表面等離子共振傳感檢測Cry2A蛋白
蔡 淼,黃 新,岳喜慶,*
(1.沈陽農業大學食品學院,遼寧 沈陽 110866;2.中國檢驗檢疫科學研究院植物檢疫研究所,北京 100029)
表面等離子共振傳感檢測Cry2A蛋白
蔡 淼1,黃 新2,岳喜慶1,*
(1.沈陽農業大學食品學院,遼寧 沈陽 110866;2.中國檢驗檢疫科學研究院植物檢疫研究所,北京 100029)
目的:建立利用表面等離子共振(surface plasmon resonance,SPR)傳感器檢測轉基因植物中蘇云金芽孢桿菌Cry2A蛋白的方法。方法:利用SPR檢測技術,根據生物分子間的相互作用,在金片表面修飾Cry2A蛋白的特異性單克隆抗體,對不同質量濃度梯度的Cry2A蛋白進行檢測研究。結果:該方法可有效地檢測到Cry2A蛋白,檢測靈敏度可達10 ng/mL,與同為抗蟲基因編碼的Cry1Ac和Cry2Ab蛋白未出現交叉反應。結論:利用SPR方法檢測Cry2A蛋白操作簡單,省時且靈敏度高、特異性強,可用于對Cry2A蛋白的定性檢測。
表面等離子共振傳感器;Cry2A蛋白;蘇云金芽孢桿菌;轉基因植物
蘇云金芽孢桿菌(Bacillus thuringiensis,Bt),是一種分布非常廣泛的革蘭氏陽性病原性細菌[1],其在芽孢形成時會產生具有殺蟲活性的晶體蛋白質[2],稱為殺蟲晶體蛋白(insecticidal crystal protein,ICP)。利用轉基因技術將Bt基因導入植物中,改良植物品種,使改良后的植物具有抗蟲基因,可有效殺滅多種害蟲[3-7]。在節省害蟲防治成本的同時,還能緩解因大量施用農藥而造成的環境污染。目前已有多種轉Bt基因農作物實現了商業化種植,如玉米、棉花、馬鈴薯、番茄等[8]。然而,由于轉基因產品的安全性問題一直備受關注,各國對于轉基因產品的種植和進口都有著嚴格的規定,因此研究出一種簡便快捷地檢測轉Bt基因作物的方法具有重要的現實意義。本研究針對Bt蛋白中的Cry2A蛋白進行檢測研究,Cry2A蛋白能同時殺滅鱗翅目害蟲和雙翅目害蟲。
表面等離子共振(surface plasmon resonance,SPR)技術是近些年得到長足發展的一項應用于分析生物分子間相互作用的檢測技術[9-14],而表面等離子共振傳感器便是基于這種技術的一種光學傳感器,它利用全反射時入射光可以和金屬表面的等離子發生共振的原理,檢測生物分子之間的相互作用與結合過程以及動力學反應[11,15-18]。相比其他檢測方法,SPR方法具有以下幾個優點:1)檢測樣品不需標記,避免了樣品因為標記不當而失去活性[19-22];2)可做到動態實時監測;3)檢測過程非常簡便且靈敏度高。目前該技術已廣泛應用于食品分析、蛋白質[23-25]與核酸檢測[26-27]、藥物篩選、臨床醫學等各個領域。本實驗便是基于這種技術,利用SPR傳感器對Bt抗蟲蛋白Cry2A進行了檢測研究。
1 材料與方法
1.1 材料、試劑與儀器
單側鍍金玻璃片(12 mm×20 mm,單側鍍金50 nm)、SPR Navi 200傳感器 芬蘭BioNavis公司;蒸餾水;無水乙醇;30%氨水、30%雙氧水均為分析純;巰基十一酸(11-mercaptoundecanoic acid,11-MUA) Sigma中國上海有限公司;3-巰基丙酸(3-mercaptopropionic acid,3-MPA)、脂肪酸甲酯磺酸鹽(fatty acid methyl ester sulfonate,MES)、N-乙基-N’-(二甲基氨基丙基)碳二亞胺(N-(3-dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride,EDC)、N-羥基琥珀酰亞胺(1-hydroxy-5-pyrrolidinedione,NHS)、Cry2A蛋白及其單克隆抗體、牛血清白蛋白(bovine serum albumin,BSA)、磷酸鹽(phosphate buffered saline,PBS)緩沖液(20 mmol/L NaH2PO4,150 mmol/L NaCl,pH7.4)、DHG-9030恒溫干燥箱 北京江陰濱江設備公司;Cry2A蛋白檢測試劑盒 美國Envirlogix公司。
1.2 方法
1.2.1 SPR金片預處理
將30%氨水、30%雙氧水、蒸餾水按照1∶1∶5的體積比混合,把金片置入其中,于水浴鍋中煮沸,溫度設置為80~90 ℃,10 min后取出,用蒸餾水及無水乙醇分別清洗金片表面,氮氣吹干表面,以便用于后續實驗。
1.2.2 SPR金片表面修飾
將10 mmol/L 3-MPA溶液與10 mmol/L 11-MUA溶液以10∶1的比例混合,把金片鍍金的一面朝上置于其中,浸泡24 h;取出金片,用蒸餾水及無水乙醇沖洗金片并用氮氣吹干,于金片表面滴加100 μL EDC(0.4 mol/L),100 μL NHS(0.1 mol/L)(EDC、NHS均用MES溶解)以活化金片表面的硫醇羧基,室溫靜置2 h后用蒸餾水及無 水乙醇清洗金片,氮氣吹干,再次滴加100 μL EDC,100 μL NHS,室溫靜置2 h;蒸餾水及無水乙醇清洗并吹干金片,金片表面滴加100 μL Cry2A單克隆抗體溶液(0.2 mg/mL,PBS稀釋),37 ℃恒溫箱中靜置3 h;蒸餾水洗去表面抗體溶液,氮氣吹干,2 mg/mL PBS稀釋,覆蓋于金片表面,室溫靜置2 h,用蒸餾水將金片表面清洗干凈,吹干,置于PBS中4 ℃保存。
1.2.3 SPR檢測樣品
取出金片,用蒸餾水洗凈,氮氣吹干,將金片放入SPR傳感器的指定位置中,打開儀器和監測軟件,通入PBS(使用前需超聲),流速為10 μL/min,待反應池及棱鏡溫度達到設置溫度后進行初始角度掃描(一般將反應溫度設置為低于室溫1~2 ℃),找到固定角后進行固定角掃描,待基線穩定后,用進樣注射器注入300 μL待測樣品溶液(PBS稀釋),通過SPR檢測軟件實時觀察反應過程。
1.2.4 酶聯免疫(enzyme-linked immunosorbent assay,ELISA)法檢測Cry2A蛋白
將Cry2A標準樣品稀釋到目標質量濃度,取100 μL加入到樣品板中,室溫靜置15 min,加入100 μL酶標抗體,室溫孵育1 h,傾去反應液,拍干,吐溫-PBS緩沖液(tween PBS,PBST)洗滌3 次,加入100 μL底物,靜置30 min,最后加入100 μL終止液,使用酶標儀讀數。
2 結果與分析
2.1 SPR檢測Cry2A蛋白的靈敏度
將待測抗原Cry2A稀釋成不同質量濃度(10~1 000 ng/mL),每種質量濃度在同一條件下重復檢測3 次,對結果進行分析,計算平均值,結果如圖1所示。進樣后約30 s開始產生響應,表明待測樣品流經金片表面時與結合在金片表面的單抗發生特異性結合,引起金片表面折射率的變化,使SPR角度發生偏移。樣品質量濃度越高,響應值越大,說明結合在金片表面的抗原越多。從實驗結果可以看出,使用SPR檢測Cry2A蛋白的最低檢測限為10 ng/mL。
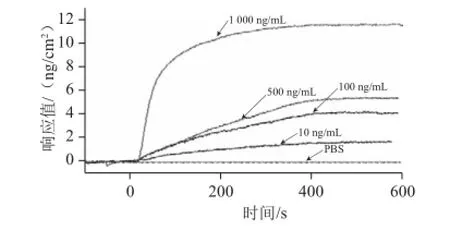
圖1 SPR檢測Cry2A蛋白的靈敏度Fig.1 Sensitivity of SPR for the detection of Cry2A protein
2.2 SPR檢測Cry2A蛋白的重復性
選取4 種不同質量濃度的Cry2A蛋白重復檢測3 次,表1結果顯示每次檢測都有明顯的反應,且同一質量濃度的響應值差異很小,隨蛋白質量濃度的降低反應響應值也相應減小,表明SPR檢測Cry2A的重復性較好。
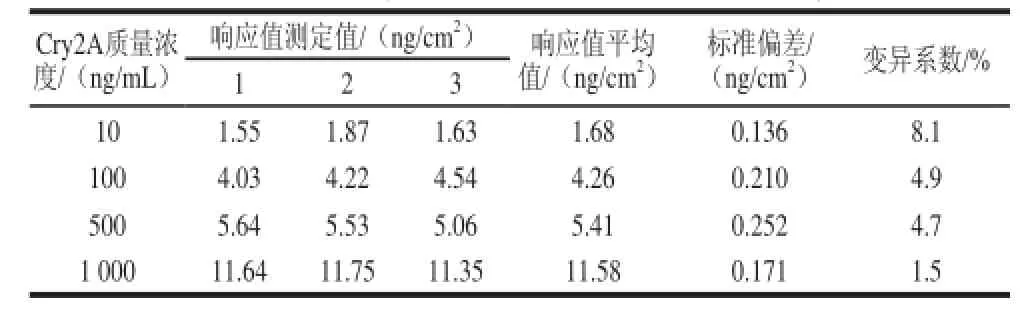
表1 SPR檢測Cry2A蛋白的重復性Table 1 Repeatability of SPR for the detection of Cry2A protein
2.3 SPR檢測Cry2A蛋白的特異性
為了驗證SPR檢測Cry2A蛋白的特異性,選用另外兩種抗蟲Bt蛋白Cry1Ac和Cry2Ab作為對照,3 種蛋白均以1 μg/mL質量濃度進樣,進行3 次特異性檢測實驗。結果如圖2所示,Cry2A蛋白有明顯響應,而Cry1Ac和Cry2Ab蛋白則未出現明顯響應,由此可見此方法檢測Cry2A蛋白具有較好的特異性。
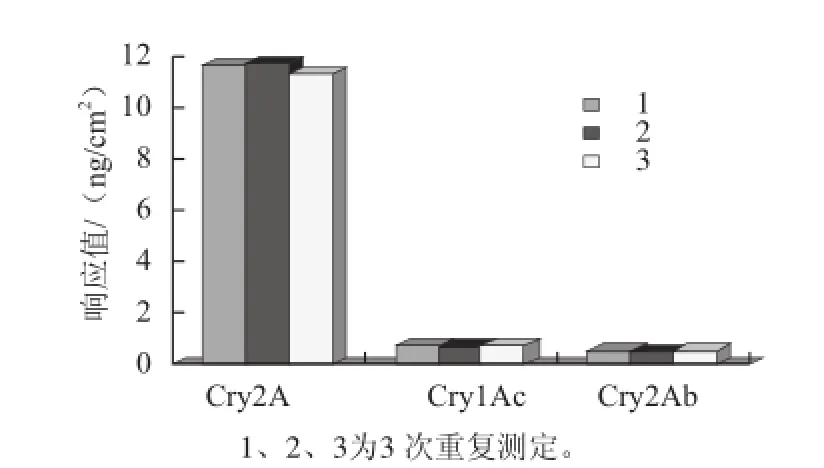
圖2 SPR檢測Cry2A蛋白的特異性Fig.2 Specificity of SPR for the detection of Cry2A protein
2.4 ELISA法檢測Cry2A蛋白
使用Cry2A檢測試劑盒對不同質量濃度的Cry2A抗原進行了檢測,每個質量濃度3 個重復,結果如表2所示。陰性樣品的OD值一般不超過0.2,超過0.2均視為陽性樣品,故ELISA法檢測Cry2A蛋白的靈敏度可達10 ng/mL,與SPR方法靈敏度相當,但SPR方法具有免標記、操作簡便、快捷的優勢。
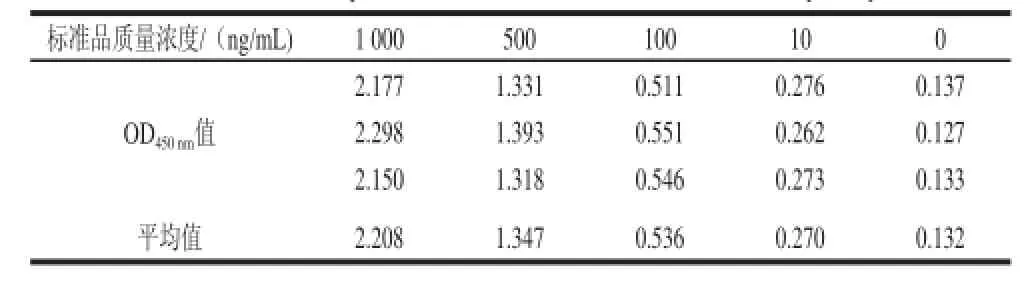
表 2 ELISA 檢測CCrryy22AA蛋白靈敏度Table 2 Sensitivity of ELISA for the detection of Cry2A protein
3 討論與結論
轉基因產品的安全問題一直備受關注,我國政府高度重視轉基因植物安全檢測工作。因此,對于轉基因產品檢測新方法的研究具有重大的現實意義。SPR傳感器是近年來迅速發展起來的新型檢測儀器。近30a來,SPR傳感器在技術發展和應用領域等方面都有很大的進步,現已成為一種檢測生物分子間相互作用的核心手段,且SPR檢測金片可反復使用30 次左右,降低了實驗成本。但SPR技術在靈敏度、多通道檢測等方面還有不足。在靈敏度方面目前SPR技術還無法準確檢測到一些低濃度、小分子質量的分子。在實現多通道檢測方面,目前SPR傳感器僅可同時檢測兩組數據。以上兩方面問題將是今后SPR檢測研究的主要方向。本實驗基于抗原抗體特異性結合的原理,運用SPR檢測技術,研究建立了Cry2A蛋白的新的檢測方法。該方法檢測靈敏度可達10 ng/mL,與傳統的ELISA檢測方法靈敏度相似,但SPR方法具有免標記、實時監測、操作省時簡便等優勢,且特異性較好,在與Cry1Ac和Cry2Ab蛋白的對照檢測中可看出,Cry1Ac和Cry2Ab蛋白未出現明顯響應,而Cry2A蛋白響應明顯。重復性實驗結果表明此方法具有較好的穩定性,可實現對Cry2A蛋白的定性檢測,為Bt蛋白的檢測提供了一種新的可行性方法。
[1] 李海濤, 姚江, 郭巍, 等. 蘇云金芽孢桿菌Cry2Aa基因的克隆、表達與活性[J]. 農業生物技術學報, 2005, 13(6): 787-791.
[2] LEE M K, PAUL M, CHEN J S. Brush border membrane binding properties of Bacillus thuringiensis Vip3A toxin to Heliothis virescens and Helicoverpa zea midguts[J]. Biochemical and Biophysical Research Communications, 2006, 339(4): 1043-1047.
[3] 徐雪亮, 韓宇, 吳剛. 轉cry1Ab/Ac, cry1C, cry2A基因水稻對田間稻縱卷葉螟及其捕食類天敵的影響[J]. 中國科學: 生命科學, 2011, 41(11): 1095-1104.
[4] 常雪, 王偉, 沈志成, 等. 轉cry1Ab/cry2Aj玉米對亞洲玉米螟的抗性評價[J]. 植物保護學報, 2013, 40(4): 339-344.
[5] 張嵐, 林克劍, 李飛, 等. 轉cry1C和cry2A不同抗蟲基因水稻品種對非靶標害蟲灰飛虱生物學特性的影響[J]. 植物保護, 2011, 37(6): 120-125.
[6] SHARON D, ROD M. Evolution ecology and management of resistance in Helicoverpa spp. to Bt cotton in Australia[J]. Journal of Invertebrate Pathology, 2012, 110(3): 281-286.
[7] LU Qiong, CAO Guangchun, ZHANG Lili, et al. The binding character of cry insecticidal proteins to the brush border membrane vesicles of Helicoverpa armigera, Spodoptera exigua, Spodoptera litura and Agrotis ipsilon[J]. Journal of Integrative Agriculture, 2013, 12(9): 1598-1605.
[8] MANN R S, GILL R S, DHAWAN A K, et al. Relative abundance and damage by target and non-target insects on Bollgard and BollgardII cotton cultivars[J]. Crop Protection, 2010, 29(8): 793-801.
[9] KANG C D, LEE S W, PARK T H, et al. Performance enhancement of real-time detection of protozoan parasite, Cryptosporidium oocyst by a modified surface plasmon resonance (SPR) biosensor[J]. Enzyme and Microbial Technology, 2006, 39(3): 387-390.
[10] CHEN X, PAN M, JIANG K. Sensitivity enhancement of SPR biosensor by improving surface quality of glass slides[J]. Microelectronic Engineering, 2010, 87(5/6/7/8): 790-792.
[11] CHUNG J W, KIM S D, BERNHARDT R. Application of SPR biosensor for medical diagnostics of human hepatitis B virus (hHBV) [J]. Sensors and Actuators B, 2005, 111/112(11): 416-422.
[12] PARK M, JOACHIM J, PYUN J C. SPR biosensor by using E. coli outer membrane layer with autodisplayed Z-domains[J]. Sensors and Actuators B: Chemical, 2011, 154(2): 82-88.
[13] WANG Jing, SONG Daqian, WANG Liying, et al. Design and performance of immunoassay based on SPR biosensor with Au/Ag alloy nanocomposites[J]. Sensors and Actuators B: Chemical, 2011, 157(2): 547-553.
[14] ZHANG Hua, SUN Ying, WANG Jing, et al. Preparation and application of novel nanocomposites of magnetic-Au nanorod in SPR biosensor[J]. Biosensors and Bioelectronics, 2012, 34(1): 137-143.
[15] MARIOTTI E, MINUNNI M, MASCINI M. Surface plasmon resonance biosensor for genetically modified organisms detection[J]. Analytica Chimica Act, 2002, 453(2): 165-172.
[16] CHABOT V, MIRON Y, CHARETTE P G, et al. Identification of the molecular mechanisms in cellular processes that elicit a surface plasmon resonance (SPR) response using simuLtaneous surface plasmon-enhanced fluorescence (SPEF) microscopy[J]. Biosens Bioelectron, 2013, 50(15): 125-131.
[17] SUN Ying, BI Ning, SONG Daqian, et al. Preparation of titania sol-gel matrix for the immunoassay by SPR biosensor with magnetic beads[J]. Sensors and Actuators B: Chemical, 2008, 134(2): 566-572.
[18] SHIN Y B, KIM H M, JUNG Y W, et al. A new palm-sized surfaceplasmon resonance (SPR) biosensor based on modulation of a light source by a rotating mirror[J]. Sensors and Actuators B: Chemical, 2010, 150(1): 1-6.
[19] KANG C D, LEE S W, PARK T Y, et al. Performance enhancement of real-time detection of protozoan parasite, Cryptosporidium oocyst by a modified surface plasmon resonance (SP R) biosensor[J]. Enzyme and Microbial Technology, 2006, 39(3): 387-390.
[20] MANERA M G, FERREIRO-VILA E, GARCIA-MARTIN J M, et al. Enhanced magneto-optical SPR platform for amine sensing based on Zn p orphyrin dimers[J]. Sensors and Actuators B: Chemical, 2013, 182: 232-238.
[21] CHEN X, PAN M, JIANG K. Sensitivity enhancement of SPR biosensor by improving surface quality of glass slides[J]. Microelectronic Enginee ring, 2010, 87(5/6/7/8): 790-792.
[22] KAROONUTHAISIRI N, CHARLERMROJ R, MORTON M J, et al. Development of a M13 bacteriophage-based SPR detection using Salmonella as a case study[J]. Sensors and Actuators B: Chemical, 2014, 190: 214-220.
[23] SOTA H, HASEGAWA Y, IWAKURA M. Detection of conformational changes in an immobilized protein using surface plasmon resonance[J]. Analytical Chemistry, 1998, 70(10): 2019-2024.
[24] MASSARELLI. Computational modeli ng and surface plasmon resonance analyses in the assessment of peptide ligands interacting with fibrin gamma(312-324)epitope[J]. European Journal Medicinal Chemistry, 2009, 44(5): 2128-2134.
[25] COCHRAN S, LI C P, FERRO V. A surface plasmon resonancebased solution affinity assay for heparan sulfate-binding proteins[J]. Glycoconjugate Journal, 2009, 26(5): 577-587.
[26] MONTEIRO J P, FERREIRA J, SABAT R G, et al. SPR based biosensor using surface relief grating in transmission mode[J]. Sensors and Actuators B: Chemical, 2012, 174: 270-273.
[27] NAKAMURA K, SAKAGAMI H, ASANUMA-DATE K, et al. Immobilized glycosylated Fmoc-amino acid for SPR: comparative studies of lectin-binding to linear or biantennary dilacNAc structures[J]. Carbohydrate Research, 2013, 382(15): 77-85.
Using a Surface Plasmon Resonance Sensor for the Detection of Bacillus thuringiensis Cry2A Protein
CAI Miao1, HUANG Xin2, YUE Xi-qing1,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. Institute of Plant Quarantine, Chinese Academy of Inspection and Quarantine, Beijing 100029, China)
Purpose: To establish a method to detect Bacillus thuringiensis (Bt) Cry2A protein by surface plasmon resonance (SPR) sensor. Methods: By using SPR based on interaction between biomolecules, the monoclonal antibodies specific to the Cry2A protein were modified on the gold surface for the detection of this protein. Results: The detection limit of Cry2A protein was 10 ng/mL by this method without cross-reaction with Cry1Ac or Cry2Ab protein. Conclusion: The SPR method was simple, time-saving, sensitive, specific and applicable for the qualitative detection of Bt Cry2A protein.
surface plasmon resonance sensor; Cry2A protein; Bacillus thuringiensis; genetically modified plant
Q31
A
1002-6630(2014)24-0201-04
10.7506/spkx1002-6630-201424038
2014-01-17
質檢公益性行業科研專項(201410014)
蔡淼(1987—),女,碩士研究生,研究方向為轉基因檢測。E-mail:779302469@qq.com
*通信作者:岳喜慶(1966—),男,教授,博士,研究方向為畜產品加工。E-mail:yxqsyau@126.com

