含迷迭香的蛋白基薄膜對(duì)高氧氣調(diào)包裝生鮮豬肉的護(hù)色及抗氧化作用
李大虎,應(yīng)麗莎,程玉嬌,張 敏*
(西南大學(xué)食品科學(xué)學(xué)院,農(nóng)業(yè)部農(nóng)產(chǎn)品貯藏保鮮質(zhì)量安全風(fēng)險(xiǎn)評(píng)估實(shí)驗(yàn)室(重慶),重慶市特色食品工程技術(shù)研究中心,重慶 400715)
含迷迭香的蛋白基薄膜對(duì)高氧氣調(diào)包裝生鮮豬肉的護(hù)色及抗氧化作用
李大虎,應(yīng)麗莎,程玉嬌,張 敏*
(西南大學(xué)食品科學(xué)學(xué)院,農(nóng)業(yè)部農(nóng)產(chǎn)品貯藏保鮮質(zhì)量安全風(fēng)險(xiǎn)評(píng)估實(shí)驗(yàn)室(重慶),重慶市特色食品工程技術(shù)研究中心,重慶 400715)
以不同質(zhì)量濃度迷迭香與大豆分離蛋白復(fù)合制備活性蛋白膜,并將該蛋白膜用于高氧氣調(diào)下生鮮豬肉的護(hù)色保鮮。分析豬肉貯藏期間CIE a*值、正鐵肌紅蛋白、硫代巴比妥酸反應(yīng)(thiobarbituric acid reactive substances,TBARS)值、蛋白質(zhì)羰基及肉品硬度的變化情況。結(jié)果表明:肉樣表面噴灑0.05 g/100 mL迷迭香提取物有效抑制了高氧氣調(diào)包裝肉品的脂類氧化和貯藏后期的顏色劣變。而蛋白膜加入不同質(zhì)量濃度迷迭香對(duì)高氧氣調(diào)包裝的豬肉表現(xiàn)出不同的抗氧化活性。純蛋白膜和0.025 g/100 mL迷迭香包裝組對(duì)豬肉沒有表現(xiàn)出護(hù)色作用,但對(duì)豬肉貯藏期間脂類和蛋白質(zhì)的氧化起到了一定的抑制作用;0.1、0.2 g/100 mL迷迭香包裝組有效延緩了豬肉a*值的下降和正鐵肌紅蛋白、TBARS值的生成,且其對(duì)豬肉的護(hù)色效果好于迷迭香直接噴灑處理,但無法抑制蛋白質(zhì)羰基的形成。而0.05 g/100 mL迷迭香包裝組在整個(gè)貯藏期間對(duì)豬肉顏色、脂類、蛋白質(zhì)等的抗氧化效果均好于迷迭香直接噴灑處理,且基本維持了肉品貯藏期間的硬度,這表明蛋白膜對(duì)迷迭香的包埋顯著提高了迷迭香對(duì)高氧氣調(diào)下豬肉的抗氧化活性。
迷迭香;大豆分離蛋白;高氧氣調(diào);抗氧化;豬肉
顏色是生鮮豬肉最重要的外觀屬性之一,直接影響消費(fèi)者的購買欲望[1]。肉品在沒有腐敗的情況下顏色也會(huì)變暗、變褐,導(dǎo)致銷售困難,給生產(chǎn)廠家和銷售商造成巨大的經(jīng)濟(jì)損失[2]。高氧氣調(diào)包裝通常應(yīng)用于生鮮肉品使肉品呈現(xiàn)吸引人的紅色,但高體積分?jǐn)?shù)氧氣也會(huì)促使肉品色素、脂類等發(fā)生氧化反應(yīng),導(dǎo)致肉品品質(zhì)劣變[3]。天然植物提取物如迷迭香被認(rèn)為是一種天然高效的抗氧化劑,主要通過提供氫離子中斷脂肪自動(dòng)氧化的自由基反應(yīng)鏈。迷迭香對(duì)肉品的抗氧化作用已被廣泛報(bào)道[4-7]。目前,迷迭香等抗氧化劑的添加方式主要采用與肉制品直接混合或配成溶液對(duì)肉品進(jìn)行噴灑、浸漬等處理,然而直接添加可能導(dǎo)致迷迭香與食品成分發(fā)生中和及分解等一系列復(fù)雜反應(yīng)從而很快被消耗殆盡,噴灑或浸漬處理則會(huì)使迷迭香從表面擴(kuò)散進(jìn)入食品內(nèi)部,導(dǎo)致食品表面有效質(zhì)量濃度降低,活性下降,這對(duì)于表面不致密的食品如新鮮肉品而言尤為突出[8],大大降低了迷迭香對(duì)肉品表面的抗氧化效用。
為了改善傳統(tǒng)添加方式導(dǎo)致的迷迭香抗氧化作用的降低,一種新型的貯藏方式如活性包裝能有效增強(qiáng)迷迭香對(duì)生鮮豬肉抗氧化作用的有效性和持續(xù)性。活性包裝指的是包裝材料內(nèi)加入抗菌劑或抗氧化劑等活性物質(zhì)使材料能積極作用于食品或包裝內(nèi)環(huán)境[9],起到維持或提高食品品質(zhì)的目的。當(dāng)前,眾多研究集中于活性材料的制備及性能表征[10-12],僅有少量研究報(bào)道了活性薄膜在食品中的運(yùn)用。de Abreu等[9]報(bào)道聚乙烯薄膜涂覆抗氧化劑延緩了鯊魚冷凍貯藏期間的脂類水解,并增加了其抗氧化穩(wěn)定性。Wu等[13]發(fā)現(xiàn)聚乙烯醇-淀粉膜摻雜兒茶素抑制了牛肉的脂類氧化。Nerín等[14]也報(bào)道,將不同質(zhì)量濃度的迷迭香固定在聚丙烯薄膜,有效延緩了高氧氣調(diào)包裝的牛肉(metmyoglobin,MetMb)和硫代巴比妥酸反應(yīng)(thiobarbituric acid reactive substances,TBARS)值的形成,且該活性薄膜對(duì)肉品的抗氧化作用達(dá)到了迷迭香直接添加的作用效果。
近幾年,隨著對(duì)環(huán)保包裝材料的迫切需求,可降解生物聚合物材料如蛋白質(zhì)類越來越受到研究者的普遍關(guān)注。大豆分離蛋白作為一種應(yīng)用較為廣泛的蛋白質(zhì)原料,具有優(yōu)秀的成膜能力,且價(jià)格低廉。相比于其他植物蛋白,由大豆分離蛋白制備的薄膜具有更好的柔韌性、光滑度、水溶性和清晰度[15]。本研究者利用大豆分離蛋白摻雜迷迭香制備活性蛋白膜,探索蛋白膜對(duì)高氧氣調(diào)下生鮮豬肉顏色變化和抗氧化穩(wěn)定性的影響,為評(píng)估迷迭香活性包裝對(duì)豬肉的護(hù)色及抗氧化效果及其在食品工業(yè)等領(lǐng)域的應(yīng)用提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
豬通脊肉 市購;迷迭香粉末 海南舒普生物科技有限公司;大豆分離蛋白(>85%) 北京奧博星生物技術(shù)有限責(zé)任公司。
乙酸乙酯、丙三醇、2,4-二硝基苯肼、三氯乙酸、硫代巴比妥酸(均為分析純) 成都科龍化工試劑廠;丙二醛二乙縮醛、鹽酸胍(均為分析純) 北京大田豐拓化學(xué)技術(shù)有限公司。
1.2 儀器與設(shè)備
MAP-500D袋式氣調(diào)包裝機(jī) 上海一恒科學(xué)儀器有限公司;GL-20G-Ⅱ高速冷凍離心機(jī) 上海安亭科學(xué)儀器廠;1-15 PK冷凍離心機(jī) 德國Sigma公司;5810臺(tái)式高速離心機(jī) 德國Eppendorf公司;UV-2450PC紫外-可見分光光度計(jì) 日本島津公司;PHS-3C pH計(jì) 上海精科有限公司;JJ-1精密增力電動(dòng)攪拌器常州博遠(yuǎn)實(shí)驗(yàn)分析儀器廠;TA.XT2i物性測(cè)定儀 英國Stable Micro System 公司;UltraScan?PRO測(cè)色儀 美國HunterLab公司。
1.3 方法
1.3.1 蛋白基薄膜制備
大豆分離蛋白溶液參照Cho等[15]方法制備。將5 g大豆分離蛋白緩慢溶解于100 mL蒸餾水中,分別加入1.25 g甘油和山梨醇,充分?jǐn)嚢瑁肗aOH溶液調(diào)整該混合體系pH值為10,然后置于70 ℃水浴中加熱攪拌30 min。迷迭香用無水乙醇溶解加入到成膜溶液中,配成迷迭香質(zhì)量濃度分別為0、0.025、0.05、0.1、0.2 g/100 mL的5 組成膜溶液,分別記為spi、sr250、sr500、sr1000、sr2000。取一定量膜液流延于聚丙烯塑料板上,置于室溫條件下干燥過夜。揭膜后于50%相對(duì)濕度環(huán)境中保存,備用。選取厚度為(62.22±6.48) mm的薄膜用于實(shí)驗(yàn)。
1.3.2 肉樣制備
將豬通脊肉剔除可見脂肪,用無菌手術(shù)刀切成1.5 cm厚的肉排,暴露在空氣中1 h(4 ℃)使其充分熟化[16]。對(duì)部分肉樣表面噴灑0.05 g/100 mL迷迭香提取物(記為r500),其余樣品用含不同迷迭香質(zhì)量質(zhì)量濃度的大豆蛋白膜包裹,對(duì)照組樣品(記為Con)不作處理。
所有肉樣均置于18.5 cm×11.5 cm×2.5 cm的聚苯乙烯塑料托盤內(nèi),用0.1 mm厚的聚酰胺-聚乙烯復(fù)合袋進(jìn)行80% O2/20% CO2氣調(diào)包裝,頂空與內(nèi)容物比率為1∶1[17]。最后,將樣品放置在超市標(biāo)準(zhǔn)熒光燈下于4 ℃貯藏12 d,每3 d取樣進(jìn)行分析。
1.3.3 指標(biāo)測(cè)定
1.3.3.1 表面顏色測(cè)定
參照Rubio等[18]方法。根據(jù)CIE L*a*b*顏色標(biāo)準(zhǔn)采用色差儀于室溫條件下測(cè)得。使用D65照明光源,10°標(biāo)準(zhǔn)觀察角。每個(gè)樣品取上表面均勻分布的6 處不同位置進(jìn)行測(cè)量并求其平均值。同時(shí)用式(1)計(jì)算肉品的色相(Hue):

1.3.3.2 MetMb含量測(cè)定
參照Krzywicki[19]方法。MetMb用冷的0.04 mol/L、pH 6.8的磷酸鹽緩沖液提取,樣品和緩沖液的比例為1∶10。樣品勻漿以50 000×g離心30 min(5 ℃),吸取上清液在525、545、565、572 nm波長(zhǎng)處測(cè)其吸光度。不同形態(tài)肌紅蛋白所占百分比由公式(2)、(3)得出[19]:
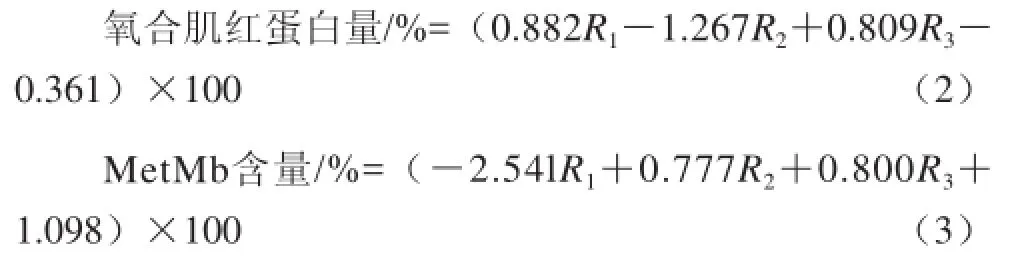
式中:R1、R2和R3分別是吸光度比值A(chǔ)572nm/A525nm、A565 nm/A525 nm和A545 nm/A525 nm。
1.3.3.3 脂肪氧化測(cè)定
參照S?rensen等[20]方法。檢測(cè)豬肉脂肪氧化的次級(jí)產(chǎn)物丙二醛的含量。取5 g肉樣加入到15 mL 7.5%三氯乙酸溶液中充分混勻,過濾。濾液與同體積0.02 mol/L硫代巴比妥酸混合,100 ℃水浴40 min,用流動(dòng)的自然水冷卻至室溫。取上清液在532 nm波長(zhǎng)處比色。用丙二醛二乙縮醛作丙二醛標(biāo)準(zhǔn)曲線,由曲線可得出樣品的TBARS值。
1.3.3.4 蛋白質(zhì)氧化測(cè)定
參照Oliver等[21]方法。取1 g豬肉在磷酸鹽緩沖液中高速勻漿,移取兩份等量提取液分別與20%三氯乙酸反應(yīng)。其中一份用0.2%二硝基苯肼處理,另一份用2 mol/L HCl作空白對(duì)照。體系置于25 ℃水浴反應(yīng)30 min,再加1 mL三氯乙酸,冷凍高速離心15min,棄上清液。沉淀經(jīng)乙醇-乙酸乙酯(1∶l,V/V)洗滌3 次后溶解于6 mol/L鹽酸胍溶液中,于370 nm波長(zhǎng)處測(cè)定其吸光度。總蛋白質(zhì)含量通過測(cè)定HCl空白組在280nm波長(zhǎng)處的吸光度,并以牛血清白蛋白作標(biāo)準(zhǔn)曲線計(jì)算可得。結(jié)果用每毫克蛋白質(zhì)中含有與二硝基苯肼結(jié)合的蛋白濃度表示。
1.3.3.5 硬度的測(cè)定
參照Martinez等[22]方法。采用物性儀對(duì)肉樣進(jìn)行壓縮實(shí)驗(yàn),測(cè)試使用直徑5 mm的不銹鋼圓柱形探頭,測(cè)前、測(cè)中和測(cè)后速率分別為2、1、5 mm/s,壓縮比為50%,2 次下壓時(shí)間間隔為5 s,測(cè)試時(shí)力的方向與肌纖維方向垂直。
1.4 數(shù)據(jù)分析
使用SPSS 13.0軟件對(duì)各指標(biāo)進(jìn)行單因素方差分析。
2 結(jié)果與分析
2.1 表面顏色變化
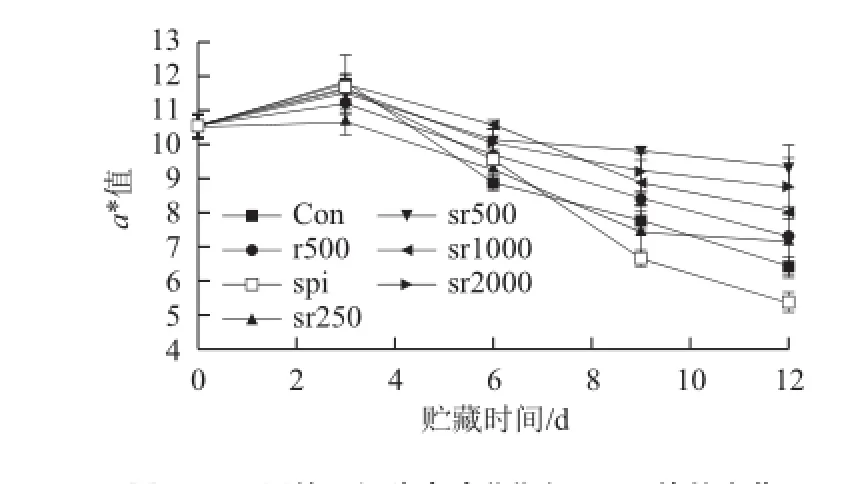
圖1 不同處理組豬肉冷藏期間CIE a*值的變化Fig.1 Changes in CIE a* in fresh pork with different treatments during chilled storage
如圖1所示,對(duì)照組肉品在貯藏前3 d a*值顯著增加(P<0.01),這是由于豬肉的肌紅蛋白在高氧環(huán)境中與O2結(jié)合生成了亮紅色的氧合肌紅蛋白,Martinez等[23]也報(bào)道80% O2能顯著增加香腸貯藏前期的a*值。但是,高氧氣調(diào)包裝的肉品到貯藏后期顏色會(huì)發(fā)生急劇褐變。本實(shí)驗(yàn)中對(duì)照組肉品在第9天a*值已降到8以下,而r500處理組從第9天開始a*值明顯大于對(duì)照組(P<0.05),說明迷迭香的添加有效改善了高體積分?jǐn)?shù)氧氣在貯藏后期引發(fā)的氧化問題。但是,噴灑在肉品表面迷迭香由于其反應(yīng)消耗或擴(kuò)散行為,隨著貯藏時(shí)間的延長(zhǎng)其有效質(zhì)量濃度逐漸降低,而將一定量迷迭香包埋于大豆分離蛋白薄膜中,可以實(shí)現(xiàn)迷迭香的緩慢釋放或在薄膜內(nèi)部的持續(xù)作用。由圖1可知,spi和sr250兩組沒有表現(xiàn)對(duì)高氧氣調(diào)下生鮮豬肉的護(hù)色作用,而且,純蛋白膜包裹加速了肉品貯藏后期顏色的劣變(P<0.01),這可能是由于蛋白膜對(duì)氧氣有一定的阻隔能力,且低質(zhì)量濃度迷迭香加入到蛋白質(zhì)中對(duì)蛋白膜結(jié)構(gòu)的影響較小,故spi和sr250兩組降低了豬肉表面的氧分壓,不利于豬肉顏色的穩(wěn)定。而sr500、sr1000和sr2000三組從第6天開始a*值明顯大于對(duì)照組(P<0.01),其中sr500和sr2000兩組從第9天開始對(duì)豬肉的作用效果明顯好于r500(P<0.01),到貯藏末期兩組肉品的a*值仍維持在9以上。本實(shí)驗(yàn)中r500為高氧氣調(diào)下迷迭香對(duì)生鮮豬肉的最佳抗氧化質(zhì)量濃度(由前期實(shí)驗(yàn)得出)。這說明大豆蛋白薄膜中適量包埋迷迭香能顯著增加迷迭香對(duì)豬肉的護(hù)色效果。Nerín等[14]指出迷迭香活性薄膜包裝延緩了高氧氣調(diào)下牛肉a*值的下降,但活性薄膜對(duì)肉品顏色的抗氧化作用并不依賴于迷迭香的質(zhì)量濃度,這與本實(shí)驗(yàn)的結(jié)果相似。
2.2 MetMb含量的變化
由圖2可知,各組豬肉MetMb的含量均隨貯藏時(shí)間的延長(zhǎng)而增加(P>0.05),迷迭香噴灑處理從第6天開始有效延緩了豬肉MetMb的形成(P<0.05),純蛋白膜包裹的肉品在前6 d有較低的MetMb含量,之后急劇增加,到第9天MetMb值已接近55%,這與圖1所示spi處理組肉品到第9天a*值的迅速降低相一致,表明純蛋白膜包裹促使豬肉在貯藏后期發(fā)生嚴(yán)重褐變。而蛋白膜包埋不同質(zhì)量濃度迷迭香對(duì)豬肉貯藏期間MetMb的形成產(chǎn)生了不同的作用效果。sr250并沒有表現(xiàn)出對(duì)MetMb的抑制作用,相反,sr250處理組肉品在前3d MetMb值明顯大于對(duì)照組(P<0.01)。而sr500、sr1000和sr2000三個(gè)處理組則顯示出蛋白膜與迷迭香的協(xié)同作用,這3組肉品在整個(gè)貯藏期間MetMb含量均低于迷迭香直接噴灑處理的肉品(P>0.05),其中sr500處理組從第6天開始MetMb值明顯低于r500(P<0.01),而sr2000和sr1000分別在第9天和第12天與r500處理組表現(xiàn)出明顯差異(P<0.01)。這說明迷迭香活性薄膜對(duì)MetMb的抗氧化能力與迷迭香的質(zhì)量濃度并不成比例,Nerín等[14]利用聚丙烯和迷迭香共擠制備活性薄膜,發(fā)現(xiàn)該活性薄膜對(duì)牛肉MetMb的抑制作用并不依賴于薄膜中添加的迷迭香質(zhì)量濃度。而Camo等[24]采用涂覆方式得到的活性薄膜對(duì)肉品MetMb的抑制作用隨薄膜中牛至屬提取物含量的增加而增大。這可能是因?yàn)橹颇し绞健⒒钚猿煞帧⒊赡ぽd體等均會(huì)影響活性薄膜的結(jié)構(gòu),從而使薄膜內(nèi)活性成分的行為方式受到影響,而薄膜的最佳抗氧化效果體現(xiàn)在活性成分對(duì)自由基的一個(gè)恰當(dāng)?shù)那宄俾省?/p>

圖2 不同處理組豬肉冷藏期間MetMb含量的變化Fig.2 Changes in metmyoglobin content in pork with different treatments during chilled storage
2.3 脂肪氧化
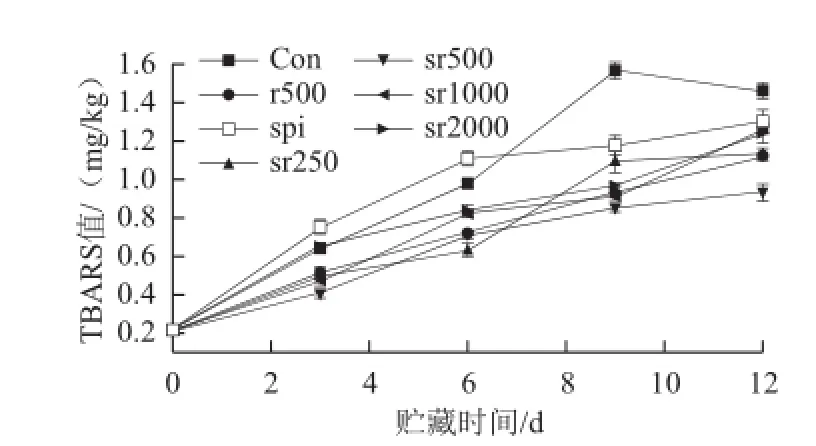
圖3 不同處理組豬肉冷藏期間脂肪次級(jí)氧化產(chǎn)物TBARS值的變化Fig.3 Changes in secondary lipid oxidation products measured as TBARS in pork with different treatments during chilled storage
由圖3可知,對(duì)照組肉品前9 d TBARS值急劇增加(P<0.01),但到第12天開始下降(P<0.05),這可能是由于貯藏末期脂肪氧化的次級(jí)產(chǎn)物被大量分解成小分子物質(zhì),故降低了豬肉的TBARS值。實(shí)驗(yàn)發(fā)現(xiàn)純蛋白膜包裹的肉品前6d TBARS值大于對(duì)照組(P<0.05),但之后呈緩慢上升趨勢(shì),延緩了高氧氣調(diào)環(huán)境中豬肉在貯藏后期TBARS值的形成。而迷迭香與蛋白膜復(fù)合形成的活性薄膜提高了蛋白膜對(duì)豬肉脂肪的抗氧化能力。其中sr250、sr500和sr1000三組活性薄膜包裹的肉品在整個(gè)貯藏期間TBARS值均明顯低于對(duì)照組(P<0.01),sr2000從第6天開始明顯抑制了TBARS值的快速生成(P<0.01)。實(shí)驗(yàn)發(fā)現(xiàn)sr500對(duì)脂肪TBARS值的抑制作用明顯大于sr2000(P<0.01)。這是因?yàn)樵谥苽涞幕钚员∧ぶ校缘惚环稚⒉⒐潭ㄓ诘鞍踪|(zhì)的網(wǎng)絡(luò)結(jié)構(gòu)中,迷迭香分子通過從薄膜遷移到肉品表面或在薄膜內(nèi)部吸附豬肉產(chǎn)生的氧化產(chǎn)物而達(dá)到清除自由基的目的,薄膜中裝載的迷迭香的量不同,導(dǎo)致薄膜的微觀結(jié)構(gòu)出現(xiàn)差異,從而影響迷迭香對(duì)自由基的清除速率,故薄膜的抗氧化活性的強(qiáng)弱與迷迭香質(zhì)量濃度的高低并無直接聯(lián)系。
由圖3可知,迷迭香噴灑處理明顯抑制了豬肉的脂類氧化(P<0.01),但r500對(duì)豬肉TBARS值的抑制作用介于sr500和sr2000之間。實(shí)驗(yàn)發(fā)現(xiàn)sr500處理組肉品在整個(gè)貯藏期間TBARS值均低于r500處理組,且兩者從第9天開始表現(xiàn)出明顯差異(P<0.01),這說明蛋白膜對(duì)適量迷迭香的包埋可以增強(qiáng)迷迭香對(duì)生鮮豬肉脂肪的抗氧化能力,而且,本實(shí)驗(yàn)也可以說明對(duì)于相同質(zhì)量濃度迷迭香,蛋白膜的包埋可以增加迷迭香的抗氧化活性。而Camo等[25]報(bào)道相比迷迭香活性薄膜,迷迭香直接添加對(duì)高氧氣調(diào)下羊肉TBARS值起到了更好的的抑制作用,這可能是由于活性膜的迷迭香沒有達(dá)到最適質(zhì)量濃度。
2.4 蛋白質(zhì)氧化
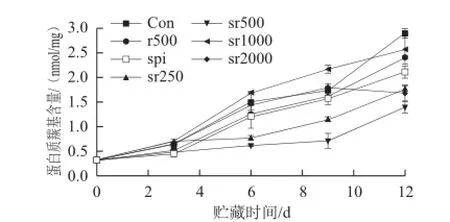
圖4 不同處理組豬肉冷藏期間蛋白質(zhì)羰基含量的變化Fig.4 Changes in protein oxidation products measured as carbonyl content in pork with different treatments during chilled storage
由圖4可知,迷迭香直接噴灑和純蛋白膜包裹均減少了肉品貯藏期間蛋白質(zhì)羰基的生成量(P>0.05),且兩個(gè)處理組在第12天蛋白質(zhì)羰基含量明顯低于對(duì)照組(P<0.01),其中spi對(duì)蛋白質(zhì)羰基的抑制效果略好于r500(P>0.05)。實(shí)驗(yàn)發(fā)現(xiàn)sr1000雖然對(duì)肉品的MetMb和脂肪表現(xiàn)出良好的抗氧化能力,但是對(duì)蛋白質(zhì)羰基的抑制效果不大,sr1000處理組肉品在前9d蛋白質(zhì)羰基含量略大于對(duì)照組(P>0.05),到第9天兩者出現(xiàn)明顯差異(P<0.05)。sr2000處理組在貯藏前期與對(duì)照組并無明顯差異,到第12天才表現(xiàn)出對(duì)蛋白質(zhì)羰基的抑制作用(P<0.01)。而蛋白膜包埋低質(zhì)量濃度迷迭香即sr250和sr500兩個(gè)處理組從第6天開始蛋白質(zhì)羰基含量遠(yuǎn)遠(yuǎn)低于r500和對(duì)照組(P<0.01),對(duì)肉品蛋白質(zhì)表現(xiàn)出優(yōu)秀的抗氧化能力。sr250雖然無法延緩豬肉a*值的下降和MetMb的形成,但豬肉TBARS值和蛋白質(zhì)羰基的生成均起到了一定的抑制作用,這可能是由sr250薄膜中迷迭香的抗氧化作用與薄膜對(duì)氧氣的阻隔作用共同決定的。此外,sr500處理組肉品在整個(gè)貯藏期間蛋白質(zhì)羰基的含量明顯低于sr250(P<0.01),到貯藏末期蛋白質(zhì)羰基含量仍在1.5 nmol/mg以下。
2.5 硬度的變化
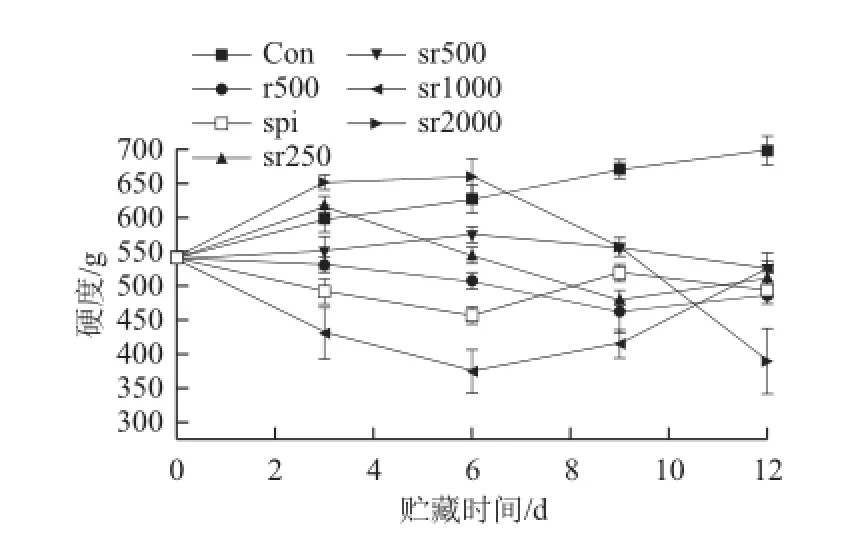
圖5 不同處理組豬肉冷藏期間硬度的變化Fig.5 Changes in hardness in fresh pork with different treatments during chilled storage
如圖5所示,對(duì)照組肉品在高氧環(huán)境中硬度變大(P<0.05)。大量研究[26-28]報(bào)道高氧氣調(diào)對(duì)肉品嫩度產(chǎn)生不利影響,這與本實(shí)驗(yàn)結(jié)果一致。Lund等[26]認(rèn)為高氧氣調(diào)引起的蛋白質(zhì)氧化促使肌球蛋白通過二硫鍵形成分子間交聯(lián),從而使肉品變硬,而且氧化也會(huì)影響蛋白水解酶的活性,繼而阻止肉品的嫩化。由圖5可知,純蛋白膜包裹的肉品前6 d硬度下降,第9天硬度回升,到貯藏末期基本維持在500 g左右。而sr1000處理組肉品貯藏6d后硬度下降到400 g以下,明顯低于spi處理組,但之后硬度開始上升,這可能是由蛋白質(zhì)氧化造成的。由圖4可知,sr1000無法抑制豬肉蛋白質(zhì)羰基的生成,蛋白質(zhì)降解可能導(dǎo)致豬肉硬度下降,而蛋白質(zhì)的聚集或蛋白分子間的交聯(lián)可能又促使sr1000處理組肉品后期硬度值增加。與對(duì)照組相比,sr2000則增加了肉品貯藏前期的硬度(P>0.05),到第3天已達(dá)到650 g左右,明顯大于對(duì)照組肉品(P<0.01),但該處理組肉品貯藏6 d后硬度急劇下降,到貯藏末期肉品硬度降到400 g以下。實(shí)驗(yàn)發(fā)現(xiàn)r500和sr500兩個(gè)處理組有效抑制了高氧氣調(diào)包裝的肉品硬度的增加(P<0.01),其中sr500基本維持肉品的硬度在初始狀態(tài),r500處理組從第6天開始硬度明顯低于sr500(P<0.01)。而sr250處理組雖然前3 d硬度略有增加,但與對(duì)照組相比差異并不顯著(P>0.05),且sr250處理組從第6天開始豬肉的硬度介于sr500和r500之間。
3 結(jié) 論
純蛋白膜包裹無法延緩豬肉顏色的劣變和MetMb的生成,但在貯藏后期對(duì)TBARS值和蛋白質(zhì)羰基起到了一定的抑制作用。蛋白膜加入不同質(zhì)量濃度迷迭香對(duì)生鮮豬肉表現(xiàn)出不同的抗氧化效果。sr250(0.025 g/100 mL)對(duì)豬肉的顏色和MetMb沒有表現(xiàn)出抗氧化作用,但明顯抑制了豬肉脂類和蛋白質(zhì)氧化。sr1000(0.1g/100mL)和sr2000(0.2 g/100 mL)兩個(gè)處理組對(duì)豬肉的顏色、MetMb、TBARS值起到了良好的抑制作用,且兩組對(duì)豬肉的護(hù)色作用達(dá)到甚至超過了迷迭香直接添加的作用效果,但sr1000和sr2000對(duì)豬肉蛋白質(zhì)羰基的生成沒有起到明顯的抑制作用,也無法維持肉品貯藏期間的硬度。這可能是由于豬肉的蛋白質(zhì)和脂類在氣調(diào)貯藏環(huán)境中表現(xiàn)的氧化機(jī)制不同,兩者可能并無直接聯(lián)系[29]。而sr500(0.05g/100mL)在整個(gè)貯藏期間對(duì)豬肉顏色和硬度的維持及對(duì)肉品脂類、蛋白質(zhì)等的抗氧化作用均好于r500(0.05g/100mL噴灑),且隨著貯藏時(shí)間的延長(zhǎng),迷迭香與大豆分離蛋白的復(fù)合表現(xiàn)出明顯的優(yōu)勢(shì)。
通過對(duì)比活性蛋白膜和迷迭香直接噴灑對(duì)豬肉護(hù)色和抗氧化效果的影響,可以得出大豆分離蛋白加入適量迷迭香對(duì)豬肉的抗氧化效果可以達(dá)到甚至超過迷迭香直接添加的作用效果,而且對(duì)于相同質(zhì)量濃度迷迭香,大豆蛋白膜的包埋可以增強(qiáng)迷迭香的活性。但是活性蛋白膜對(duì)豬肉抗氧化作用的機(jī)理并不清晰。本實(shí)驗(yàn)中使用的是脂溶性迷迭香,根據(jù)相似相容原理,迷迭香可能由于布朗運(yùn)動(dòng)從蛋白膜的網(wǎng)絡(luò)結(jié)構(gòu)中擴(kuò)散遷移到肉品表面,從而實(shí)現(xiàn)對(duì)豬肉的抗氧化作用。而生鮮豬肉本身含有的水分使包裹的蛋白膜發(fā)生溶脹,薄膜中聚合物的流動(dòng)性增加,也可能促使迷迭香擴(kuò)散行為的發(fā)生。Granda-Restrepo等[30]報(bào)道生育酚從多層活性薄膜中遷移到食品表面從而延緩了全脂奶粉的脂類氧化。但迷迭香也可能被固定于大豆分離蛋白膜內(nèi),在薄膜表面或內(nèi)部實(shí)現(xiàn)對(duì)自由基的清除能力。Tovar等[31]研究迷迭香提取物從活性塑料薄膜向模擬物的遷移行為,發(fā)現(xiàn)迷迭香的遷移量非常低。而Nerín等[32]報(bào)道活性薄膜能夠通過吸收頂空中的活性氧,從而起到清除自由基的目的。
此外,研究報(bào)道蛋白膜在低濕環(huán)境中對(duì)氧氣具有優(yōu)秀的阻隔能力[33],雖然生鮮豬肉包裝內(nèi)具有較高的濕度環(huán)境,但蛋白膜的包裹可能還是會(huì)對(duì)豬肉表面的氧氣體積分?jǐn)?shù)產(chǎn)生影響。而且大豆分離蛋白中含有的酪氨酸、苯丙氨酸和色氨酸對(duì)300 nm波長(zhǎng)以下的光線具有較強(qiáng)的吸收能力[34],因此,大豆蛋白膜對(duì)氧氣和紫外線的阻隔能力也可能對(duì)豬肉脂類蛋白質(zhì)的氧化起到了一定的抑制作用。
[1] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121.
[2] 應(yīng)麗莎, 劉星, 周曉慶, 等. 肉類產(chǎn)品護(hù)色技術(shù)研究進(jìn)展[J]. 食品科學(xué), 2011, 32(3): 291-295.
[3] 應(yīng)麗莎, 趙東方, 傅陽, 等. 迷迭香與高氧氣調(diào)對(duì)生鮮豬肉的護(hù)色及抗氧化效果[J]. 食品科學(xué), 2013, 34(2): 256-261.
[4] HERNANDEZ-HERNANDEZ E, PONCE-ALQUICIRA E, JARAMILLO-FLORES M E, et al. Antioxidant effect rosemary (Rosmarinus officinalis L.) and oregano (Origanum vulgare L.) extracts on TBARS and colour of model raw pork batters[J]. Meat Science, 2009, 81(2): 410-417.
[5] LIU D C, TSAU R T, LIN Y C, et al. Effect of various levels of rosemary or Chinese mahogany on the quality of fresh chicken sausage during refrigerated storage[J]. Food Chemistry, 2009, 117(1): 106-113.
[6] LARA M S, GUTIERREZ J I, TIMON M, et al. Evaluation of two natural extracts (Rosmarinus offi cinalis L. and Melissa offi cinalis L.) as antioxidants in cooked pork patties packed in MAP[J]. Meat Science, 2011, 88(3): 481-488.
[7] MARTINEZ L, CILLA I, BELTRAN J A, et al. Effect of illumination on the display life of fresh pork sausages packaged in modified atmosphere. Influence of the addition of rosemary, ascorbic acid and black pepper[J]. Meat Science, 2007, 75(3): 443-450.
[8] 應(yīng)麗莎, 趙東方, 付海姣, 等. 控釋技術(shù)在食品活性包裝中應(yīng)用與研究[J]. 食品科學(xué), 2012, 33(9): 335-340.
[9] de ABREU D A P, LOSADA P P, MAROTO J, et al. Natural antioxidant active packaging film and its effect on lipid damage in frozen blue shark (Prionace glauca)[J]. Innovative Food Science & Emerging Technologies, 2011, 12(1): 50-55.
[10] SEYDIM A C, SARIKUS G. Antimicrobial activity of whey protein based edible films incorporated with oregano, rosemary and garlic essential oils[J]. Food Research International, 2006, 39(5): 639-644.
[11] BOURBON A I, PINHEIRO A C, CERQUEIRA M A, et al. Physicochemical characterization of chitosan-based edible films incorporating bioactive compounds of different molecular weight[J]. Journal of Food Engineering, 2011, 106(2): 111-118.
[12] BYUN Y, KIM Y T, WHITESIDE S. Characterization of an antioxidant polylactic acid (PLA) film prepared with alpha-tocopherol, BHT and polyethylene glycol using film cast extruder[J]. Journal of Food Engineering, 2010, 100(2): 239-244.
[13] WU J G, WANG P J, CHEN S C. Antioxidant and antimicrobial effectiveness of catechin-impregnated pva-starch film on red meat[J]. Journal of Food Quality, 2010, 33(6): 780-801.
[14] NER?N C, TOVAR L, DJENANE D, et al. Stabilization of beef meat by a new active packaging containing natural antioxidants[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7840-7846.
[15] CHO S Y, LEE S Y, RHEE C. Edible oxygen barrier bilayer film pouches from corn zein and soy protein isolate for olive oil packaging[J]. LWTFood Science and Technology, 2010, 43(8): 1234-1239.
[16] DJENANE D, SANCHEZ-ESCALANTE A, BELTRAN J A, et al. Ability of alpha-tocopherol, taurine and rosemary, in combination with vitamin C, to increase the oxidative stability of beef steaks packaged in modified atmosphere[J]. Food Chemistry, 2002, 76(4): 407-415.
[17] JAKOBSEN M, BERTELSEN G. Colour stability and lipid oxidation of fresh beef. Development of a response surface model for predicting the effects of temperature, storage time, and modified atmosphere composition[J]. Meat Science, 2000, 54(1): 49-57.
[18] RUBIO B, MARTINEZ B, GARCIA-CACHAN M D, et al. Effect of the packaging method and the storage time on lipid oxidation and colour stability on dry fermented sausage salchichon manufactured with raw material with a high level of mono and polyunsaturated fatty acids[J]. Meat Science, 2008, 80(4): 1182-1187.
[19] KRZYWICKI K. The determination of haem pigments in meat[J]. Meat Science, 1982, 7(1): 29-36.
[20] S±RENSEN G, J RGENSEN S S. A critical examination of some experimental variables in the 2-thiobarbituric acid (TBA) test for lipid oxidation in meat products[J]. ZeitschriftfürLebensmitteluntersuchung und-Forschung A, 1996, 202(3): 205-210.
[21] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry 1987, 262(12): 5488-5491.
[22] MARTINEZ O, SALMERON J, GUILLEN M D, et al. Texture profile analysis of meat products treated with commercial liquid smoke flavourings[J]. Food Control, 2004, 15(6): 457-461.
[23] MARTINEZ L, DJENANE D, CILLA I, et al. Effect of varying oxygen concentrations on the shelf-life of fresh pork sausages packaged in modified atmosphere[J]. Food Chemistry, 2006, 94(2): 219-225.
[24] CAMO J, LORES A, DJENANE D, et al. Display life of beef packaged with an antioxidant active film as a function of the concentration of oregano extract[J]. Meat Science, 2011, 88(1): 174-178.
[25] CAMO J, BELTRAN J A, RONCALES P. Extension of the display life of lamb with an antioxidant active packaging[J]. Meat Science, 2008, 80(4): 1086-1091.
[26] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007, 77(3): 295-303.
[27] ZAKRYS P I, O’SULLIVAN M G, ALLEN P, et al. Consumer acceptability and physiochemical characteristics of modified atmosphere packed beef steaks[J]. Meat Science, 2009, 81(4): 720-725.
[28] DIKEMAN M E, GROBBEL J P, HUNT M C, et al. Effects of packaging atmospheres on beef instrumental tenderness, fresh color stability, and internal cooked color[J]. Journal of Animal Science, 2008, 86(5): 1191-1199.
[29] LUND M N, HVIID M S, SKIBSTED L H. The combined effect of antioxidants and modified atmosphere packaging on protein and lipid oxidation in beef patties during chill storage[J]. Meat Science, 2007, 76(2): 226-233.
[30] GRANDA-RESTREPO D M, SOTO-VALDEZ H, PERALTA E, et al. Migration of alpha-tocopherol from an active multilayer film into whole milk powder[J]. Food Research International, 2009, 42(10): 1396-1402.
[31] TOVAR L, SALAFRANCA J, S NCHEZ C, et al. Migration studies to assess the safety in use of a new antioxidant active packaging[J]. Journal of Agricultural and Food Chemistry, 2005, 53(13): 5270-5275.
[32] NER?N C, TOVAR L, SALAFRANCA J. Behaviour of a new antioxidant active film versus oxidizable model compounds[J]. Journal of Food Engineering, 2008, 84(2): 313-320.
[33] RHIM J W, MOHANTY K A, SINGH S P, et al. Preparation and properties of biodegradable multilayer films based on soy protein isolate and poly (lactide)[J]. Industrial & Engineering Chemistry Research, 2006, 45(9): 3059-3066.
[34] GUERRERO P, STEFANI P M, RUSECKAITE R A, et al. Functional properties of films based on soy protein isolate and gelatin processed by compression molding[J]. Journal of Food Engineering, 2011, 105(1): 65-72.
Effect of Protein-Based Film Containing Rosemary on Color and Oxidative Stability of Fresh Pork in High-Oxygen Modified Atmosphere
LI Da-hu, YING Li-sha, CHENG Yu-jiao, ZHANG Min*
(Chongqing Special Food Program and Technology Research Center, Laboratory of Quality and Safety Risk Assessment for Argo-products on Storage and Preservation (Chongqing), Ministry of Agriculture, College of Food Science, Southwest University, Chongqing 400715, China)
The active protein films prepared with different concentrations of rosemary and soy protein isolate were used for color protection and preservation of fresh pork in high-oxygen modifi ed atmosphere. Changes in CIE a* value, metmyoglobin, thiobarbituric acid reactive substances (TBARS) value, protein carbonyl and hardness value of fresh pork were determined. The results showed that direct treatment with rosemary at 0.05 g/100 mL effectively inhibited lipid oxidation and discolouration in the later period of storage in high oxygen atmosphere packaging. Protein films incorporated with different concentrations of rosemary showed different antioxidant effects on pork. Pure protein film and the film with rosemary at a concentration of 0.025 g/100 mL were unable to inhibit discoloration of pork, but they delayed lipid and protein oxidation to a certain extent. The fi lms with rosemary concentration at 0.1 and 0.2 g/100 mL effectively delayed the decline of a* value and the formation of metmyoglobin and TBARS value, and its protection on meat color was better than that observed with direct addition of rosemary, but these two groups failed to inhibit the formation of protein carbonyl. While the fi lm with 0.05 g of rosemary /100 mL exerted better protection than that o f direct addition of rosemary on color, lipids, proteins and other parameters of fresh pork, it basically maintained the hardness value of meat during storage. These results indicate that protein fi lm incorporated with rosemary increased the antioxidant activity of rosemary on pork in high oxygen atmosphere packaging.
rosemary; soy protein isolate; high-oxygen modifi ed atmosphere; antioxidation; pork
TS251.5
A
1002-6630(2014)24-0321-06
10.7506/spkx1002-6630-201424062
2014-06-15
重慶市科技攻關(guān)應(yīng)用技術(shù)研發(fā)類重點(diǎn)項(xiàng)目(cstc2012gg-yyjsB80003);中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)(XDJK2013C130)
李大虎(1989—),男,碩士研究生,研究方向?yàn)槭称钒b技術(shù)。E-mail:ldh060308@126.com
*通信作者:張敏(1975—),男,副教授,碩士,研究方向?yàn)槭称钒b保鮮材料及技術(shù)。E-mail:zmqx123@163.com

