預處理對膠原蛋白水解和血管緊張素轉化酶抑制肽段釋放的影響
劉 軼,馬 良,2,3,張宇昊,2,3,*
(1.西南大學食品科學學院,重慶 400715;2.西南大學 國家食品科學與工程實驗教學示范中心,重慶 400715;3.農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400715)
預處理對膠原蛋白水解和血管緊張素轉化酶抑制肽段釋放的影響
劉 軼1,馬 良1,2,3,張宇昊1,2,3,*
(1.西南大學食品科學學院,重慶 400715;2.西南大學 國家食品科學與工程實驗教學示范中心,重慶 400715;3.農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400715)
以胰蛋白酶為工具酶,研究短時熱處理、超高壓處理對膠原蛋白水解和血管緊張素轉化酶(angiotensin converting enzyme,ACE)抑制肽段釋放的影響。結果表明:熱處理可顯著促進胰蛋白酶對膠原蛋白的水解和ACE抑制活性肽段釋放,超高壓處理組水解物水解度(degree of hydrolysis,DH)與無處理組無顯著差異,ACE抑制活性顯著低于無處理組。水解物DH和ACE抑制活性關系研究顯示,胰蛋白酶水解膠原蛋白過程中,水解度小于5%時,ACE抑制率隨水解度呈明顯上升趨勢,水解度大于5%后,其上升趨勢不再明顯。肽譜分析進一步證明熱處理可有效促進膠原蛋白的水解,超高壓處理可改變胰蛋白酶作用位點。熱處理組水解物序列分析顯示,獲得序列均來源于膠原蛋白三螺旋區域,且大部分序列都具有潛在的ACE抑制活性。說明短時熱處理可以有效破壞膠原蛋白的三螺旋結構,促進ACE抑制肽段的釋放。
胰蛋白酶;膠原蛋白;預處理;水解;ACE抑制活性
動物性食品加工過程中會產生皮、骨等大量副產物,這些副產物中含有大量膠原蛋白。因此以動物加工副產物為原料,通過酶解制備膠原多肽,提高副產物的附加值已經成為目前研究熱點[1-2]。血管緊張素轉化酶(angiotensin converting enzyme,ACE)抑制肽構效研究表明,C末端含有Pro或Hyp的多肽,如Gly-Pro-Hyp-Gly-Thr-Asp-Gly-Ala-Hyp、Gly-Pro-Pro-Gly-Ala-Hyp、Gly-Pro-Pro-Gly-Ala-Hyp、Gly-Ala-Hyp、Gly-Phe-Hyp-Gly-Pro等,通常具有較強的ACE抑制活性(其半抑制濃度范圍為8.6~200 μmol/L)[3-4]。膠原蛋白富含脯氨酸(Pro)和羥脯氨酸(Hyp),因此被大量應用于ACE抑制肽的制備和研究[5-8]。然而,天然的膠原蛋白具有穩定的三螺旋結構,很難被金屬基質蛋白酶(matrix metallo protease,MMP)以外的蛋白酶水解[9],而膠原蛋白中Pro和Hyp全部存在于三螺旋區域,因此膠原蛋白中潛在的ACE抑制肽段很難通過酶解被有效釋放。目前有關膠原ACE肽制備方面的報道,大部分均以明膠為底物[10]或者酶解前對膠原蛋白進行3 h以上的熱處理[5-8,10],以破壞膠原的三螺旋結構。對膠原前處理方法進行研究,構建可有效制備膠原ACE抑制肽的短時預處理方法具有重要意義。
超高壓技術近年來被廣泛應用于蛋白質改性,適度的超高壓作用可破壞蛋白質的三級和四級結構,破壞其疏水鍵和離子鍵等非共價鍵,使蛋白質肽鏈伸展,立體結構松散[11-12]。研究表明,采用超高壓作用可有效破壞膠原蛋白非共價鍵平衡,誘導膠原蛋白明膠化[11,13]。因此,超高壓預處理有可能暴露膠原蛋白內部位點,促進內部活性肽段的釋放。
熱處理是常用的蛋白水解預處理方法,但短時熱處理對膠原蛋白水解產物影響方面的研究鮮見報道。本實驗擬選擇難以水解天然膠原蛋白的胰蛋白酶為工具酶,研究短時熱處理和超高壓處理對胰蛋白酶水解膠原蛋白釋放ACE抑制活性肽段的影響,旨在為膠原ACE肽的高效制備奠定理論基礎。
1 材料與方法
1.1 材料與試劑
牛Ⅰ型膠原蛋白、胰蛋白酶、A C E、A C E作用底物(ABZ-Gly-Phe(NO2)-Pro)、鄰苯二甲醛(o-pthaldialdehyde,OPA)、N-乙酰半胱氨酸(N-acetyl cysteine,NAC) 美國Sigma公司;乙腈、三氟乙酸(trifluoroacetic acid,TFA)(均為色譜純) 德國Fisher公司;其余試劑為分析純。
1.2 儀器與設備
UV-2100型分光光度計 澳大利亞Mulgrave公司;熒光酶標儀 美國Tecan Genios Plus公司;QFP-6超高壓處理設備 瑞典Avure Technologies公司;Agilent 1100 MSD Trap液質聯用儀 美國Agilent公司。
1.3 方法
1.3.1 樣品預處理
稱取一定量牛Ⅰ膠原蛋白,按料液比1∶100(m/V)加入0.1 mol/L磷酸鹽緩沖液(pH 8.0),于4 ℃過夜后分別用熱和超高壓進行預處理,其中熱處理組于100 ℃處理5 min后立即用蒸餾水沖洗冷卻至室溫;超高壓處理組樣品用塑料袋封裝,于600 MPa處理15 min后立即轉移至燒杯中;以無處理組作為對照。
1.3.2 酶解液制備
預處理后的樣品于37 ℃預熱10 min,以酶與底物質量比1∶100加入胰蛋白酶,酶解時間在1 min、30 min、1 h、2 h、3 h、4 h時分別取出一定量水解液,立即于90 ℃水浴15 min進行滅酶處理。冷卻至室溫后于11 000 ×g離心5 min,取上清液過0.45 μm濾膜后于-18 ℃凍藏備用。
1.3.3 水解度(degree of hydrolysis,DH)測定
參照Spellman等[14]的方法,略有改進。按文獻方法配制OPA試劑,現配現用,將酶解液稀釋10 倍后取2.4 mL于10 mL試管中,加入2.4 mL濃度為5 mmol/L的OPA/NAC溶液,反應進行10 min達到平衡后,將反應液轉移至3 mL的比色管中,于340 nm波長處測定其吸光度。空白組以水代替水解液。通過Peptide Cutter Software(http://web.expasy.org/peptide_cutter/)預測胰蛋白酶水解牛Ⅰ型膠原蛋白的作用位點,并利用公式(1)計算胰蛋白酶水解牛Ⅰ型膠原蛋白的理論水解度。
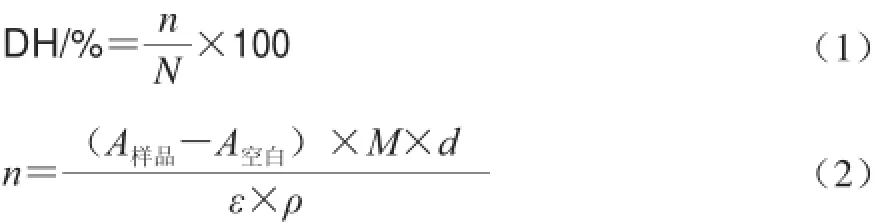
式中:n為水解斷裂肽鍵平均數;N為每個蛋白分子總肽鍵數;A樣品、A空白分別為樣品和空白組在340 nm波長處的吸光度;M為蛋白分子質量/D;d為稀釋系數;ε為OPA在340 nm波長處的消光系數,此處為6 000/(mol·cm);ρ為蛋白質質量濃度/(g/L)。查詢UniProt數據庫計算可得,牛Ⅰ型膠原蛋白分子質量為406.940 D,肽鍵數為4 287。
1.3.4 ACE抑制率測定
采用熒光酶標法測定ACE抑制率[15]。向黑色微量酶標板加50 μL酶解液,加入6 mU/mL ACE溶液50 μL后,將微量酶標板置于熒光酶標儀振板10 s,于37 ℃條件下反應10 min,之后向滴定板每個反應孔中加入200 μL 0.45 mmol/L ABZ-Gly-Phe(NO2)-Pro,在37 ℃進行動力學測定,1 h內每隔1.5 min測定一次激發波長為360 nm、吸收波長為415 nm所對應的熒光值,繪制曲線并計算斜率。以pH 8.3 Tris緩沖液代替酶解液作陽性對照組,陰性對照、空白用Tris緩沖液替代ACE溶液。所有樣品均需重復5 次。ACE抑制率按公式(3)測定。

1.3.5 多肽序列測定
參照Otte等[16]的LC-MS/MS法進行測定。分析柱Zorbax 300SB C18柱(2.1 mm×150 mm,5 μm);進樣量25 μL;柱溫40 ℃;流速0.25 mL/min;采用梯度洗脫,其中前5 min用A流動相洗脫(A為含0.1% TFA的超純水),后70 min采用0%~60%流動相B線性梯度洗脫(B為90%含0.1% TFA的乙腈)。離子化方式為ESI+;氣體流速9 L/min;霧化器壓力50 psi;干燥氣溫度300 ℃;掃描范圍50~2 000 m/z,目標質量數為1 521。采用Bruker Daltonics 3.3數據分析軟件處理數據;用Mascot Version 2.1軟件對水解物經質譜分析后所得組分與蛋白序列進行匹配,此外,Biotools Software軟件被用于分析膠原多肽分子質量。牛Ⅰ型膠原蛋白的序列可從UniProt數據庫獲得,用于確定所得多肽序列的來源。
1.4 數據處理
采用SPSS 13.0進行數據分析。樣品DH和ACE抑制活性的顯著性分析采用圖基檢驗法(Tukey’s test);DH與ACE抑制活性關系分析主要利用SPSS中提供的各種模型進行擬合,以相關系數為指標選擇最優擬合模型。
2 結果與分析
2.1 不同預處理膠原蛋白水解產物DH和ACE抑制活性分析
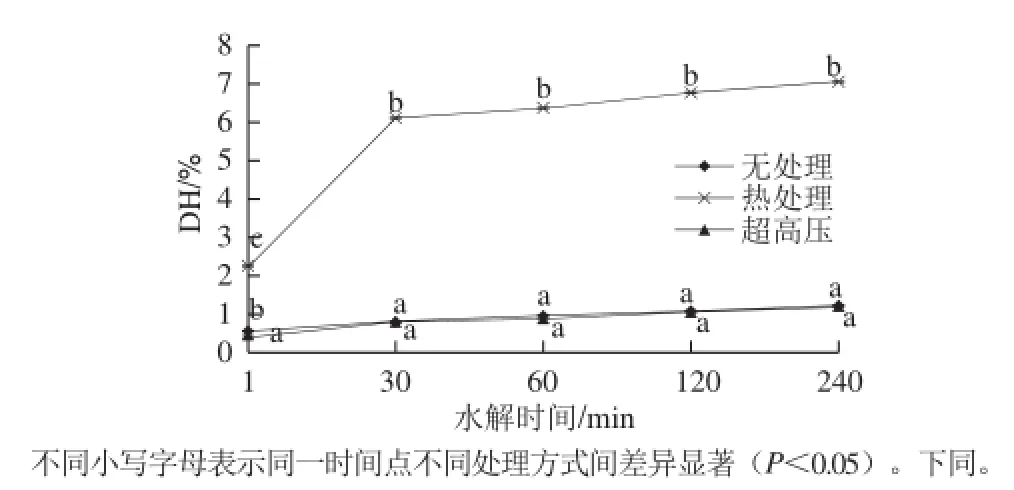
圖1 不同預處理對DH的影響Fig.1 Effect of pretreatments on DH
胰蛋白酶對于膠原蛋白的理論水解度為8.5%,但由圖1可知,胰蛋白酶對未經處理的膠原蛋白水解非常有限,酶解240 min后水解度僅為1.46%。600 MPa超高壓預處理對于胰蛋白酶水解膠原蛋白同樣沒有促進作用,酶解240 min后水解度與無處理組無顯著差異(P>0.05)。而熱處理可顯著提高胰蛋白酶水解膠原蛋白的能力(P<0.05),水解1 min后水解度即達到2.44%,240 min后達到6.96%,接近胰蛋白酶對膠原蛋白的理論水解度。Zhang Zhongkai等[17]研究表明,膠原蛋白具有穩定的三螺旋結構,很難被胰蛋白酶水解,但如果以明膠為底物,其水解度會大幅提高,主要是因為明膠中三螺旋結構已被破壞。由此可見,對于純牛皮膠原蛋白,100 ℃、5 min的預處理已足夠破壞其三螺旋結構,使之暴露內部酶切位點,提高胰蛋白酶的水解度。
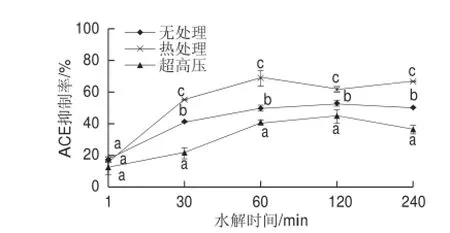
圖2 不同預處理對水解物ACE抑制活性的影響Fig.2 Effect of pretreatments on ACE inhibitory activity of hydrolysates
由圖2可知,熱處理膠原蛋白的胰蛋白酶水解物同樣具有較高的ACE抑制活性,其中最高活性出現在水解60 min后,其ACE抑制率達到68.55%。盡管無處理組水解液的水解度與超高壓處理組相近,但其ACE抑制活性顯著高于超高壓處理組(P<0.05),這可能是因為超高壓導致了膠原蛋白的聚集[15,18],改變了胰蛋白酶的作用位點,抑制了ACE抑制活性肽段的釋放。
2.2 膠原胰蛋白酶水解物DH與ACE抑制活性的關系
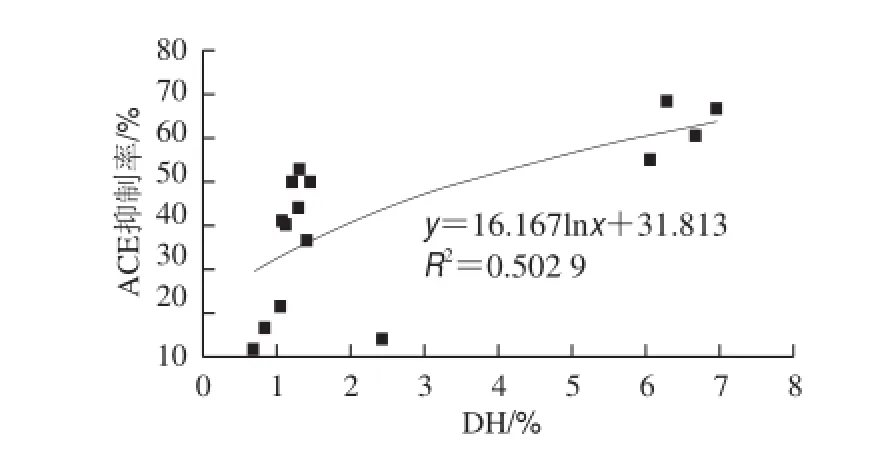
圖3 膠原蛋白水解物DH與ACE抑制活性關系Fig.3 Correlation between DH and ACE inhibitory activity
由圖3可知,胰蛋白酶水解物水解度小于5%時,ACE抑制率隨水解度呈明顯上升趨勢,水解度大于5%后,其上升趨勢不再明顯,這可能是因為在水解初始階段,隨著水解度的升高多肽濃度大幅增加,而在高水解度階段,水解度繼續上升,多肽濃度增加不明顯。采用對數模型可對該散點圖進行較好擬合。Walsh[19]和Nielsen[20]等對對乳源ACE抑制肽的水解度和ACE抑制活性關系進行研究,結論與本實驗一致。超高壓預處理和無處理組膠原蛋白水解度均小于5%,因此無法有效釋放膠原內部的ACE抑制活性肽段。
2.3 不同預處理膠原蛋白水解物肽譜分析
對熱處理、超高壓處理、無處理組酶解60 min樣品進行肽譜分析,由圖4可知,水解60 min后,熱處理組多肽明顯多于無處理組和超高壓組,與水解度分析結論一致,進一步說明100 ℃、5 min的預處理可有效促進胰蛋白酶水解膠原蛋白。無處理組和超高壓處理組產物中多肽含量較少,同時肽譜具有一定差異性,如保留時間在50~70 min時,無處理組多肽含量更高,說明超高壓預處理部分改變了胰蛋白酶的作用位點,這可能是導致二者水解物ACE抑制活性差異的原因。
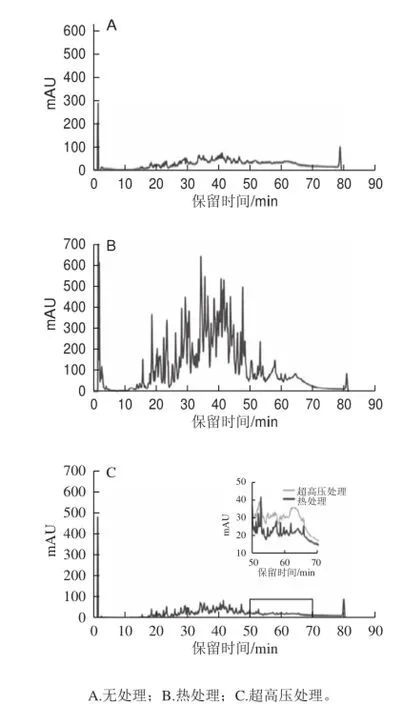
圖4 不同預處理水解物肽譜Fig.4 Peptide pro fi le of hydrolysates obtained with different pretreatments
2.4 熱處理膠原蛋白水解物中潛在ACE抑制肽序列
鑒于熱處理組60 min水解物ACE抑制活性最高,對其多肽序列進行分析,結果見表1。ACE抑制肽多為小分子肽,因此主要對其中分離度較高的小分子組分進行序列分析。所有獲得的序列均來源于膠原蛋白三螺旋結構中的α1鏈和α2鏈,說明熱處理充分暴露了膠原蛋白內部位點。胰蛋白酶切割的位點是主要是Lys和Arg的C末端[21],表1中大部分多肽C末端均為Arg或Lys,與胰蛋白酶的作用位點相一致。其中部分序列已經被鑒定報道,如GPPGSAGSPGK[22]、GDAGPAGPK[23]、GPPGPQGAR[24]、GSEGPQGVR[25]、GPAGPQGPR[26]、GETGPAGPAGPIGPVGAR[27],所有報道的序列均來源于膠原蛋白,但對于其ACE抑制活性還未見報道。ACE抑制肽構效研究表明,當Lys、Arg或者極度疏水氨基酸位于C末端時,多肽通常具有較強的ACE抑制活性[28]。從表中還以看出,8 個多肽序列在C末端后3 位含有Pro或者Hyp,而Ichimura[3]和Byun[6]等研究表明,當多肽C末端3 位含有Pro或者Hyp時,通常具有較強的ACE抑制活性,因此,所鑒定多肽中絕大部分可能具有較強的ACE抑制活性,這也是熱處理組60 min水解物具有較高ACE抑制活性的原因。
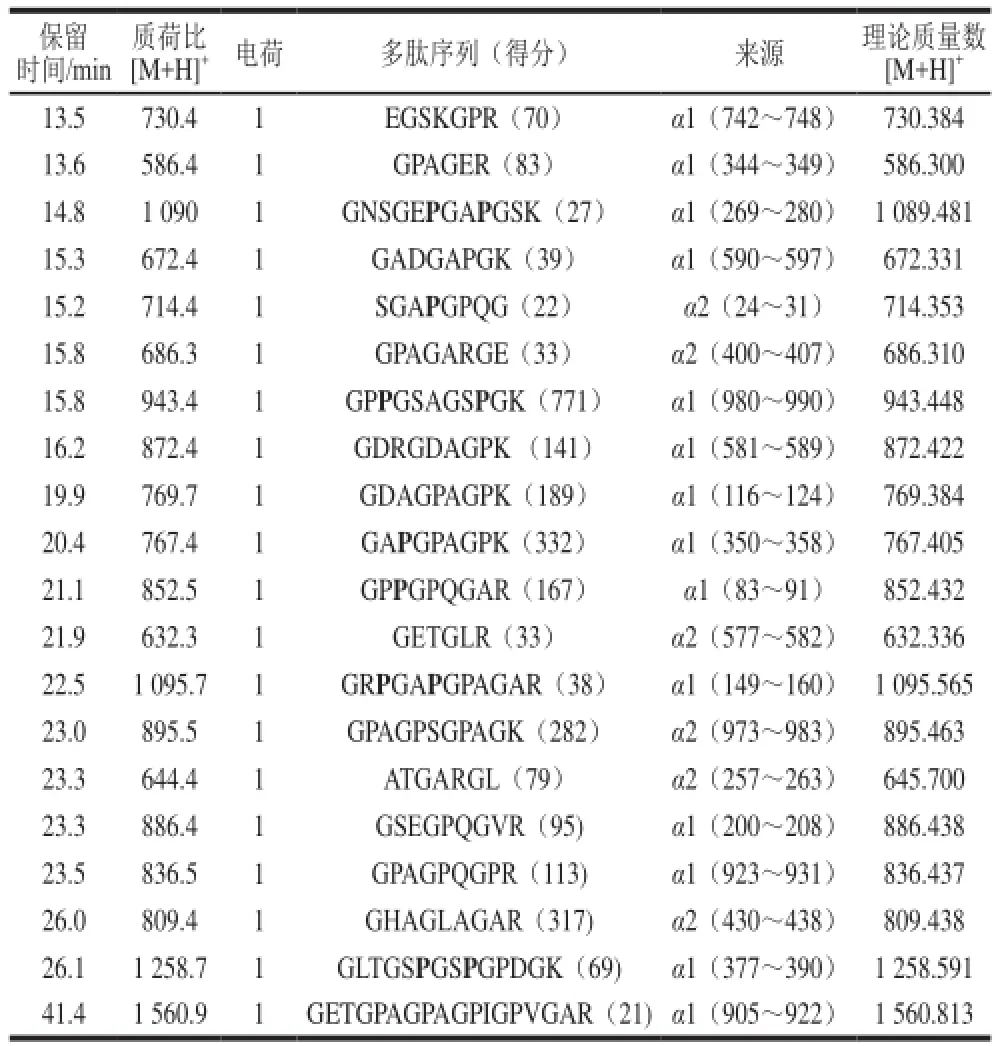
表1 熱處理膠原水解60 min后水解物質譜分析Table1 Mass spectrometric analysis of major peptides in 60 min hydrolysates of boiled collagen
3 結 論
本研究表明,100 ℃、5 min的預處理可有效促進胰蛋白酶對膠原蛋白的水解和ACE抑制活性肽段的釋放,其水解產物的DH和ACE抑制活性均顯著提高(P<0.05);600 MPa、15 min的超高壓預處理無法促進胰蛋白酶對膠原蛋白的水解,其水解產物DH與無處理組無顯著差異(P>0.05),ACE抑制活性顯著低于無處理組(P<0.05);膠原胰蛋白酶水解物DH與ACE抑制活性的關系研究表明,胰蛋白酶水解物水解度小于5%時,ACE抑制率隨水解度增大呈明顯上升趨勢,水解度大于5%后,其上升趨勢不再明顯;胰蛋白酶酶解膠原蛋白60 min后水解物肽譜與水解度測定結果一致,超高壓預處理組與無處理組水解物呈現一定差異,證明超高壓預處理部分改變了胰蛋白酶的作用位點;對熱處理組酶解60 min水解物中部分多肽進行序列分析顯示,所鑒定序列均來源于膠原蛋白三螺旋區域,且大部分序列都具有潛在的ACE抑制活性。
參考文獻:
[1] KIDA K, MORIMURA S, NODA J, et al. Enzymatic-hydrolysis of the horn and hoof of cow and buffalo[J]. Journal of Fermentation and Bioengineering, 1995, 80(5): 478-484.
[2] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process from livestock and for utilization of collagen fish waste[J]. Process Biochemistry, 2002, 37(12): 1403-1412.
[3] ICHIMURA T, YAMANAKA A, OTSUKA T, et al. Antihypertensive effect of enzymatic hydrolysate of collagen and Gly-Pro in spontaneously hypertensive rats[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(10): 2317-2319.
[4] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensinⅠ-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimica et Biophysica Acta, 1979, 566(1): 128-137.
[5] ALEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125(2): 334-341.
[6] BYUN H G, KIM S K. Purification and characterization of angiotensinⅠconverting enzyme (ACE) inhibitory peptides from Alaska pollack (Theragra chalcogramma) skin[J]. Process Biochemistry, 2001, 36(12): 1155-1162.
[7] KIM S K, BYUN H G, PARK P J, et al. AngiotensinⅠconverting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 2992-2997.
[8] SAIGA A, IWAI K, HAYAKAWA T, et al. Angiotensin Ⅰ-converting enzyme-inhibitory peptides obtained from chicken Collagen hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9586-9591.
[9] CHUNG L D, DINAKARPANDIAN D, YOSHIDA N, et al. Collagenase unwinds triple-helical collagen prior to peptide bond hydrolysis[J]. The Embo Journal, 2004, 23(15): 3020-3030.
[10] CHENG F Y, LIU Y T, WAN T C, et al. The development of angiotensinⅠ-converting enzyme inhibitor derived from chicken bone protein[J]. Animal Science Journal, 2008, 79(1): 122-128.
[11] 張宇昊, 馬良, 師萱. 魚皮明膠的超高壓輔助提取工藝[J]. 食品科學, 2011, 32(6): 99-103.
[12] 陳麗清, 馬良, 張宇昊. 現代加工技術在明膠制備中的應用展望[J].食品科學, 2010, 31(19): 418-421.
[13] 陳麗清, 張宇昊, 周夢柔, 等. 豬皮明膠提取過程中的超高壓預處理工藝優化[J]. 農業工程學報, 2012, 28(19): 262-269.
[14] SPELLMAN D, MCEVOY E, O’CUINN G, et al. Proteinase and exopeptidase hydrolysis of whey protein: comparison of the TNBS, OPA and pH stat methods for quantif i cation of degree of hydrolysis[J]. International Dairy Journal, 2003, 13(6): 447-453.
[15] SENTANDREU M A, TOLDRA F. A fluorescence-based protocol for quantifying angiotensin-converting enzyme activity[J]. Nature Protocols, 2006, 1(5): 2423-2427.
[16] OTTE J, SHALABY S M, ZAKORA M, et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates: effect of substrate, enzyme and time of hydrolysis[J]. International Dairy Journal, 2007, 17(5): 488-503.
[17] ZHANG Zhongkai, LI Guoying, SHI B L. Physicochemical properties of collagen, gelatin and collagen hydrolysate derived from bovine limed split wastes[J]. Journal of the Society of Leather Technologists and Chemists, 2006, 90(1): 23-28.
[18] CHEN Liqing, MA Liang, ZHOU Mengru, et al. Effects of pressure on gelatinization of collagen and properties of extracted gelatins[J]. Food Hydrocolloids, 2014, 36: 316-322.
[19] WALSH D J, BERNARD H, MURRAY B A, et al. in vitro generation and stability of the lactokinin beta-lactoglobulin fragment (142-148)[J]. Journal of Dairy Science, 2004, 87(11): 3845-3857.
[20] NIELSEN M S, MARTINUSSEN T, FLAMBARD B, et al. Peptide prof i les and angiotensin-Ⅰ-converting enzyme inhibitory activity of fermented milk products: Effect of bacterial strain, fermentation pH, and storage time[J]. International Dairy Journal, 2009, 19(3): 155-165.
[21] OTTE J, SHALABY S M, ZAKORA M, et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates: Effect of substrate, enzyme and time of hydrolysis[J]. International Dairy Journal, 2007, 17(5): 488-503.
[22] YILMAZ M T, KESMEN Z, BAYKAL B, et al. A novel method to differentiate bovine and porcine gelatins in food products: NanoUPLCESI-Q-TOF-MSE based data independent acquisition technique to detect marker peptides in gelatin[J]. Food Chemistry, 2013, 141(3): 2450-2458.
[23] TAGA Y, KUSUBATA M, OGAWA-GOTO K, et al. Site-specific quantitative analysis of overglycosylation of collagen in osteogenesis imperfecta using hydrazide chemistry and SILAC[J]. Journal of Proteome Research, 2013, 12(5): 2225-2232.
[24] WILSON J, van DOORN N L, COLLINS M J. Assessing the extent of bone degradation using glutamine deamidation in collagen[J]. Analytical Chemistry, 2012, 84(21): 9041-9048.
[25] PATARIDIS S, ECKHARDT A, MIKULIKOVA K, et al. Identif i cation of collagen types in tissues using HPLC-MS/MS[J]. Journal of Separation Science, 2008, 31(20): 3483-3488.
[26] PATARIDIS S, ECKHARDT A, MIKULIKOVA K, et al. Determination and quantification of collagen types in tissues using HPLC-MS/MS[J]. Current Analytical Chemistry, 2009, 5(4): 316-323.
[27] ZHANG G F, LIU T, WANG Q, et al. Mass spectrometric detection of marker peptides in tryptic digests of gelatin: a new method to differentiate between bovine and porcine gelatin[J]. Food Hydrocolloids, 2009, 23(7): 2001-2007.
[28] HERNANDEZ-LEDESMA B, CONTRERAS M D, RECIO I. Antihypertensive peptides: production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35.
Inf l uence of Pretreatment on Enzymatic Hydrolysis of Collagen and Release of Angiotensin Converting Enzyme (ACE) Inhibitory Peptides
LIU Yi1, MA Liang1,2,3, ZHANG Yu-hao1,2,3,* (1. College of Food Science, Southwest University, Chongqing 400715, China; 2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China; 3. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
Trypsin was used to hydrolyze bovine type Ⅰ collagen with trypsin for the preparation of angiotensin converting enzyme (ACE) inhibitory peptides. The inf l uence of pretreatment by heating or high-pressure (HP) treatment for a short time on the degree of hydrolysis (DH) and ACE inhibitory activity of hydrolysates was studied. Heating could improve hydrolysis of collagen and release of ACE inhibitory peptides. HP pretreatment caused no signif i cant difference in DH from the untreated control, but exhibited signif i cantly lower ACE inhibitory activity than the control. The correlation between DH and ACE inhibition implied that ACE inhibition rose rapidly as DH increased, until reaching a plateau at a DH level of 5%. The peptide prof i le showed that collagen could be hydrolyzed effectively after heating and the sites hydrolyzed by trypsin could be changed after HP pretreatment. Sequence analysis of peptides from collagen with heating pretreatment showed that all sequences were from the triple-helix of collagen and most of them could have strong ACE inhibitory activity, which implied the triple-helix of collagen could be damaged and ACE inhibitory peptides could be released effectively after shorttime heating pretreatment.
trypsin; collagen; pretreatment; hydrolysis; ACE inhibitory activity
TS209
A
1002-6630(2014)21-0021-05
10.7506/spkx1002-6630-201421005
2014-04-06
國家自然科學基金青年科學基金項目(31301425);中央高校基本科研業務費專項資金項目(XDJK2011B001);中國博士后科學基金面上項目(2014M562267)
劉軼(1990—),女,碩士研究生,研究方向為食品化學與營養學。E-mail:penganliuyi@126.com
*通信作者:張宇昊(1978—),男,副教授,博士,研究方向為蛋白質與生物活性肽。E-mail:zyh1203@163.com

