甲狀腺激素脫碘酶在孕哺期十溴聯苯醚(BDE 209)暴露致子代小鼠神經發育毒性中的潛在作用
錢 波,王 健,朱春艷,胡 宏,邵 靜, *,劉曉暉,#
1.大連醫科大學公衛學院 勞動衛生與環境衛生教研室,大連 116044 2.大連醫科大學附屬二院 檢驗科,大連 116027
多溴聯苯醚(polybromodiphenyl ethers,PBDEs)是一類高效溴系阻燃劑,在過去的30~40年中被廣泛應用在多種工業產品和家庭消費品中。由于PBDEs具有一定的揮發性,并且與產品以非共價鍵結合,使得PBDEs易從產品中釋放出來,導致生態和生活環境污染。在過去的20多年里,PBDEs不僅被發現存在于大氣、水和土壤等多種環境介質中,而且許多生物組織也檢測到PBDEs的存在[1]。人群調查顯示,孕哺期婦女、嬰幼兒及兒童等敏感人群體內PBDEs負荷有逐年升高趨勢。在育齡婦女的脂肪、血液、胎盤,哺乳期婦女的乳汁,新生兒臍血及胚胎肝臟均已檢測到PBDEs多種同系物的存在,并且新生兒臍血與母體血液PBDEs水平具有相關性[2],這說明PBDEs可通過胎盤屏障或以哺乳方式進入胎兒及嬰幼兒體內,對胚胎發育和嬰幼兒健康產生潛在損害。目前PBDEs對人類毒理效應還不十分清楚,但動物研究顯示,PBDEs對甲狀腺激素干擾和神經發育損傷尤為顯著[3-4]。
甲狀腺激素(TH,包括T3和T4)參與了脊椎動物幾乎所有組織器官的發育和生理功能,尤其在神經系統發育過程中起著重要的作用[5]。PBDEs對TH的干擾作用已在多種種屬動物研究中得到證實,主要表現在降低循環血液中T4濃度[6]。PBDEs神經發育毒性的主要表現為誘導運動行為以及改變認知能力和降低學習記憶能力[7]。因此,鑒于TH在大腦發育過程中的重要角色,劉早齡等推測PBDEs神經發育毒理效應可能(至少部分)與其導致的TH紊亂有關[6],但二者的聯系機制尚不清楚。
生物體諸多基礎生理過程的調節依賴于甲狀腺激素的合理代謝。其中,甲狀腺激素脫碘酶在甲狀腺激素代謝轉化及組織利用中具有重要作用。甲狀腺激素脫碘酶包括I型、II型和III型脫碘酶。II型(DI-2)主要分布在腦、垂體、及棕色脂肪組織,近年來在甲狀腺、胎盤和胎兒腦中也發現有該酶表達,尤其在新生兒腦中該酶活性達到高峰。局部組織細胞中的T3主要由DI-2催化T4外環脫碘生成,這對于依賴TH的大腦發育(特別是胎兒和嬰幼兒)至關重要[8]。III型(DI-3)主要存在于腦、皮膚和眼睛等組織,特別是胎盤、胎腦和胎肝。DI-3催化T3和T4內環的脫碘,導致T3、T4的降解和滅活。在胎盤和胎兒組織,高DI-3活性可通過滅活T3調節胎兒循環T3水平,避免胎兒暴露于母體的高濃度T3之下,具有保護作用[9]。I型(DI-1)主要分布于肝臟、腎臟和甲狀腺,目前其功能尚不十分明確[10]。由于DI-1同時具有內環和外環脫碘的活性[11],推測其主要作用包括:一是在外周組織中將T4催化生成T3,以維持循環T3濃度穩定;二是為機體清除T3滅活后生成的γT3,并作為產生循環T3主要來源。目前有關PBDEs對哺乳動物脫碘酶影響的報道較少,鑒于上述三種脫碘酶的組織分布特征,及在維護循環和局部組織TH穩態中的重要作用,可以推測PBDEs對脫碘酶的影響可能是其甲狀腺激素紊亂和神經發育毒性的一種機制。
PBDEs具有209種同系物,其中十溴聯苯醚(decabromodiphenyl ether, BDE 209)是目前使用量最大的一種。盡管BDE 209被認為毒性較小,但近年來的研究顯示,其具有與其它同系物相似的甲狀腺激素干擾效應和神經發育毒性[12-13]。本研究通過建立孕哺期BDE 209暴露模型,研究BDE 209對昆明小鼠母鼠胎盤、子鼠腦組織中甲狀腺激素脫碘酶基因表達的變化,初步探討甲狀腺激素脫碘酶在PBDEs誘導神經發育毒理效應中的作用,為將來的機制研究提供依據。
1 材料和方法(Materials and methods)
1.1 主要儀器與試劑
儀器:Morris水迷宮檢測系統(中國科學院研制),PCR儀(Takara Thermal Cycler Dice TP800,寶生物公司,大連)。
試劑:BDE 209(純度>99% ChemService公司,美國),RNA提取及反轉錄試劑(寶生物公司,大連),其他試劑皆為國產分析純。
1.2 實驗動物
選用4周齡SPF級昆明雌性小鼠75只(大連醫科大學實驗動物中心提供),隨機分為3組(對照組、低劑量暴露組、高劑量暴露組),每組25只。將BDE 209溶于精煉花生油中,根據小鼠體重,按不同暴露劑量(低劑量暴露組:1.5 mg·(kg·d)-1,高劑量暴露組:225 mg·(kg·d)-1每天避光灌胃一次。對照組灌胃等量花生油。BDE 209暴露10 d后,將雌鼠與同齡SPF級雄性昆明小鼠按2:1合籠,次日清晨檢查脫落的陰栓,陰栓脫落則記為妊娠第0天。待確定雌鼠受孕后,將雄鼠取出。選取懷孕時間相近(相差不過2 d)的8只母鼠繼續對其進行染毒,直至出生后子鼠斷乳。所有動物均自由采食、飲水。室內溫度為20~25 ℃,光線按亮/暗12 h循環。
1.3 樣品采集
原代雌鼠每組取5只,在孕第17~18天處死,立即取其胎盤組織,放入液氮中凍存,后轉入-80 ℃冰箱備用。子鼠每組取雌雄各5只,在染毒60 d后處死,立即取其腦組織,放入液氮中凍存,后轉入-80 ℃冰箱備用。
1.4 檢測指標及方法
1.4.1 實驗動物一般動態觀察
自子鼠出生第1天起,每天觀察記錄子鼠活動和精神狀態,并在出生后第2、16、30和60天測量子鼠體重。
1.4.2 子鼠空間學習記憶能力檢測(Morris水迷宮試驗)
子鼠出生后第60天,按照性別,每組隨機取5只子鼠,用Morris水迷宮檢測系統(中國科學院研制)開始進行強迫游泳訓練。實驗前將小鼠置于站臺上適應10 s,隨后將小鼠隨機從不同象限面壁置入池內,小鼠登上站臺5 s后終止記錄,最長記錄時間為120 s,若小鼠在120 s內不能上臺,引導其登上站臺適應10 s,最后將小鼠擦干放入鼠籠。如此將小鼠置入游泳池,每天4次,每次間隔1 h。在定位航行訓練第4天,通過水池上方架設的一臺連接電腦的攝像機,記錄和分析動物行為軌跡以及動物找到平臺所需時間,即逃避潛伏期測量,以評判小鼠的空間記憶能力。
1.4.3 脫碘酶mRNA水平檢測
采用實時熒光定量PCR(quantitative real-time reverse transcription-polymerase chain reaction, qRT-PCR)檢測I型、II型、III型脫碘酶mRNA表達水平。(1)總RNA提取和質量控制:取-80 ℃冰箱凍存的孕第17~18天原代雌鼠胎盤和子鼠出生60 d腦組織,按照RNAiso Plus試劑盒(大連寶生物公司)方法分別提取總RNA,通過紫外吸收值A260/A280和瓊脂糖凝膠電泳驗證RNA無污染及降解。(2)本研究所用引物均由大連寶生物公司設計合成,引物序列號及序列如表1所示。(3)熒光定量PCR:將2 μg總RNA逆轉錄合成cDNA(PrimeScript?RT Master Mix試劑盒,大連寶生物公司),然后按照SYBR Premix Ex TaqTMⅡ試劑盒(大連寶生物公司)說明,使用大連寶生物公司PCR儀(Takara Thermal Cycler Dice TP800)進行實時熒光定量。反應條件為:預變性95 ℃ 30 s;PCR反應 95 ℃ 5 s,60℃ 30 s,40個循環;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。(4)結果分析:使用TP800 v4.01軟件對結果進行分析,以GAPDH的表達量對結果進行標準化。
1.5 統計學分析
2 結果(Results)
2.1 子鼠生長動態觀察
斷乳后對子鼠一般狀態進行動態觀察。隨著生長期的延長,BDE 209染毒組子鼠出現飲食及活動減少,精神萎靡,毛發紊亂,體重進行性下降直至消瘦等表現。由表2可見,第2、16天雌、雄子鼠體重未見明顯變化(p>0.05);在出生后30 d,高劑量組雌性子鼠體重明顯降低(p<0.05),而雄性子鼠低劑量和高劑量組體重均明顯降低(p<0.05或p<0.01);出生后60 d各組子鼠體重未見明顯差異(p>0.05)。
2.2 孕哺期十溴聯苯醚暴露對60 d子鼠學習記憶能力的影響
Morris水迷宮訓練結束后,在第4天對逃避潛伏期進行了考察。由圖1可以看出,隨著染毒劑量的升高,雌、雄子鼠的逃避潛伏期呈現延長趨勢,劑量-效應趨勢明顯(p<0.05或p<0.01)。
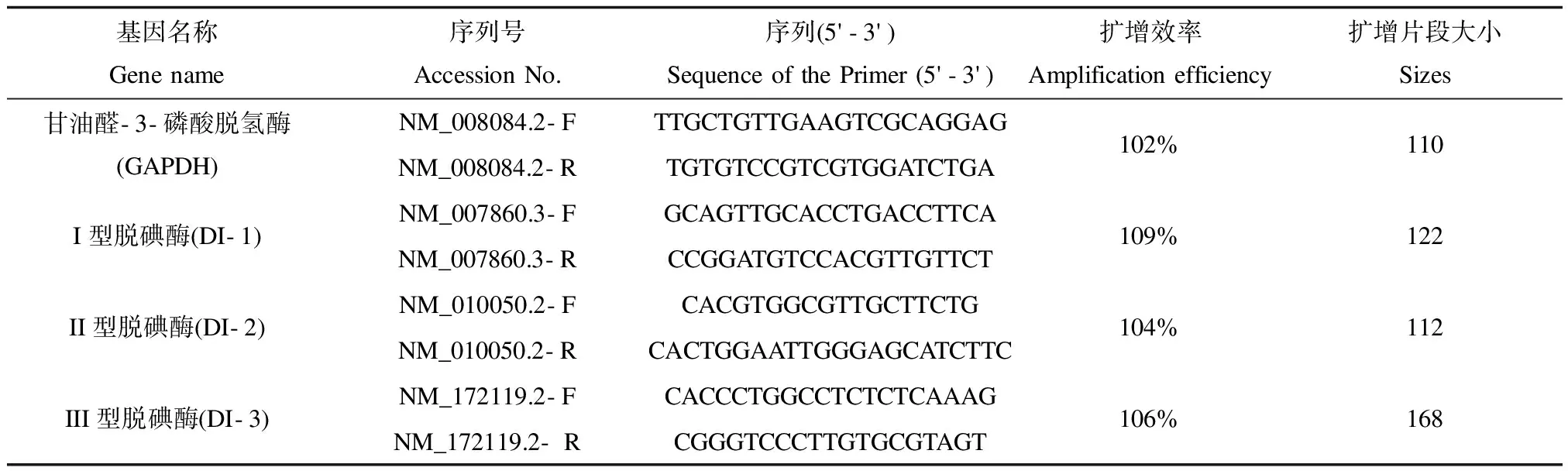
表1 引物GAPDH, DI-1, DI-2, DI-3的基本參數Table 1 Parameters of GAPDH, DI-1, DI-2, DI-3 genes
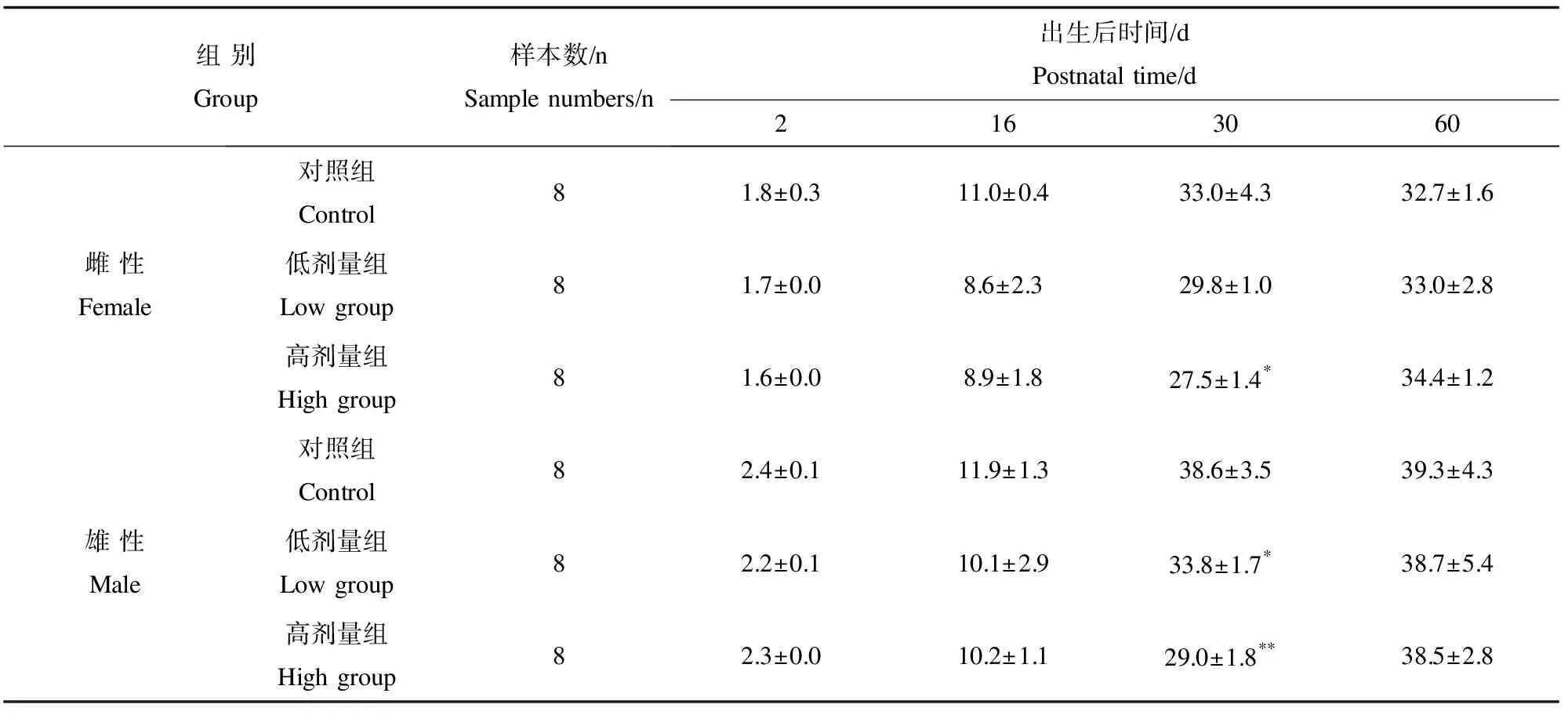
表2 BDE 209對小鼠子鼠體重動態影響(g)Table 2 Effect of BDE 209 exposure on the body weight in the offspring mice
注:*與對照組比較,p<0.05;**與對照組比較,p<0.01。
Note: *compared with the control,p<0.05; **compared with the control,p<0.01.
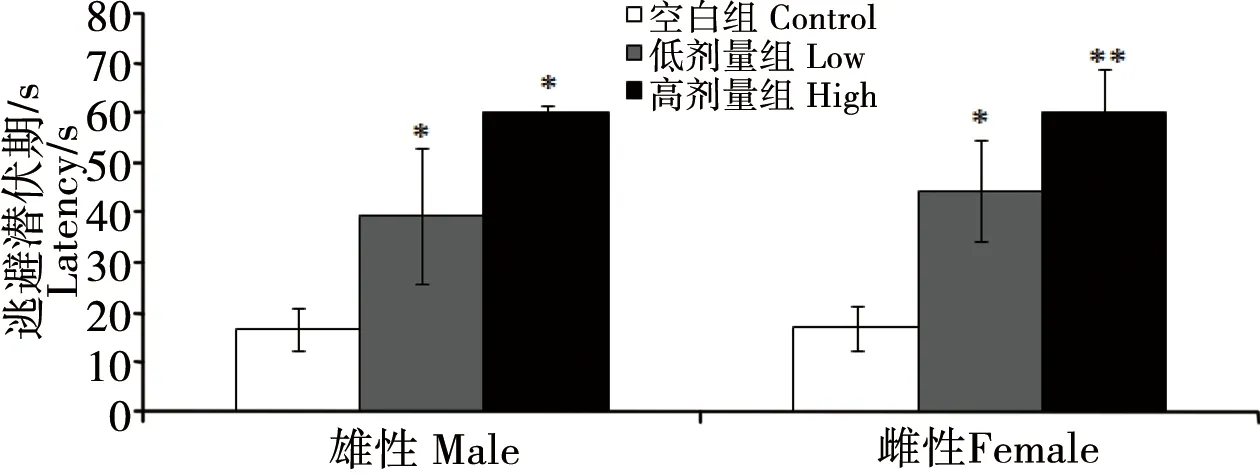
圖1 孕哺期BDE 209暴露對子鼠逃避潛伏期影響注:*與對照組比較,p<0.05;**與對照組比較,p<0.01。Fig. 1 Effect of BDE 209 on latency of offspringNote: *compared with the control, p<0.05; **compared with the control, p<0.01.
2.3 十溴聯苯醚暴露對原代雌鼠胎盤脫碘酶表達的影響
BDE 209暴露對原代雌鼠胎盤脫碘酶表達影響結果如圖2所示。低劑量暴露組與對照組比較,低劑量暴露組胎盤DI-1和DI-3的mRNA表達水平顯著下降(約60%,p<0.05),而DI-2的mRNA表達水平無顯著差異(p>0.05);高劑量暴露組胎盤DI-2和DI-3的mRNA表達水平顯著下降(約70%,p<0.01),而DI-1與對照組相比無顯著差異(p>0.05)。
2.4 十溴聯苯醚暴露對60 d子鼠腦組織脫碘酶表達的影響
BDE 209暴露對雄性子鼠3種脫碘酶mRNA表達水平影響如圖3所示。與對照組比較,低劑量暴露組子鼠腦組織DI-1的mRNA表達水平顯著升高(約300%,p<0.01),DI-3的mRNA表達水平顯著降低(約70%,p<0.01),而DI-2的mRNA表達水平無顯著差異(p>0.05);高劑量暴露組子鼠腦組織DI-1的mRNA表達水平顯著升高(約140%,p<0.05),而DI-2和DI-3的mRNA表達水平無顯著差異(p>0.05)。
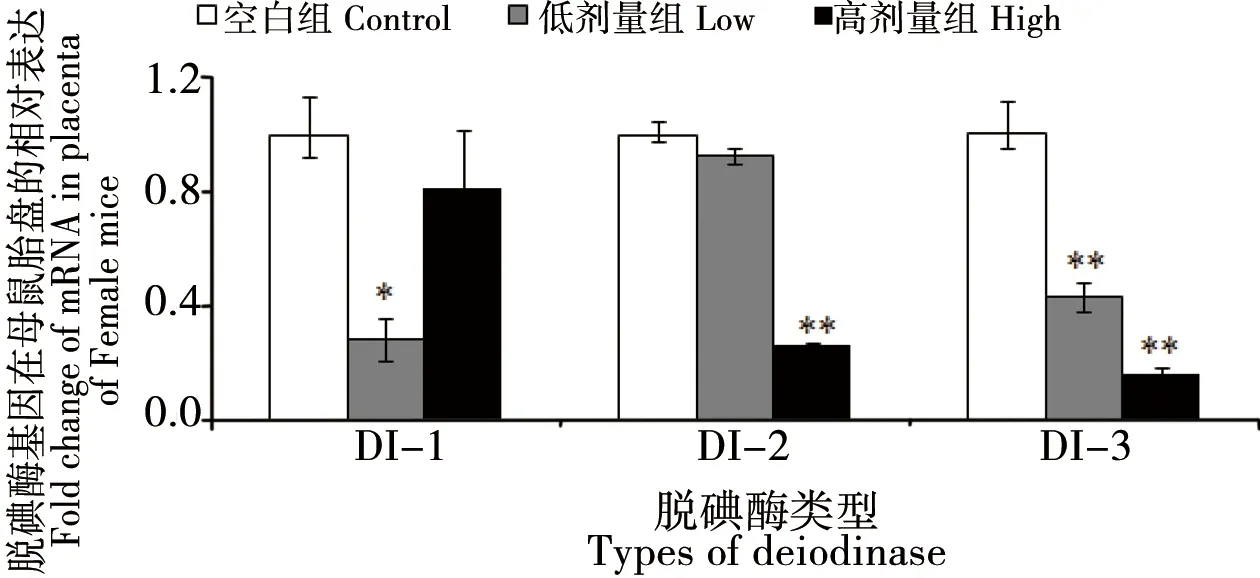
圖2 孕哺期BDE 209暴露對母鼠胎盤脫碘酶基因表達影響注:*與對照組比較,p<0.05;**與對照組比較,p<0.01。Fig. 2 Effect of BDE 209 exposure on deiodinase gene expression in the placenta of miceNote: *compared with the control, p<0.05;**compared with the control, p<0.01.
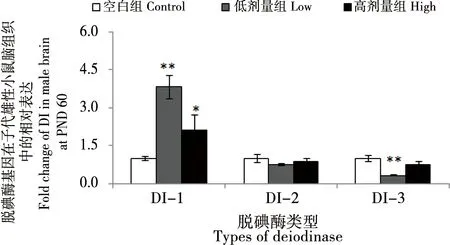
圖3 孕哺期BDE 209暴露對雄性子鼠大腦腦組織脫碘酶基因表達影響注:*與對照組比較,p<0.05;**與對照組比較,p<0.01。Fig. 3 Effect of BDE 209 exposure on deiodinase gene expression in the brain of male miceNote: *compared with the control, p<0.05; **compared with the control, p<0.01.
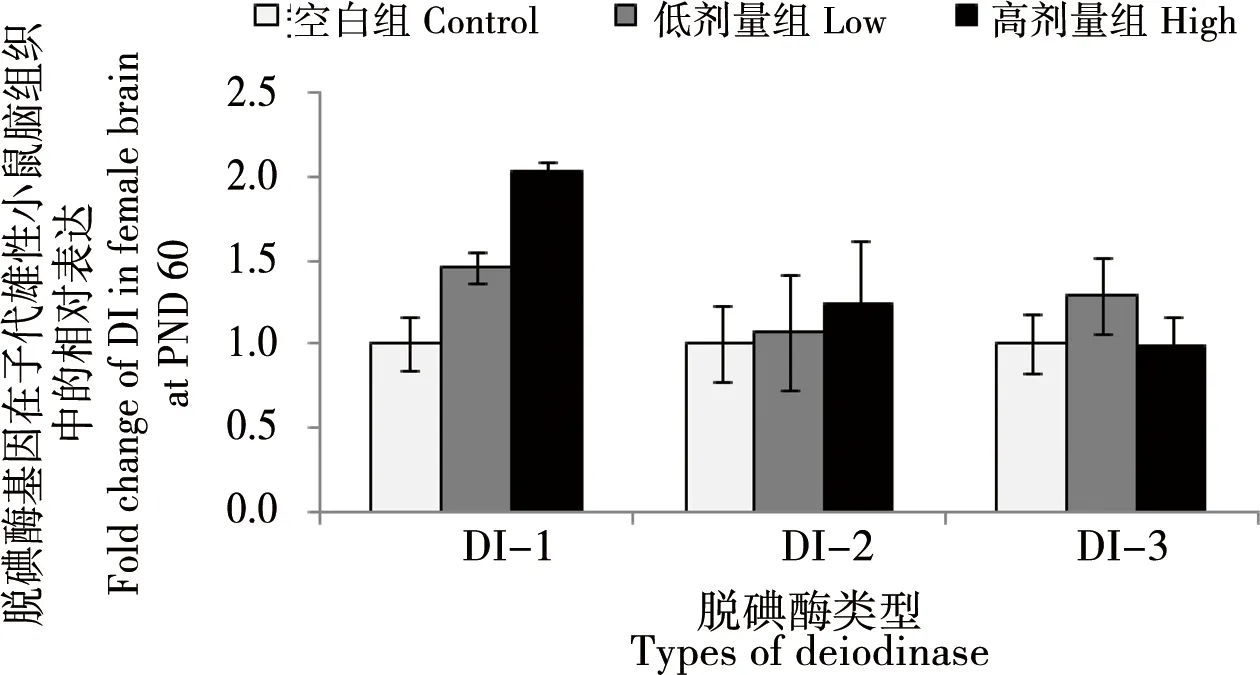
圖4 孕哺期BDE 209暴露對雌性子鼠大腦腦組織脫碘酶基因表達影響注:*與對照組比較,p<0.05;**與對照組比較,p<0.01。Fig. 4 Effect of BDE 209 exposure on deiodinase gene expression in the brain of female miceNote: *compared with the control, p<0.05;**compared with the control, p<0.01
BDE 209暴露對雌性子鼠腦組織3種脫碘酶基因表達影響如圖4所示。與對照組比較,低劑量和高劑量暴露組子鼠腦組織中3種脫碘酶的mRNA表達水平均無顯著差異(p>0.05)。
3 討論(Discussion)
大量動物研究表明,PBDEs具有神經發育毒性效應,主要表現在出生后子代運動行為異常,認知能力降低,學習和記憶能力下降等[14]。本研究通過建立孕哺期BDE 209暴露模型,評價出生60 d子鼠神經發育毒性效應。水迷宮試驗結果顯示,BDE 209暴露可導致雌、雄子鼠空間記憶能力降低,且具有劑量-效應關系,這與Eriksson和Rice等人在不同種屬小鼠中的研究結果一致[15]。PBDEs神經發育毒性機制目前還不清楚,可能與神經細胞凋亡、神經干細胞分化和遷移,以及鈣信號傳導通路有關[3]。近年來許多研究顯示,PBDEs對甲狀腺激素具有干擾作用[16]。鑒于甲狀腺激素在腦發育中的重要作用,有觀點認為,PBDEs神經發育毒性可能與其甲狀腺激素干擾作用有關,但其具體作用途徑不清。
眾所周知,甲狀腺激素對早期胚胎發育(特別是大腦的發育)起著關鍵作用。在胚胎自身甲狀腺形成、分泌和行使甲狀腺激素功能之前(小鼠孕17 d),胎兒甲狀腺激素主要來源于母體[17]。為避免胚胎暴露于母體高濃度甲狀腺激素(特別是T3)之下,甲狀腺激素脫碘酶DI-3在胎盤、胎腦以及胎肝等重要組織器官的表達和活性增高[18]。胎盤是連接母鼠與胎鼠的第一道屏障,DI-3在胎盤中的高表達和高活性可能體現了其在胚胎發育早期的保護作用[17]。動物研究顯示,DI-3基因敲除對小鼠神經發育具有損傷作用,其表現程度遠超過DI-1與DI-2雙基因敲除導致的神經發育損害效應,表明DI-3的保護作用在早期神經發育過程中具有重要意義[19]。本研究中,低劑量和高劑量BDE 209孕期暴露均導致母鼠胎盤DI-3基因表達下調,并與其誘導的子鼠神經毒性效應(學習記憶能力下降)相似,呈現劑量-反應關系,提示胎盤DI-3可能在孕哺期BDE 209暴露誘導的子代神經發育毒理效應中具有重要作用。另外,本實驗顯示,低劑量和高劑量BDE 209暴露對胎盤DI-1和DI-2基因表達影響并不一致,低劑量暴露引起胎盤DI-1基因表達下調,對DI-2基因表達無顯著影響,而高劑量暴露則恰恰相反,提示胎盤組織中DI-1和DI-2可能在將母體循環中的T4轉化為T3功能上具有互補作用。
3種脫碘酶在成年小鼠的神經組織中也有表達,其功能在于維護局部腦組織細胞內T3的穩定,以保證神經細胞的正常活動[20],因此推測,脫碘酶在小鼠腦組織中的表達和活性異常可能導致神經功能障礙。本研究對孕哺期BDE 209暴露后出生60 d子鼠腦組織中3種脫碘酶基因表達進行了觀察,結果顯示,BDE 209低劑量和高劑量暴露均引起雄性子鼠腦組織中DI-1基因表達上調,而低劑量暴露導致雄鼠腦組織中DI-3基因表達下調,但不同暴露水平對DI-2基因表達沒有顯著影響。不同于T4,外周循環中的T3不能通過血腦屏障,神經細胞中的T3主要由DI-2轉化形成。DI-2主要存在于神經膠質細胞中,將循環中的T4脫碘生成有活性的T3,并通過轉運體(MCT8)運輸到神經元中行使功能,而DI-3只分布于神經元,通過將T4降解生成γT3或滅活T3生成T2控制細胞內T3濃度[21]。DI-2和DI-3這種在不同神經細胞分布的獨特性可能有著重要生理意義。膠質細胞是神經系統分布最多的細胞,也是構成神經垂體主要細胞,由于膠質細胞具有較強的抗氧化能力[22]。而氧化損傷是PBDEs的主要毒性機制之一,因此分布在膠質細胞中的DI-2比神經元中的DI-3不易受到PBDEs損傷,這與上述本實驗觀察結果相符。DI-2的這種分布特性及功能特點可穩定腦組織T3生成及垂體通過促甲狀腺素(TSH)調節甲狀腺功能,這可能也是在多數PBDEs誘導甲狀腺素干擾的研究結果中并未發現血液中TSH改變的一個原因[6]。DI-1在神經系統分布較少,與在外周組織不同,DI-1在腦組織中可能并不參與T3生成(主要由D2完成),其作用主要可能是清除DI-3降解T4過程中生成的γT3[21]。γT3是T3競爭性抑制劑,它不僅可通過抑制T3與其受體結合阻礙T3的作用,而且能夠通過阻礙T3進入細胞內導致細胞內T3水平降低,因此DI-1具有“清道夫”之稱[23]。基于DI-1在腦中的這種功能特點,DI-1表達和活性的改變可能是DI-3活動的應答反應。
PBDEs對動物的神經毒性作用與大腦所處的發育階段有關。研究顯示,小鼠出生后10 d之前暴露PBDEs能誘發神經毒性效應,而之后暴露多不能產生影響[24]。另外,PBDEs對動物的神經毒性作用與其在大腦中的累積和代謝過程有關。例如,BDE 99在大鼠出生10 d時暴露可導致適應性降低等神經毒性效應,而BDE 209在相同時間點暴露則不能誘發癥狀,可能與BDE 209在腦中的累積速度較慢有關[24]。本研究結果顯示,孕哺期BDE 209暴露對出生后60 d雌鼠腦組織中的3種脫碘酶的基因表達均沒有顯著影響,而對雄鼠腦組織DI-1和DI-3基因表達水平有顯著影響,表明BDE 209在體內代謝過程或在神經系統中蓄積速度具有性別差異性。此外,本研究發現,盡管孕哺期BDE 209暴露對60 d子代雄鼠腦組織的DI-1和DI-3基因表達水平有顯著影響,子代雄鼠呈現了與同齡子代雌鼠相似(或稍低)的神經毒性效應,提示孕哺期BDE 209暴露誘導神經發育毒性效應可能是永久性的,主要源于對胚胎早期神經發育的損傷,并可能是通過對胎盤脫碘酶(主要是DI-3)的影響造成的,而BDE 209在成鼠腦組織的蓄積對腦脫碘酶產生的影響可能是有限的、暫時的、或可逆轉的,這可能與脫碘酶在成鼠神經細胞的分布和功能特點有關。
本研究對出生后子代小鼠的生長體重進行了動態觀察(見表1),結果顯示第2、16天雌、雄子鼠體重均無明顯變化,表明孕哺期BDE 209暴露對子代生長發育沒有明顯影響。而出生第30天時所觀察到的體重改變,且在第60天時得到恢復,顯示孕期BDE 209暴露對子代體重生長的作用可能與BDE 209在體內代謝和蓄積過程有關,從而進一步證實BDE 209在體內代謝和蓄積過程可能有性別差異,這與上述BDE 209在成鼠腦組織的作用分析是一致的。
綜合上述結果和分析,孕哺期BDE 209暴露對母體胎盤甲狀腺激素脫碘酶(特別是DI-3)的影響可能是其神經發育毒性效應的機制之一。
參考文獻:
[1] Anderson H A, Imm P, Knobeloch L, et al. Polybrominated diphenyl ethers (PBDE) in serum: findings from a US cohort of consumers of sport-caught fish [J]. Chemosphere, 2008, 73(2): 187-194
[2] Foster W G, Gregorovich S, Morrison K M, et al. Human maternal and umbilical cord blood concentrations of polybrominated diphenyl ethers [J]. Chemosphere, 2011, 84(10): 1301-1309
[3] Costa L G, Giordano G. Is decabromodiphenyl ether (BDE-209) a developmental neurotoxicant? [J]. Neurotoxicology, 2011, 32(1): 9-24
[4] Zhao X, Wang S, Li D, et al. Effects of perchlorate on BDE-47-induced alteration thyroid hormone and gene expression of in the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 1176-1185
[5] 張寶. 環境中毒物誘發甲減對胎兒神經系統發育的影響[J]. 中國科技信息, 2013, (11): 165
[6] 劉早齡, 張建清. 多溴聯苯醚對甲狀腺激素干擾毒性的研究進展[J]. 環境與職業醫學, 2010, 27(2): 107-112
Liu Z L, Zhang J Q. Progress in toxicity of polybrominated diphenyl ethers on the thyroid hormone disruption [J]. Journal of Environmental & Occupational Medicine, 2010, 27(2): 107-112 (in Chinese)
[7] Costa L G, Giordano G. Developmental neurotoxicity of polybrominated diphenyl ether (PBDE) flame retardants [J]. Neurotoxicology, 2007, 28(6): 1047-1067
[8] 劉圓圓, 冀秀玲, 沈群輝, 等. 六溴環十二烷及其復合污染腦發育期暴露對大鼠甲狀腺激素代謝過程的影響[J]. 生態環境學報, 2012, 21(9): 1614-1619
Liu Y Y, Ji X L, Shen Q H, et al. Disrupting Effects of Hexabromocyclododecane (HBCD) and its complex compounds on rat thyroid hormone metabolism after developmental exposure [J]. Ecology and Environment Sciences, 2012, 21(9): 1614-1619 (in Chinese)
[9] 冀秀玲, 劉洋, 劉芳, 等. 六溴環十二烷轉甲狀腺素蛋白結合活性及其發育期暴露的甲狀腺激素干擾效應研究[J]. 環境科學, 2010, 31(9): 2191-2195
Ji X L, Liu Y, Liu F, et al. Transthyretin-binding activity of hexabromocyclododecanes (HBCDs) and its thyroid hormone disrupting effects after developmental exposure [J]. Environmental Scicence, 2010, 31(9): 2191-2195 (in Chinese)
[10] Galton V A, Schneider M J, Clark A S, et al. Life without thyroxine to 3,5,3'-triiodothyronine conversion: studies in mice devoid of the 5'-deiodinases [J]. Endocrinology, 2009, 150(6): 2957-2963
[11] 蔡振偉, 沈永年. 脫碘酶及影響其酶活性的因素[J]. 中國煤炭工業醫學雜志, 2005, 8(3): 209-211
[12] Heredia L, Torrente M, Colomina M T, et al. Behavioral effects of oral subacute exposure to BDE-209 in young adult mice: A preliminary study [J]. Food and Chemical Toxicology, 2012, 50(3): 707-712
[13] Noyes P D, Hinton D E, Stapleton H M. Accumulation and debromination of decabromodiphenyl ether (BDE-209) in juvenile fathead minnows (Pimephalespromelas) induces thyroid disruption and liver alterations [J]. Toxicological Sciences, 2011, 122(2): 265-274.
[14] Viberg H, Johansson N, Fredriksson A, et al. Neonatal exposure to higher brominated diphenyl ethers, hepta-, octa-, or nonabromodiphenyl ether, impairs spontaneous behavior and learning and memory functions of adult mice [J]. Toxicological Sciences, 2006, 92(1): 211-218
[15] Rice D C, Thompson W D, Reeve E A, et al. Behavioral changes in aging but not young mice after neonatal exposure to the polybrominated flame retardant decaBDE [J]. Environmental Health Perspectives, 2009, 117(12): 1903
[16] Lee E, Kim T H, Choi J S, et al. Evaluation of liver and thyroid toxicity in Sprague-Dawley rats after exposure to polybrominated diphenyl ether BDE-209 [J]. The Journal of Toxicological Sciences, 2010, 35(4): 535-545
[17] 李茂全, 陳純海, 王艷艷. 甲狀腺激素與胚胎期腦發育[J]. 成都醫學院學報, 2010, 5(3): 260-265
Li M Q, Chen C H, Wang Y Y. Thyroid hormones and embryonic brain development [J]. Journal of Chengdu Medical College, 2010, 5(3): 260-265 (in Chinese)
[18] 楊雪鋒, 徐健, 郭懷蘭, 等. 長期過量碘攝入對小鼠母-胎甲狀腺激素代謝的影響[J]. 中華內分泌代謝雜志, 2006, 22(6): 532-534
Yang X F, Xu J, Guo H L, et al. Effects of long-term excessive iodine intake on the maternal-fetal thyroid hormone metabolism in mice [J]. Chinese Journal of Endocrinology and Metabolism, 2006, 22(6): 532-534 (in Chinese)
[19] Gereben B, Zavacki A M, Ribich S, et al. Cellular and molecular basis of deiodinase-regulated thyroid hormone signaling [J]. Endocrine Reviews, 2008, 29(7): 898-938
[20] Bernal J. Action of thyroid hormone in brain. Journal of endocrinological investigation, 2002, 25(3): 268-288
[21] Courtin F, Zrouri H, Lamirand A, et al. Thyroid hormone deiodinases in the central and peripheral nervous system [J]. Thyroid, 2005, 15(8): 931-942
[22] 謝玉豐. 神經膠質細胞與突觸可塑性研究新進展[J]. 生理科學進展, 2007, 38(2): 111-115
Xie Y F. The updated advancements in synaptic plasticity mediated by glial cells [J]. Progress in Physiological Sciences, 2007, 38(2): 111-115 (in Chinese)
[23] Holtorf K. Understanding Local Control of Thyroid Hormones. National Academy Hypothyroidism [OL]. 2012. (http://nahypothyroidism.org/deiodinases/)
[24] 彥世帥, 徐海明, 秦展芬. 多溴二苯醚毒理學研究進展及展望[J]. 生態毒理學報, 2010, 5(5): 609-617
Yan S S, Xu H M, Qin Z F. Research progress and future perspectives in toxicology study on polybrominated diphenyl ethers [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 609-617 (in Chinese)

