氧化樂果對小球藻的毒性研究
宋志慧,劉 冰
青島科技大學 環境與安全工程學院,山東青島 266042
我國作為一個農業大國,農藥被大量大范圍使用,農藥的污染時時刻刻影響著水生態系統。在過去的幾十年中,有機磷農藥已經在農業和家庭應用中取代有機氯農藥,并被廣泛應用于農業和公共衛生,包括殺蟲劑,殺線蟲劑,殺螨劑,和殺菌劑。基本上都被用作殺蟲劑和神經毒劑。自從有機磷農藥被人們認識,有機磷的公眾暴露水平,職業和非職業性,急性或慢性也引起人們的關注,并且已經嚴重影響了人類的健康[1]。如今,各式各樣的具有多種生物學特性的有機磷農藥的廣泛使用使得在全世界,特別是在發展中國家,有機磷中毒已經成為發病率和死亡率的一個主要原因[2]。目前國內外已有大量關于有機磷農藥對人類健康、無脊椎動物、魚類、浮游植物的影響及其毒理學研究的報道[3-12],Gama-Flores等[10]研究了農藥甲基對硫磷在不同食物密度(小球藻)條件下對角突臂尾輪蟲的急性和慢性毒性,研究表明在小球藻密度為(0.75×106) cells·mL-1時,甲基對硫磷對角突臂尾輪蟲的24 h-LC50為(2.783±0.316) mg·L-1,在小球藻密度為(3×106) cells·mL-1時,甲基對硫磷對角突臂尾輪蟲的24 h-LC50為(6.52±0.77) mg·L-1。
世界衛生組織建議對農藥的分類,認為氧化樂果為高度危險(Ib類),對大鼠的LD50為50 mg·kg-1體重。目前國內外學者對于氧化樂果的研究主要集中在氧化樂果的檢測方法[13~16]、殘留分析[17~18]、毒性研究[19-22]等方面。氧化樂果作為一種廣泛使用的有機磷農藥,由于它主要作用于乙酰膽堿酯酶,抑制動物的神經傳導,對它的毒性研究也主要集中在對動物的研究。楊帆,鄒容[19]發現氧化樂果對黃顙魚幼魚在靜態條件下的安全濃度分別為16.94 μg·L-1,而在半靜態條件下的安全濃度為15.78 μg·L-1;E1-Banhawy[20]發現氧化樂果對巴西一種捕食性螨蟲的 LC50為1.2 mg·kg-1。這些毒理學研究在一定程度上為環境監測提供了依據,但在農藥對水環境的污染越來越嚴重的今天,隨著對有毒物質的生態效應的研究由單一物種向生態系統整體效應的更大關注,農藥對生態系統的初級生產者——藻類的毒性及其生態毒理學研究也已經引起了國內外學者的廣泛重視。
藻類作為水生生態系統的初級生產者,能通過光合作用,為無脊椎動物、魚類、水鳥等生物提供O2、食物,其種類多樣性和初級生產量直接影響水生態系統的結構和功能。目前國內外關于農藥對藻類的毒性研究已有一些報道,但大多數是研究除草劑[23~27]、重金屬[28~29]對于藻類的毒性研究,Andrzej等[28]研究發現重金屬抑制小球藻生長的作用順序為:銅>鉛>鎘;Qian等人[24]研究了除草劑草丁瞵(glufosinate)、阿特拉津(atrazine)和禾草靈(diclofop-methyl)對小球藻基因轉錄的影響,他們發現這3種供試藥物對小球藻光合作用基因psbC和rbcL相對表達量有顯著地抑制作用。
目前關于氧化樂果對藻類的毒理學研究還較少,而且我們發現大多數對藻類的毒理學研究集中在抗氧化酶系統的研究,對硝酸還原酶系統的影響卻鮮有報道,因此本文研究了氧化樂果對小球藻的毒性研究,通過對硝酸還原酶活性、葉綠素含量的研究,為陸地上農藥合理使用提供決策依據,同時也了解了氧化樂果對小球藻的毒害作用。
1 材料和方法(Materials and methods)
1.1 儀器與試劑
儀器:722型分光光度計(上海精密科學儀器有限公司),GXZ型智能培養箱(寧波江南儀器廠),LDZ4-0.8A離心機(北京醫用離心機廠)。
試劑:磺胺等化學試劑為國產分析純試劑。
1.2 實驗材料
40%氧化樂果乳油,購于山東大成農藥廠。
小球藻,由中國海洋大學海洋生命學院提供。
試驗用培養基及所有器皿均經過121 ℃高壓滅菌15 min,采用BG-11培養基,藻種在無菌條件下置于250 mL錐瓶中培養,培養液100 mL,溫度25±2 ℃,光暗比14:10,光強4 000 Lux,每天振搖4次,每次15 min。培養3代,待鏡檢細胞正常,選擇對數生長期的藻液進行試驗。
1.3 實驗設計
將達到對數生長期的小球藻5 mL接種于100 mL的HB4培養液中,每個瓶中加入準備好的氧化樂果母液,使其成系列濃度,并設置一個對照組(0 mg·L-1),每個濃度設3個平行。靜止培養,每天定時人工搖動3次,每隔24 h取樣,取樣前充分搖勻藻液。
1.4 預實驗
通過查閱相關文獻,根據確定的毒性范圍配置一系列濃度梯度的染毒液(0.1、1、10、20、30、40、50 mg·L-1),在上述培養條件下隔天測定藻液在660 nm處吸光度,根據測定結果發現氧化樂果對小球藻的96 h-EC0和96 h-EC100分別為為0.5 mg·L-1、30 mg·L-1。
1.5 氧化樂果對小球藻的急性毒性試驗
根據預實驗結果,設計系列染毒濃度(1、5、10、15、20 mg·L-1),并設置一個對照組(0 mg·L-1),每個濃度設3個平行。在上述測定條件下進行各個指標的測定。
1.5.1 氧化樂果對小球藻的EC50的測定
據實驗所設濃度用分光光度計在660 nm處測其初始吸光度,以后每隔天測一次吸光度。通過將氧化樂果濃度的對數(lnC)為橫坐標,抑制百分率的概率單位為縱坐標做標準曲線,用概率單位法得到氧化樂果對小球藻的EC50。
1.5.2 硝酸還原酶活性的測定

以μg NaNO2·L-1·Abs作為酶活單位。NaNO2的濃度可根據亞硝酸鈉標準曲線計算得到。
1.5.3 葉綠素含量的測定
培養條件不變的前提下,隔天取實驗組和空白組5 mL藻液置于離心管中,3 000 r·min-1力離心10 min,棄去上清液,加入5 mL蒸餾水洗滌,3 000 r·min-1力離心10 min,棄去上清液,將沉淀懸浮于5 mL無水乙醇中將提取液放入冷藏室,提取24 h,然后將提取液在3 000 r·min-1力離心10 min,在645 nm和663 nm處測上清液的吸光度。
葉綠素(a + b)含量的計算[31]:
Ca+b=20.2A645+8.02A663
1.5.4 數據分析
數據均用平均值表示,用Origin 8.0對試驗的數據進行制圖,采用SPSS 19.0在p=0.05的置信水平對硝酸還原酶活性、葉綠素含量的變化情況進行單因素方差分析(One-Way ANOVA)。
2 結果(Results)
2.1 氧化樂果對小球藻生物量的影響
由圖1可以看出濃度小于1 mg·L-1時,前6 d小球藻生物量與對照組相比無明顯變化,隨時間增加到第6天時實驗組小球藻生物量出現明顯降低,說明低濃度氧化樂果短時間內對小球藻的細胞生長沒有影響;氧化樂果濃度大于5 mg·L-1時,細胞的生長從第二天起就受到較強的抑制,實驗組的細胞生物量明顯小于對照組,說明高濃度氧化樂果在作用初期就抑制了小球藻的細胞生長,而且氧化樂果濃度越高,抑制作用表現越明顯,同時我們發現在第6天之后,小球藻生物量出現一定的補償增長。同時由圖2可以看出實驗進行到第8天時,總體來說隨著受試氧化樂果濃度的增加,小球藻的生物量在降低,氧化樂果濃度和小球藻的生物量的相關性方程為y=0.319-0.0455x,由此可知氧化樂果濃度和小球藻的生物量之間呈負相關,相關系數R2為0.65755。同時由表2還可以看出各處理組之間以及對照組和處理組之間均存在顯著性差異(p<0.05)。
2.2 氧化樂果對小球藻EC50的影響
氧化樂果對小球藻的概率單位—濃度對數曲線方程和EC50如表1所示。從表1看出,氧化樂果對小球藻的EC50值隨時間增加處于下降狀態。
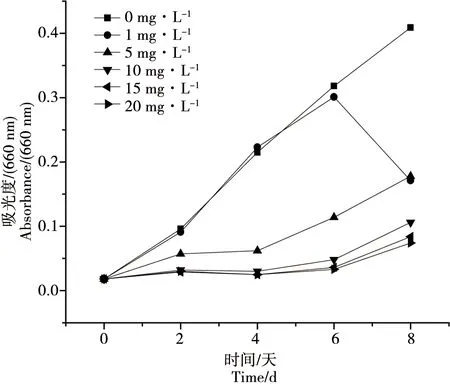
圖1 氧化樂果對小球藻生長量的影響(660 nm)Fig. 1 Toxic effects of omethoate on the biomass of Chlorella vulgaris (660 nm)
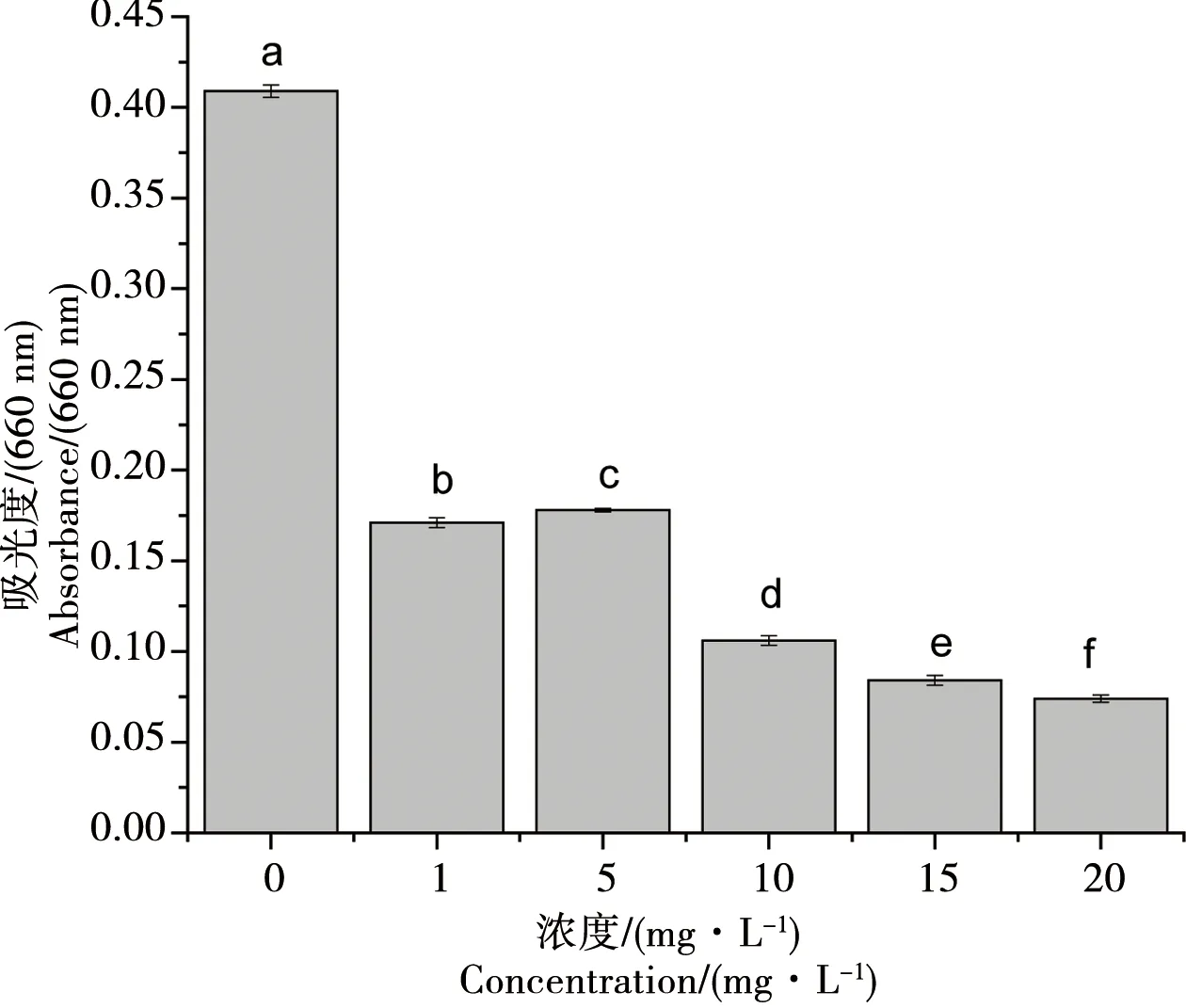
圖2 氧化樂果對小球藻生長量的影響(8 d)Fig. 2 Toxic effects of omethoate on the biomass of Chlorella vulgaris (8 d)

表1 氧化樂果對小球藻概率單位—濃度對數曲線方程和EC50Table 1 Regression curve of probit-concentration logarithm and EC50 of omethoate to Chlorella vulgaris
2.3 氧化樂果對小球藻硝酸還原酶活性的影響
由圖3可知,1、15、20 mg·L-1處理組之間相比較無顯著差異(p>0.05),1、15、20 mg·L-1處理組與1、10 mg·L-1處理組和對照組之間相比均存在顯著差異(p<0.05)。實驗進行到第8天時,氧化樂果濃度在0~5 mg·L-1范圍內,隨著氧化樂果濃度的升高,相比于對照組增加了12.7%,小球藻硝酸還原酶活性逐漸上升;當到達5 mg·L-1時,硝酸還原酶活性開始下降,隨著氧化樂果濃度的升高,小球藻硝酸還原酶活性逐漸降低,但仍高于對照組。
2.4 氧化樂果對小球藻葉綠素含量的影響
由圖4可知,在實驗進行到第6天時,氧化樂果對葉綠素b含量的影響實驗中,5 mg·L-1處理組與1 mg·L-1和對照組之間無顯著性差異(p>0.05),其余各濃度組之間、各濃度組與對照組之間均存在顯著差異(p<0.05),并且隨氧化樂果濃度的增加,小球藻體內葉綠素的含量整體呈下降趨勢,而且空白組藻體內的葉綠素a、葉綠素b、葉綠素總含量都明顯高于濃度組。
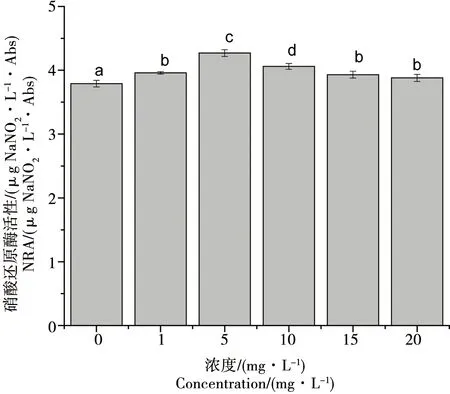
圖3 氧化樂果對小球藻硝酸還原酶活性的影響Fig. 3 Toxic effects of omethoateo on nitrate reductase activity of Chlorella vulgaris
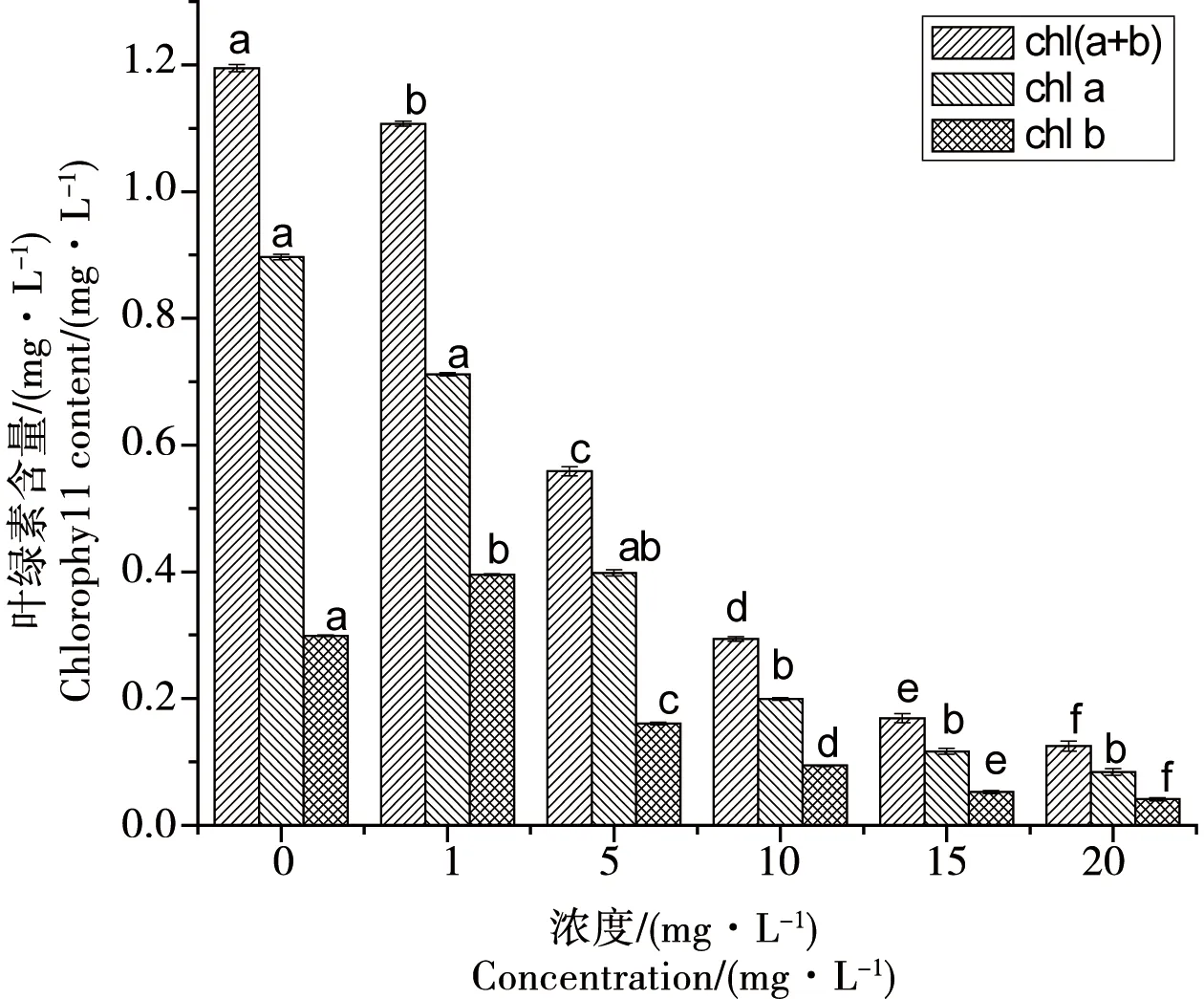
圖4 氧化樂果對葉綠素含量的影響(6 d)Fig. 4 Toxic effects of omethoate on chlorophyll content of Chlorella vulgaris(6 d)
3 討論(Discussion)
方漢孫等[32]人研究發現,在0.001、0.01、0.1 mg·L-1敵敵畏3個質量濃度處理下,赤潮異彎藻第3~5 d的相對增長率顯著高于對照組,在1、10 mg·L-1質量濃度處理下,最初微藻增長受抑制,在培養7 d之后出現一定補償增長現象。由圖1我們看出低濃度氧化樂果(1 mg·L-1)在前6 d對小球藻細胞增長影響不大,高濃度(大于5 mg·L-1)則在初期就表現為抑制,氧化樂果濃度與細胞數量之間表現為負相關(R2=0.65755),如方漢孫的研究結果一致,而且在后期也出現一定的補償增長現象。
裴國鳳等[33]研究發現,以生物量計,三聚氰胺抑制近頭狀偽蹄形藻和斜生柵藻生長的72 h-EC50值分別是537.67 mg·L-1和485.17 mg·L-1,為較低的毒性效應。本實驗中氧化樂果對小球藻96 h-EC50值為4.88 mg·L-1,屬于中毒,同時由表1可以看出,隨著受試氧化樂果濃度的增加,EC50值呈降低趨勢,可能是由于隨毒物作用時間的延長,藻細胞分裂速度減慢,死亡速度增加,導致細胞密度下降EC50值降低。也可能是由于培養時間的延長,而在此期間又不添加營養物,導致營養的缺乏或其它理化條件的改變,進而藻細胞數減少,EC50下降。

葉綠素的含量水平是植物生長能力大小的直接表現。當一定濃度的有機磷作用于小球藻,會使細胞生理活性降低,從而降低細胞對微量元素的吸收作用,尤其是鐵、鎂等元素的吸收量大大降低,這就進一步導致了小球藻體內葉綠素含量的降低。方漢孫等[32]同時發現低濃度敵敵畏對赤潮異彎藻葉綠素a的影響表現為促進作用,高濃度則表現為抑制;岳文潔等[37]也通過對氯氰菊酯對海洋卡盾藻Chl.a含量的影響的研究發現,低濃度氯氰菊酯對海洋卡盾藻葉綠素a的影響表現為促進作用,高濃度則表現為抑制,這些研究結果與本實驗結果大體一致。圖4反映出當氧化樂果濃度高于1 mg·L-1時,隨氧化樂果濃度的增加葉綠素含量下降,可能是小球藻葉綠素含量對氧化樂果反應比較靈敏,則總體表現為抑制作用。
硝酸還原酶活性和葉綠素含量分別體現了氮代謝水平的速率和光合作用的大小。這兩個指標對于藻細胞的生長都起到關鍵作用,因此對這兩個指標的研究具有一定的代表性。從實驗結果我們可以認為氧化樂果對小球藻生長的影響是通過抑制葉綠素的形成,進而抑制光和作用來實現的,這與劉青等[38]人的研究結果一致,且與硝酸還原酶活性相比,葉綠素的含量能更靈敏的反映這種損傷,故而葉綠素含量能夠作為一種有效的生物標志物對氧化樂果引起的毒性做出評價。而且目前對于藻類的毒理學研究很多,其研究指標不止包括葉綠素含量、硝酸還原酶活性,還包括各種抗氧化酶活性[39]、葉綠素熒光特征[40]等指標,因此,關于氧化樂果對小球藻細胞的毒理學研究的具體機理還需進一步探究。
參考文獻:
[1] Etemad L, Moshiri M, Moallem S A. Basic and Clinical Toxicology of Organophosphorus Compounds [M]. 2014, 79-118
[2] Soltaninejad K, Shadnia S. Basic and Clinical Toxicology of Organophosphorus Compounds [M]. 2014, 25-43
[3] Pavlic M, Haidekker A, Grubwieser P, et al. Fatal intoxication with omethoate [J]. International Journal of Legal Medicine, 2002, 116: 238-241
[4] 姚新民, 周志俊. 長期接觸低劑量有機磷農藥對人體健康影響的研究進展[J]. 環境與職業醫學, 2008, 25(4): 409-412
Yao X M, Zhou Z J. Advances in human health effects of long-term exposure to low doses of organophosphorus pesticides [J]. Journal of Environmental & Occupational Medicine, 2008, 25(4): 409-412
[5] 徐光翠, 鄢珣, 張波. 有機磷農藥對雄性生殖系統的損傷作用[J]. 甘肅農業大學學報, 2005, 40(6): 822-826
Xu G C, Yan X, Zhang B. Injury of organophosphorus pesticide on male reproductive system [J]. Journal of Gansu Agricultural University, 2005, 40(6): 822-826
[6] 來有鵬, 劉賢金, 余向陽, 等. 農藥對河蝦的急性毒性及其谷光甘肽轉移酶(GSTs)的影響[J]. 農藥, 2008, 47(11): 820-822
[7] 何東海, 孟范平, 朱小山. 有機磷農藥對海洋動物乙酰膽堿酯酶(AChE)的毒性效應研究進展[J]. 海洋通報, 2003, 22(6): 71-78
He D H, Meng F P, Zhu X S. Organophosphorus pesticides in marine animals acetylcholinesterase (AChE) toxicity effect research progress [J]. Marine Bulletin, 2003, 22(6): 71-78 (in Chinese)
[8] 陳朝陽, 許淼清, 謝進金. 二種農藥對金魚的急性毒性研究[J]. 泉州師范學院學報(自然科學), 2005, 23(6): 78-81
Chen C Y, Xu M Q, Xie J J. The acute toxicity of two kinds of pesticides on goldfish study [J]. Journal of Quanzhou Normal College: Natural Science, 2005, 23(6) : 78-81 (in Chinese)
[9] 劉梅, 劉贊. 低濃度有機磷農藥樂果促進普通小球藻生長的研究[J]. 焦作工學院學報, 1998, 17(5): 396-399
Liu M, Liu Z. Low concentration of organophosphorus pesticide dimethoate promote commonChlorellagrowth research [J]. Journal of Jiaozuo Institute of Technology, 1998, 17(5): 396-399 (in Chinese)
[10] Gama-Flores J L, Sarma S S S, Nandini S. Acute and chronic toxicity of the pesticide methyl parathion to the rotiferBrachionusangularis(Rotifera) at different algal (Chlorellavulgaris) food densities[J]. Aquatic Ecology, 2004, 38: 27-36
[11] Ferrando M D, Sancho E, Andreu-Moliner E. Accumulation of tetradifon in an algae (Nannochlorisoculata) and the cladoceran,Daphniamagna[J]. Bulletin of Environmental Contamination and Toxicology, 1996, 57: 139-145
[12] Kent R A, Caux P Y. Subletthal effect of the insecticide fenitrothion on freshwater phytoplankton [J]. Canadian Journal of Botany-Revue Canadienne de Botanique, 1995, 73: 45-53
[13] Yu G T, Yao M W, Lian B Y, et al. Simultaneous determination of omethoate and dichlorvos by capillary electrophoresis [J]. Bulletin of Environmental Contamination and Toxicology, 2008, 81(2): 210-215
[14] Hollosi L, Mittendorf K, Senyuva H Z. Coupled turbulent flow chromatography: LC-MS/MS method for the analysis of pesticide residues in grapes, baby food and wheat flour matrices [J]. Chromatographia, 2012, 75: 1377-1393
[15] Wang Y, Sun Y S, Huang J H, et al. Determination of omethoate by cathodically sweeping oscillopolarography [J]. Wuhan University Journal of Natural Sciences, 1998, 3(4): 469-472
[16] 鞠芳芳, 張喜軒, 孫體健, 等. 氣相色譜和氣相色譜/質譜法檢測生物樣品中氧化樂果[J]. 中國衛生檢驗雜志, 2009, 19(12): 2729-2730
Ju F F, Zhang X X, Sun T J, et al. Gas chromatography and gas chromatography/mass spectrometry detection in biological samples omethoate [J]. Chinese Journal of health inspection, 2009, 19(12): 2729-2730 (in Chinese)
[17] Smart N A. Organophosphorus pesticide residues in fruits and vegetables in the United Kingdom and some other countries of the European Community since 1976 [J]. Environmental Contamination and Toxicology, 1987, 98: 99-160
[18] 韓梅, 易盛國, 侯雪, 等. 結球甘藍中氧化樂果殘留量的測定[J]. 現代農業科技, 2010, 5: 147-148
Han M, Yi S G, Hou X, et al. Determination of omethoate residues in head cabbage [J]. Modern Agricultural Science and Technology, 2010, 5: 147-148 (in Chinese)
[19] 楊帆, 鄒容. 3種有機磷農藥對黃顙魚幼魚的急性毒性試驗[J]. 安徽農業科學, 2010, 38(4): 1872-1873
Yang F, Zou R. Acute toxicity test of three kinds of organophosphorus pesticides onPelteobogrusfulvidracolarvae[J]. Anhui Agricultural Sciences, 2010, 38(4): 1872-1873 (in Chinese)
[20] E1-Banhawy E M. Residual toxicity of some common acaricides in brazil to the predacious miteAmblyseiusbrazilli[J]. , 1976, 21(3): 303-306
[21] 葛士林, 曹傳旺, 王志英. 3種農藥對紅裸須搖蚊體內蛋白質質量分數和AChE活性的影響[J]. 東北林業大學學報, 2011, 39(1): 108-109, 126
Ge S L, Cao C W, Wang Z Y. Three kinds of pesticides onPropsilocerusakamusiTokunagain vivo protein mass fraction and the impact of AChE activity [J]. Journal of Northeast Forestry University, 2011, 39(1): 108-109, 126 (in Chinese)
[22] 徐光翠. 氧化樂果對雄性小鼠生殖系統損傷的研究[D]. 甘肅: 甘肅農業大學, 2005: 1-46
[23] Junghans M, Backhaus T, Faust M, et al. Toxicity of sulfonylurea herbicides to the green algaScenedesmusvacuolatus: Predictability of combination effects [J]. Bulletin of Environmental Contamination and Toxicology. 2003, 71: 585-593
[24] Qian H F, Chen W, Sun L W, et al. Inhibitory effects of paraquat on photosynthesis and the response to oxidative stress inChlorellavulgaris[J]. Ecotoxicology, 2009, 18(5): 537-543
[25] Ma J, Liang W, Xu L, et al. Acute Toxicity of 33 herbicides to the green algaChlorellapyrenoidosa[J]. Bulletin of Environmental Contamination and Toxicology, 2001, 66: 536-541
[26] Ma J, Liang W. Acute Toxicity of 12 herbicides to the green algaeChlorellapyrenoidosaandScenedesmusobliquus[J]. Bulletin of Environmental Contamination and Toxicology, 2001, 67: 347-351
[27] Ma J, Lin F, Wang S, et al. Acute toxicity assessment of 20 herbicides to the green alga scenedesmus quadricauda (Turp.) Breb [J]. Bulletin of Environmental Contamination and Toxicology, 2004, 72: 1164-1171
[28] Andrzej B. Suppression ofChlorellavulgarisgrowth by cadmium, lead, and copper stress and its restoration by endogenous brassinolide [J]. Archives of Environmental Contamination and Toxicology, 2011, 60(3): 406-416
[29] Simona C, Nicola L, Giovanna S, et al. Physiological and morphological responses of lead or cadmium exposedChlorellasorokiniana211-8K (Chlorophyceae) [J]. SpringerPlus, 2013, 2: 147
[30] 宋志慧編. 水生生態毒理學實驗[M]. 北京: 化學工業出版社, 2008: 18-19
[31] 楊敏文. 快速測定植物葉片葉綠素含量方法的探討[J]. 光譜實驗室, 2002, 19(4): 478-481
Yang M W. Method of rapid determination of plant leaf chlorophyll content of leafs [J]. Chinese Journal of Spectroscopy Laboratory, 2002, 19(4): 478-481(in Chinese)
[32] 方漢孫, 張磊, 段舜山. 有機磷農藥敵敵畏對赤潮異彎藻(Heterosigmaakashiwo)的毒物刺激效應[J]. 生態環境學報, 2010, 19(5): 1025-1029
Fang H S, Zhang L, Duan S S. The stimulating effect of organophosphorus pesticide dichlorvos onHeterosigmaakashiwo[J]. Ecology and Environmental Sciences, 2010, 19(5): 1025-1029 (in Chinese)
[33] 裴國鳳, 劉國祥. 三聚氰胺對藻類的毒性效應研究[J]. 水生生物學報, 2010, 34(5): 973-978
Pei G F, Liu G X. Toxic effects of melamine on algae [J]. Acta Hydrobiologica Sinica, 2010, 34(5): 973-978 (in Chinese)
[34] 吳麗. 生物源農藥和有機磷農藥對銅綠微囊藻生長及生理影響[D]. 南京: 南京師范大學, 2011: 1-37
[35] 孫穎穎, 劉筱瀟, 閻斌倫. 對羥基苯甲酸對2種赤潮微藻生長的影響[J]. 環境科學與技術, 2010, 33(7): 36-39
Sun Y Y, Liu X X, Yan B L. Impact of hydroxy acid on two kinds of red tide algae growth [J]. Environmental Science & Technology, 2010, 33(7): 36-39 (in Chinese)
[36] 宋志慧, 黃國蘭, 劉新程. 五氯酚對鹽澤螺旋藻的毒性研究[J]. 上海環境科學, 2000, 9: 441-443
Song Z H, Huang G L, Liu X C. Toxic studies of pentachlorophenol onMicrocystisaeruginos[J]. Shanghai Environmental Sciences, 2000, 9: 441-443(in Chinese)
[37] 岳文潔, 王朝暉, 王橋軍, 等. 氯氰菊酯對海洋卡盾藻的毒性效應[J]. 生態毒理學報, 2009, 4(2): 251-257
Yue W J, Wang Z H, Wang Q J, et al. Toxic effects of cypermethrin on algaeChattonella[J]. Asian Journal of Ecotoxicology, 2009, 4(2): 251-257 (in Chinese)
[38] 劉青, 張曉芳, 李太武. 光照對4種單胞藻生長速率、葉綠素含量及細胞周期的影響[J]. 大連水產學院學報, 2006, 21(1): 24-30
Liu Q, Zhang X F, Li T W. Impact of light on growth rate, chlorophyll content and cell cycle of four kinds ofChlamydomonas[J]. Journal of Dalian Fisheries University, 2006, 21(1): 24-30 (in Chinese)
[39] 聶湘平, 鹿金雁, 李瀟, 等. 諾氟沙星(norfloxacin)對蛋白核小球藻(Chlorellapyrenoidosa)生長及抗氧化酶活性的影響[J]. 生態毒理學報, 2007, 2(3): 327-332
Nie X P, Lu J Y, Li X, et al. Growth and antioxidant enzyme activity of norfloxacin onChlorellapyrenoidosa[J]. Asian Journal of Ecotoxicology, 2007, 2 (3) : 327-332 (in Chinese)
[40] 王帥, 梁英, 田傳遠. Cd2+脅迫對6株微藻生長及葉綠素熒光特性的影響[J]. 海洋湖沼通報, 2009, 3: 155-166
Wang S, Liang Y, Tian C Y. Cd2+stress on six microalgae growth and chlorophyll fluorescence characteristics [J]. Transactions of Oceanology and Limnology, 2009, 3: 155-166

