利用人皮膚模型評價殺菌類農藥的腐蝕/刺激性
張光甫,劉薇,*,邢立國,胥維
1. 大連理工大學環境學院工業生態與環境工程教育部重點實驗室,大連 116024 2. 中化集團沈陽化工研究院有限公司,沈陽110027
化妝品、農藥等接觸類物質,依據安全管理要求,進入市場之前須經過皮膚腐蝕/刺激性測試。傳統檢測方法都采用活體動物皮膚實驗,給實驗動物造成巨大的痛苦,而且每年動物使用量呈逐年增加趨勢,不符合“3R”原則[1]。為了減少動物使用,體外皮膚模型替代方法的開發和驗證取得快速發展,開發了如Episkin、SkinEthic和EpiDerm皮膚模型等[2-4]。歐洲替代方法驗證中心(ECVAM)經過大量的驗證工作,于2007年4月公告Episkin可作為Draize皮膚刺激性替代方法,成為第一個被認證的模型,隨后EpiDerm、SkinEthic也得到認證。2008年美國EPA、NIH和NIP協議未來十年內減少動物在化學品安全評價中的使用,歐盟立法2009年3月起禁止動物實驗用于化妝品安全性評價[5],進一步推動了皮膚模型替代方法的發展和應用。我國在重組皮膚模型的研究,近年來也取得了較快的發展[6-8]。
目前體外皮膚模型在農藥化學品評價中的應用非常有限,仍需進一步研究。我國作為農藥品生產大國,農藥品的腐蝕/刺激性替代方法的研究同樣迫在眉睫。殺菌劑作為農藥中重要的一類產品,近年來的使用量和整體比重呈上升趨勢[9]。目前國內的皮膚腐蝕/刺激性檢驗,主要依據動物皮膚腐蝕/刺激性檢測方法(GB15670-1995)。本研究通過人皮膚模型在殺菌類農藥皮膚腐蝕/刺激性評價中應用,為動物實驗替代方法用于農藥類化學品安全性評價提供依據。
1 實驗材料(Materials)
1.1 試劑與儀器
試劑:人表皮角化細胞(HEK)、成人真皮纖維原細胞(HDF-a)(上海佛雷堡生物有限公司),K-SFM培養基(Gibco公司),鼠尾膠原(北京鴻躍有限公司),DMEM培養基、0.25%胰酶(0.04%EDTA)、胎牛血清(Hyclone公司),MTT試劑(BioSHARP公司),TritonX-100、正辛酸、十二烷基硫酸鈉SLS分析純試劑(國藥藥業有限公司)、人白介素-1aELISA試劑盒(R&D公司),10種農藥包括嘧菌酯原藥、肟菌酯原藥、丁香菌酯原藥、唑胺菌酯原藥、苯醚菌酯原藥、唑菌酯原藥、SYP-11545、SYP-14380、SYP-13409、SYP-12194純度均在95%以上(中國中化集團公司提供)、大耳白兔(日本)。
儀器:Transwell細胞培養板(Corning公司),倒置顯微鏡(CKX31,Olympus公司),CO2培養箱(Sanyo公司),離心機(5430,Eppendorf公司),多功能酶標儀(BIO-TEK公司)。
1.2 實驗方法(Methods)
1.2.1 人皮膚模型的建立
人皮膚模型的構建方法,依據EpiDerm的構建原理。皮膚模型包括表皮層和真皮層兩部分,分別通過利用成人真皮纖維原和鼠尾膠原模擬具有支撐作用的真皮層,利用人角化細胞模擬上面的表皮層,從而得到構建的皮膚模型[10-11]。
由人成纖維細胞和鼠尾膠原蛋白混合培養模擬真皮層。(1)將生長狀態良好的人成纖維細胞消化、重懸,制成約為5×105個·mL-1濃度的細胞懸液;(2)冰浴條件下,取1 mL鼠尾膠原與60 μL 0.1 mol·L-1NaOH溶液混合;(3)迅速將鼠尾膠原混合液與4 mL細胞懸液混合;(4)將以上混合液以每孔600 μL的量加入Transwell,在37 ℃培養箱中放置0.5~1 h,待膠原凝固后,加入2 mL含10%胎牛血清的DMEM培養基,浸沒培養5~6 d,隔天換液。
HEK細胞在上述真皮層基質表面上模擬表皮層。(5)接種2×106個·mL-1濃度的人角化細胞,同時更換為K-SFM培養基,隔天換液。(6)每天觀察細胞生長狀態,當表層角化細胞融合率達90~95%時,改為氣液培養5~6 d,表面細胞角質化,獲得所需的人皮膚模型。
1.2.2 人皮膚模型的屏障功能測試
皮膚模型方法相比細胞毒性實驗,其三維結構更好的模擬了人皮膚,可反映不同細胞之間的級聯毒性作用。且細胞實驗對低溶解度化合物進行測試時,結果可能受助溶劑干擾,而人皮膚模型則不受測試物的劑型的影響。同時皮膚模型模擬了皮膚中具有屏障功能的角質層,提高其與動物測試方法結果的一致性。利用1%聚乙二醇辛基苯基醚(TritonX-100)評價皮膚模型的屏障功能[2]。TritonX-100(1%)在皮膚模型上作用不同時間點t=0、1、2、3、4、5 h,用無菌PBS沖洗皮膚模型5~6次,最后利用MTT法測定模型活性(OD570),計算得出組織活性減少50%時所需的作用時間(ET50)。
進一步利用十二烷基硫酸鈉(SLS)對皮膚模型屏障性驗證[12],將不同濃度SLS(c=0、0.16、0.8、4、20、100 mg·mL-1)作用于皮膚模型,作用時間達到18 h后,用無菌PBS去掉殘留農藥,最后用MTT法測定組織模型活性(OD570),計算組織活性減少50%時,所需的暴露劑量(IC50)。
1.2.3 皮膚腐蝕和刺激性測試方法
皮膚模型腐蝕性測試方法參考OECD化學品測試指南(TG431)[13]。待測化學物按25 μL·cm-2(液體)或25 mg·cm-2(固體),均勻作用于皮膚模型(N=3)3 min或1 h,之后利用MTT法測定組織模型的活性。通過相對細胞活性評價待測品的腐蝕性。
皮膚模型的刺激性測試方法,依據OECD化學品測試指南(TG439)[14]。首先待測化學物按25 μL·cm-2(液體)或25 mg·cm-2(固體),均勻涂于皮膚模型作用15 min,之后用無菌PBS沖洗,再將皮膚模型轉移到新培養基中繼續培養42 h,最后通過測定培養基中組織活性和白介素-1a,判斷待測品的刺激性。白介素-1a(IL-1a)是皮膚受到刺激時,產生的一種細胞因子,含量與待測物的刺激性存在劑量效應關系[15]。皮膚模型暴露42 h后,通過ELISA法測定培養基中IL-1a含量,首先取42 h培養后的培養液和試劑盒中的IL-1a標準品,分別按40 μL和50 μL的量加入96孔板,每個樣品做2個平行對照;在樣品孔中加入10 μL一抗和50 μL的酶標試劑,標準品中只加50 μL酶標試劑,蓋上封板膜37 ℃溫育60 min;洗滌液洗板5次,加入A、B兩種顯色液,避光37 ℃顯色10 min,最后每孔加入50 μL終止液,在450 nm處測定吸光度。利用標樣首先繪制標準曲線:Y=0.009X+0.021,當X=60時,Y=0.561。根據繪制的標準曲線和酶標儀450 nm處對樣品的測定結果,計算IL-1a含量并用pg·mL-1表示。即:光吸收值大于0.561時,該農藥品能使皮膚組織模型IL-1a量超過60 pg·mL-1,說明該農藥品具有皮膚刺激性。
人皮膚模型對殺菌類農藥品的腐蝕性/刺激性測試,每種受試物進行3個平行測試,采用無菌PBS作為陰性對照,分別采用正辛酸和SLS作為腐蝕性和刺激性測試的陽性對照物。
1.2.4 農藥腐蝕/刺激性動物測試
參考OECD和我國化學品腐蝕/刺激性試驗方法(OECD TG404;GB15670 -1995)設計試驗[16-17]。
液體受試物0.5 mL,固體受試物用0.5%的羧甲基纖維素配制0.5 g·mL-1的懸濁液涂在2.5 cm×2.5 cm大小去毛的一側皮膚上,另一側皮膚作為對照,每組4只兔子平行對照,涂勻后用無刺激性的繃帶和膠布固定。未知受試物具有腐蝕性的情況下,測試過程分3步觀察:(1)作用3 min后移去觀察,如未見嚴重的皮膚反應,繼續作用至1 h后觀察。(2)無明顯反應下,作用4 h后觀察皮膚癥狀,判斷是否具有腐蝕性。(3)無明顯反應下,對兔子皮膚連續觀察24、48、72 h后結束實驗,如出現損傷觀察14 d結束,根據皮膚損傷的程度及恢復情況給出評分,判斷刺激性。
1.2.5 數據處理與判定標準

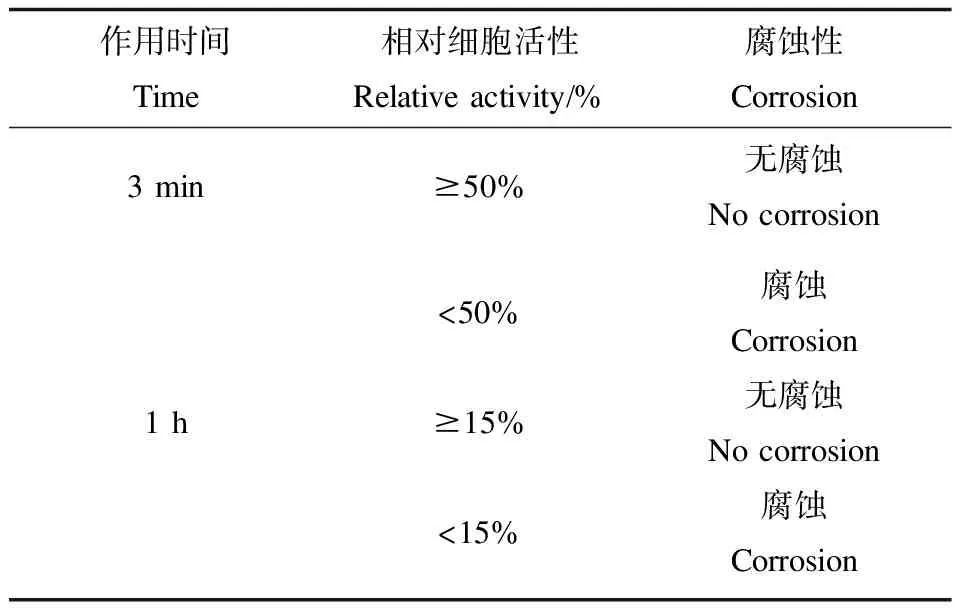
表1 腐蝕性鑒別標準Table 1 Standard of corrosion identification

表2 刺激性鑒別標準Table 2 Standard of irritation identification
2 結果與討論(Results and discussion)
2.1 人皮膚模型的功能評價
本研究建立的皮膚模型陰性對照組細胞相對活性大于0.6,證明皮膚模型具有良好的活性。本研究中,TritonX-100對人皮膚模型的細胞活性的影響,隨時間的延長其活性降低。通過表3的時間-效應關系得出ET50為2.2 h。本實驗為更充分的驗證皮膚模型屏障功能,又選用了SLS對人皮膚模型進行不同濃度的作用測試。表3給出了在不同濃度SLS作用18 h后的相對細胞活性。SLS對皮膚模型的IC50為1.71 mg·mL-1。參考物質TritonX-100和SLS2種化學品對人皮膚模型的ET50大于2 h,IC50在1.0~3.0 mg·mL-1范圍,符合相關參考標準[13-14,18]。
皮膚腐蝕/刺激性的傳統方法是借助實驗動物,觀察動物皮膚對受試物的反應。其生理機制是化學分子透過角質層,損傷細胞引起細胞的死亡,從而釋放大量的細胞因子,激活炎癥反應信號通路。炎癥分子進一步作用于真皮細胞中的基質細胞和內皮細胞,內皮細胞擴張通透性增加最終導致紅斑和水腫。體外構建的皮膚模型測試方法不同于二維細胞毒性試驗,因為細胞毒性方法中的細胞微環境相對皮膚模型與真實皮膚的差異更大,并且忽略了不同細胞之間的相互作用。而體外皮膚模型替代實驗方法正是針對此級聯效應和初始反應設計的。角質層的形成使皮膚模型模擬了受試物與皮膚的作用機制,顯著提高了體外皮膚模型測試結果與動物試驗方法的一致性,因此體外皮膚模型的屏障功能評價是該替代方法的重要質量控制/質量保證措施。此外,陽性對照物正辛酸和SLS的鑒別結果準確(表4,5)。表明本研究建立的人皮膚模型具有較好的性能,能夠準確反映受試化合物的皮膚腐蝕性/刺激性。
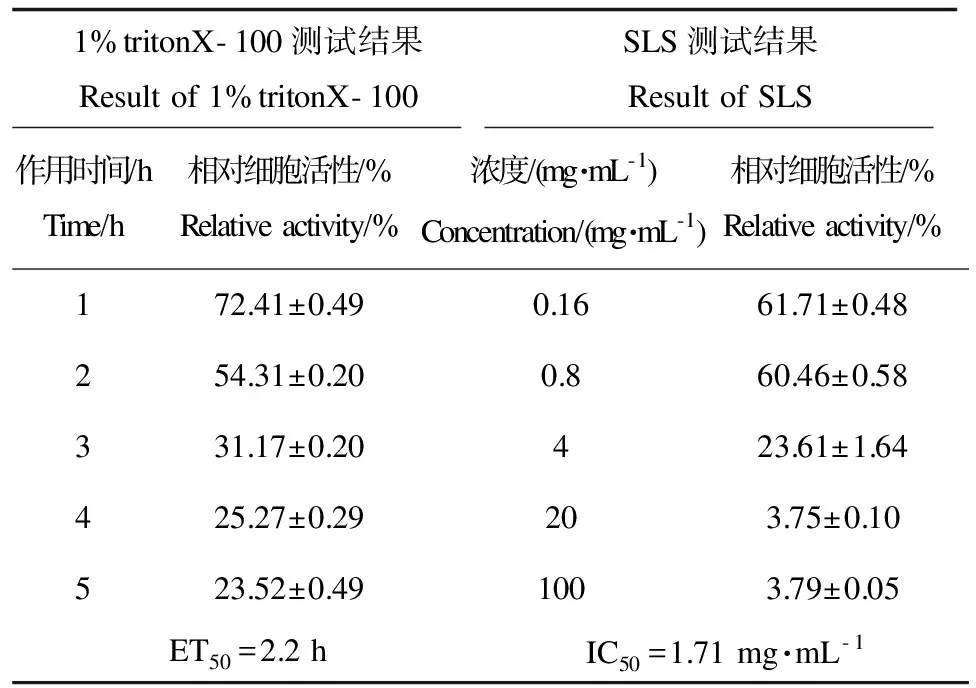
表3 人皮膚模型的屏障功能測試Table 3 Test of the barrier function of the human skin model
2.2 人皮膚模型對殺菌類農藥品的腐蝕性測試 3組平行測定的結果,滿足RSD≤18%的要求。在對殺菌類農藥品的動物實驗時,發現在3 min、1 h、4 h暴露作用時間點的皮膚反應中,沒有明顯的變化和損傷。在人皮膚模型對10種殺菌類農藥品3 min暴露作用的腐蝕性預實驗中,測定相對細胞活性都在97%以上。1 h后相對細胞活性降低到61.7~96.0%。3 min時可能由于農藥品與皮膚模型作用時間較短,難以充分反應受試物對皮膚模型的腐蝕性。因此本實驗采用了1 h暴露作用時間,根據1 h后的相對細胞活性判斷,受試物屬于無腐蝕性(表4)。比較皮膚模型和動物測試結果(表4,5),可得出兩者的鑒別結果完全一致。
2.3 人皮膚模型對殺菌類農藥品的刺激性測試
細胞活性作為檢測終點時,皮膚模型對殺菌類農藥品刺激性篩選鑒別結果(圖1)發現農藥品3(丁香菌酯)、5(苯醚菌酯)和7(SYP-11545)具有刺激性,其它無刺激性。動物皮膚刺激性測試結果(表5)表明,農藥品3(丁香菌酯)和4(唑胺菌酯)有刺激性,其它無刺激性。兩種測試方法結果的準確性為70%,進一步對刺激性相關的細胞因子(IL-1a)進行定量分析。刺激反應引起細胞因子包括IL-1a、IL-2和IL-8等[19],其中IL-1a是OECD推薦的一種。Chatterjee等[20]利用皮膚模型對IL-1a和IL-8兩種因子的“時間-劑量”關系分析,發現IL-1a具有更好的對應關系。根據表2的刺激性篩選標準,對相對細胞活性大于50%的測試組進行IL-1a的定量分析。
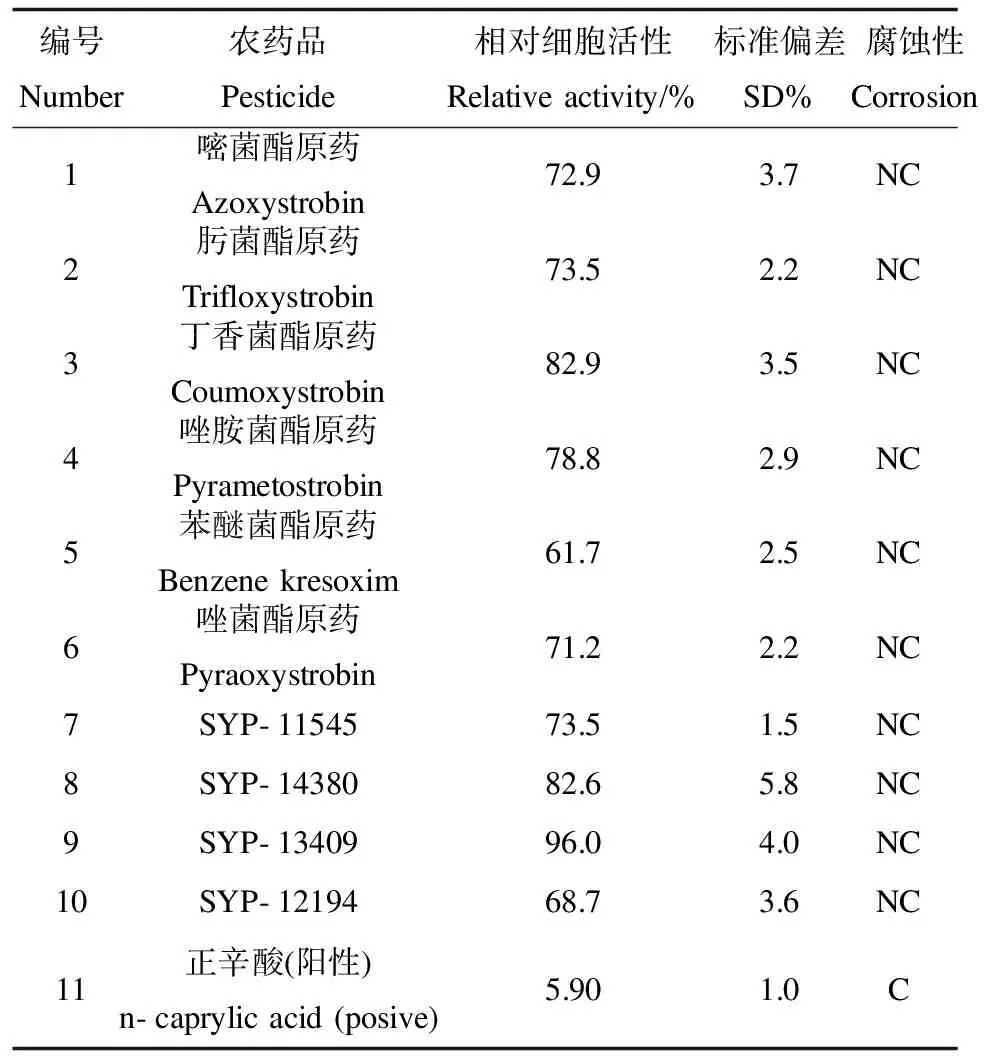
表4 殺菌類農藥對人皮膚模型的腐蝕性Table 4 The corrosion of pesticide on human skin model
注:C表示具有腐蝕性;NC表示為無腐蝕性
皮膚模型刺激性結果中相對細胞活性大于50%農藥品的IL-1a測定結果見圖1。結合細胞相對活性和IL-1a測定結果,具有刺激性的農藥品為3(丁香菌酯)、4(唑胺菌酯)、5(苯醚菌酯)和7(SYP-11545),動物實驗和體外皮膚模型的準確性提高到80%。
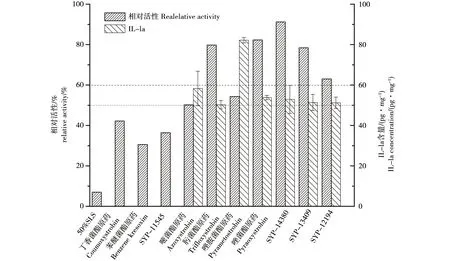
圖1 殺菌類農藥對人皮膚模型的刺激性Fig. 1 The irritation of pesticide on human skin model
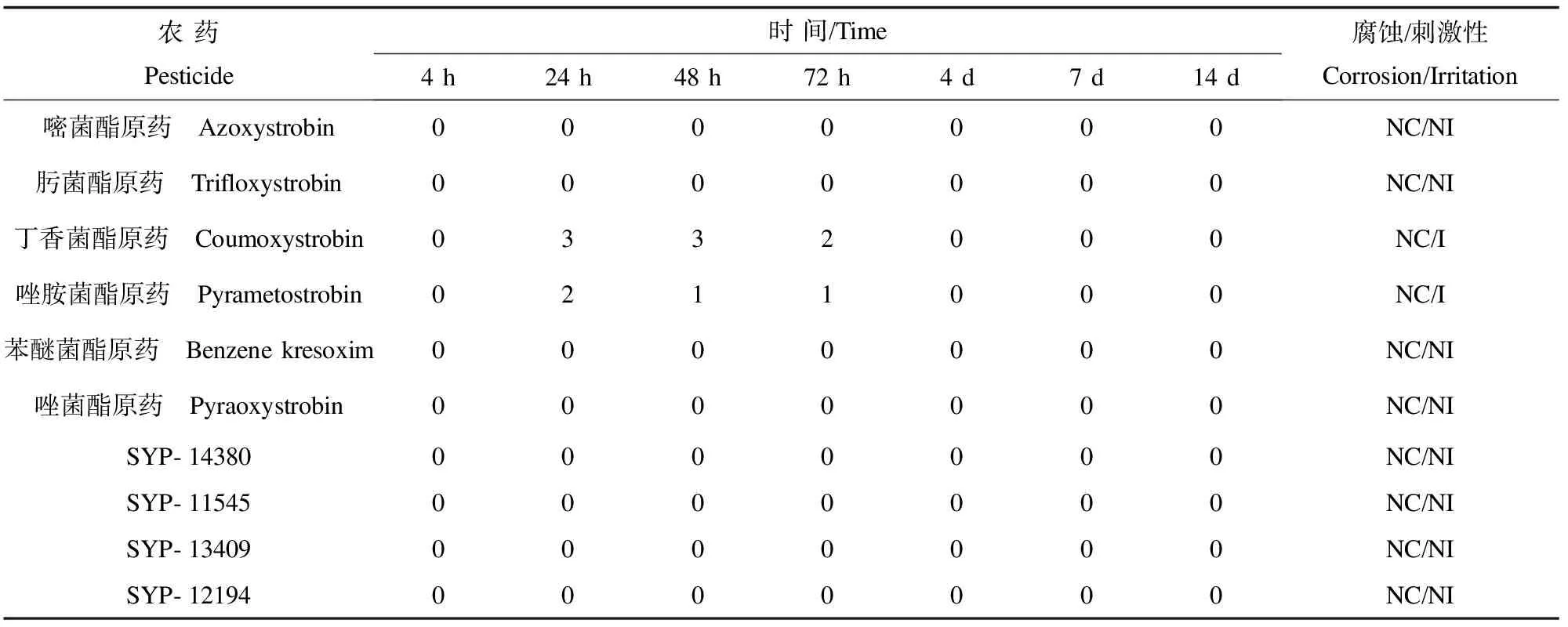
表5 殺菌類農藥的動物皮膚測試結果Table 5 The corrosion/irritation of pesticide on animal skin
目前國際和國內在體外皮膚模型的研究與應用上,已取得一定成果。目前體外皮膚模型真皮層的模擬,包括用無活性的聚合物模擬和具有活性的成纖維細胞作為真皮層。其中采用具有活性的成纖維細胞構建的人皮膚模型,能夠更準確模擬真實人皮膚組織。且人皮膚模型目前主要應用于化妝品的安全性評價[6-8,21-23],鮮有利用皮膚模型在農藥的應用。農藥的腐蝕/刺激性評價是安全評價中重要的部分。利用人皮膚模型替代動物皮膚測試,將會大量減少動物的使用量,替代實驗的研究是今后安全性評價發展的趨勢。本研究利用構建的人皮膚模型檢測農藥的腐蝕/刺激性,采用1 h暴露作用時間的腐蝕性測試,其結果與動物實驗的一致率為100%。刺激性測試中,通過相對細胞活性和IL-1a含量兩個終點信號的測定,使皮膚模型的結果與動物實驗的準確性達到了80%。皮膚模型在殺菌類農藥的應用初步表現出良好的性能,通過模型建立的優化和測試終點的篩選,在農藥的安全性評價中有良好的應用前景。此外,目前對于體外皮膚模型的建立,所使用材料如Transwell培養板的價格較昂貴,廉價或可重復利用支架材料的開發,將會有利于降低實驗成本,促進人皮膚模型的推廣和應用。
致謝:感謝沈陽化工研究院安全性評價中心謝明工程師在實驗中的支持和幫助。
參考文獻:
[1] Frank N, Lehr C M. The human epidermis models EpiSkin, SkinEthic and EpiDerm: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity and substance transport [J]. Pharmaceutics and Biopharmaceutics, 2005, 6: 167-178
[2] Kidd D A, Johnson M, Clements J, et al. Development of an in vitro corrosion/irritation prediction assay using the EpiDerm skin model [J]. Toxicology in Vitro, 2007, 21: 1292-1297
[3] Spielmann H, Hoffmann S, Liebsch M, et al. The ECVAM International Validation on in vitro tests for acute skin irritation: Report on the validity of the EMISKIN and EpiDerm assays and on the skin integrity function test [J]. Alternatives to Laboratory Animals, 2007, 35: 559-601
[4] Macfarlane M, Penny J. A tiered approach to the use of alternatives to animals testing for the safety assessment of cosmetics: Skin irritation [J]. Regulatory Toxicology and Pharmacology, 2009, 54: 188-196
[5] Andrea S, Oelgeschlager M. Developmental toxicity testing in the 21stcentury: The sword of Damocles shattered by embryonic stem cell assays? [J]. Archives of Toxicology, 2011, 85: 1361-1372
[6] 程樹軍, 秦瑤. 體外重建人體皮膚模型刺激試驗的驗證[J]. 實驗動物與比較醫學, 2012, 32(3): 243-246
[7] 鄒運動, 鄭洪艷. 基于人體皮膚模型的ECVAM體外皮膚刺激驗證研究[J]. 毒理學雜志, 2008, 22(3): 226-229
[8] 程樹軍, 焦紅. 體外構建的皮膚模型InspectskinI修復裸鼠全層皮膚缺損[J]. 中山大學學報, 2009, 30(2): 132-135
Cheng S J, Jiao H. Restoration of full-thickness skin defect in nude mice by skin model InspectskinI constructed in vitro [J]. Journal of Sun Yat-Sen University (medical sciences), 2009, 30(2): 132-135 (in Chinese)
[9] 宋衛國, 李寶聚, 趙志輝, 等. 殺菌劑安全風險及解決途徑[J]. 中國蔬菜, 2008, 1(9): 1-4
[10] Tinois E, Tiollier J, Gaucherand M, Thivolet J, et al. In vitro and post-transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute [J]. Experimental Cell Research, 1991, 193: 310-319
[11] Cannon C L, Neal P J. New epidermal model for dermal irritancy testing [J]. Toxicology in Vitro, 1994, 8: 889-891
[12] Faller C, Bracher M. Reconstructed skin kit: Reproducibility of cutaneous, irritancy testing, skin pharmacol [J]. Skin Physiology, 2002, 15: 74-91
[13] OECD. OECD guidelines for the testing of chemicals, no. 431: In vitro skin corrosion; Human skin model test [S]. Paris, France, 2004
[14] OECD. OECD guidelines for the testing of chemicals, no. 439: In vitro skin irritation; Human skin model test [S]. Paris, France, 2010
[15] Angela C, Jackie Morton. The effects of nickel and chromium on human keratinocytes: Differences in viability, cell associated metal and IL-1a release [J]. Toxicology In Vitro, 2007, 21: 809-819
[16] OECD. OECD guidelines for the testing of chemicals, no. 404: Acute dermal irritation/corrosion. Organisation for Economic Co-operation and Development [S] Paris, France, 2002
[17] 國家農業部. GB15670-1995農藥登記毒理學試驗方法[S]. 國家技術監督局, 北京, 1995
[18] 程樹軍, 焦紅. 建立體外重建人體皮膚模型刺激試驗的驗證標準[J]. 中山大學學報, 2009, 5(2): 183-189
Cheng S J, Jiao H. Validation criterion for reconstruct human skin model to skin irritation [J]. Journal of Sun Yat-Sen University, 2009, 5(2): 183-189 (in Chinese)
[19] 程樹軍, 潘芳. 體外皮膚刺激模型的生物標志研究進展[J]. 中國比較醫學雜志, 2010, 20(3): 64-68
Cheng S J, Pan F. Progress on biomarkers of skin irritation model in vitro [J]. Chinese Journal of Comparative Medicine, 2010, 20(3): 64-68 (in Chinese)
[20] Abhijit C, Mandip S, et al. In vitro and in vivo comparison of dermal irritancy of jet fuel exposure using EpiDerm cultured human skin and hairless rats [J]. Toxicology Letters, 2006, 167: 85-94
[21] 李中良, 伍津津. 用于替代皮膚刺激試驗的組織工程表皮模型的構建研究[J]. 中國修復重建外科雜志, 2011, 25(2): 129-132
Li Z L, Wu J J. Experimental study on constructing a tissue engineered epidermis for replacement of skin irritation in vitro [J]. Chinese Journal of Reparative and Reconstructive Surgery, 2011, 25(2): 129-132 (in Chinese)
[22] 金巖, 呂紅兵. 人全層組織工程皮膚的研制[J]. 實用口腔醫學雜志, 2002, 18(2): 163-166
Jin Y, Lv H B. Development of human tissue engineered skin with full thickness [J]. Journal of Practical Stomatology, 2002, 18(2): 163-166 (in Chinese)
[23] Ghalbzouri A, Siamari R. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential [J]. Toxicology in Vitro, 2008, 22: 1311-1320

