人源DCF1基因原核表達(dá)載體構(gòu)建及蛋白分離純化
王倩 楊眉 馮瑞麗 王嬌 文鐵橋
(上海大學(xué)生命科學(xué)學(xué)院 分子神經(jīng)生物學(xué)實(shí)驗(yàn)室,上海 200444)
人源DCF1基因原核表達(dá)載體構(gòu)建及蛋白分離純化
王倩 楊眉 馮瑞麗 王嬌 文鐵橋
(上海大學(xué)生命科學(xué)學(xué)院 分子神經(jīng)生物學(xué)實(shí)驗(yàn)室,上海 200444)
為了深入研究DCF1(Dendritic Cell Factor 1)基因的作用,以質(zhì)粒pcDNA3.1-DCF1-TAT為模板體外擴(kuò)增得到片段DCF1-TAT,將測(cè)序正確的目的片段克隆入原核表達(dá)載體pET32a,轉(zhuǎn)化大腸桿菌Rosetta(DE3),異丙基-β-D-硫代半乳糖苷(IPTG)誘導(dǎo)表達(dá),并優(yōu)化表達(dá)條件。以尿素溶解包涵體蛋白,并優(yōu)化溶解條件,通過(guò)Ni離子親和層析柱進(jìn)行純化,再透析復(fù)性目的蛋白。用SDS-PAGE檢測(cè)目的蛋白的表達(dá)和純化結(jié)果,并用Western blot進(jìn)行驗(yàn)證。結(jié)果表明,重組表達(dá)載體pET32a-DCF1-TAT構(gòu)建成功,并在大腸桿菌Rosetta中成功表達(dá)。融合蛋白主要以包涵體形式存在,經(jīng)過(guò)尿素溶解,Ni離子親和層析柱純化獲得高純度的目的蛋白。SDS-PAGE和Western blot檢測(cè)結(jié)果顯示蛋白分子量大小與預(yù)期結(jié)果相符。
人源DCF1基因 PTD TAT
DCF1是一種膜蛋白,早先發(fā)現(xiàn)它在神經(jīng)干細(xì)胞的分化中起著重要的作用[1]。新近研究表明DCF1過(guò)量表達(dá)能有效地抑制惡性膠質(zhì)瘤U251細(xì)胞系的增殖、遷移、侵襲能力并且促進(jìn)細(xì)胞凋亡[2]。惡性膠質(zhì)瘤是人類腫瘤中最具致命性的腦腫瘤,預(yù)后性最差,生存中期約為14個(gè)月[3]。顱內(nèi)腫瘤好發(fā)人群主要在20-50歲之間,復(fù)發(fā)率高,給社會(huì)帶來(lái)很大的壓力。當(dāng)前治療膠質(zhì)瘤的策略主要有外科手術(shù)、放射療法、化學(xué)療法、基因治療。為了避免這些治療方法的缺陷,重組蛋白藥物已經(jīng)被運(yùn)用到臨床試
驗(yàn)中。
蛋白質(zhì)不能自由進(jìn)入細(xì)胞,阻礙了蛋白藥物的發(fā)展。對(duì)于腦膠質(zhì)瘤,大分子蛋白治療藥物的運(yùn)輸常常被血腦屏障阻礙。然而,研究表明含有PTD(Protein transduction domain)的融合蛋白能夠穿透細(xì)胞膜和血腦屏障[4,5]。PTD是具有蛋白轉(zhuǎn)導(dǎo)功能的蛋白轉(zhuǎn)導(dǎo)域,由特定的蛋白質(zhì)功能域引領(lǐng)其所承載的蛋白質(zhì)穿過(guò)膜性結(jié)構(gòu)并在細(xì)胞內(nèi)積累。自然界存在3種PTD,目前運(yùn)用較多的是來(lái)自人類Ⅰ型免疫缺陷病毒的TAT蛋白轉(zhuǎn)導(dǎo)結(jié)構(gòu)域[8]。為此本研究構(gòu)建了原核表達(dá)載體pET32a-DCF1-TAT,使用以大腸桿菌為宿主細(xì)胞的原核表達(dá)體系,在大腸桿菌Rosetta(DE3)中實(shí)現(xiàn)DCF1-TAT融合蛋白表達(dá),旨在為深入研究DCF1蛋白功能奠定基礎(chǔ)。
1 材料與方法
1.1 材料
感受態(tài)大腸桿菌HB101,質(zhì)粒pET32a和pcDNA3.1-DCF1-TAT由本實(shí)驗(yàn)室保存;大腸桿菌Rosetta(DE3)菌株由吉永華教授實(shí)驗(yàn)室惠贈(zèng);限制性內(nèi)切酶BamHⅠ和HindⅢ,T4 DNA連接酶,蛋白Marker等購(gòu)自TaKaRa;異丙基β-D-硫代半乳糖苷(IPTG)購(gòu)自Sigma;Ni離子親和層析柱購(gòu)自Millipore;膠回收試劑盒購(gòu)自生工生物工程公司。
1.2 方法
1.2.1 大腸桿菌表達(dá)載體pET32a-DCF1-TAT的構(gòu)建 以質(zhì)粒pcDNA3.1-DCF1-TAT為模板,利用PCR體外擴(kuò)增DCF1-TAT片段,設(shè)計(jì)引物序列為:上游引 物:5'-AAAGGATCCATGGCGGCGCCGAAGGGG AGCC-3';下游引物:5'-AAAAAGCTTTCTTCGTCGC TGTCTCCGCTTCTTCCTGCCATAAATTTCAGAATGA GC-3'(下劃線分別為BamH I和Hind Ⅲ限制性內(nèi)切酶序列)。將PCR產(chǎn)物用1%瓊脂糖凝膠電泳,膠回收試劑盒回收目的片段。
將擴(kuò)增的DCF1-TAT片段和pET32a空載用限制性內(nèi)切酶BamH I和Hind Ⅲ雙酶切,膠回收目的片段并用T4 DNA連接酶于16℃過(guò)夜連接。把連接產(chǎn)物轉(zhuǎn)化入大腸桿菌HB101感受態(tài)細(xì)胞,均勻涂于帶Amp+抗性的LB固體培養(yǎng)基上,于37℃培養(yǎng)箱培養(yǎng)15 h。挑取單菌落接種到含100 mg/L Amp+的LB液體培養(yǎng)基(胰蛋白胨10 g/L;酵母提取物5 g/L;氯化鈉10 g/L)中,于37℃、230 r/min搖床中培養(yǎng)過(guò)夜。使用SDS堿裂解法小量制備質(zhì)粒DNA,進(jìn)行BamH I、Hind Ⅲ雙酶切和測(cè)序鑒定。
1.2.2 誘導(dǎo)表達(dá) 將鑒定正確的重組質(zhì)粒pET32a-DCF1-TAT熱激轉(zhuǎn)化到Rosetta感受態(tài)細(xì)胞中,再鋪于帶Amp+抗性的LB固體培養(yǎng)基上,于37℃培養(yǎng)箱中過(guò)夜培養(yǎng)。次日挑取單菌落接種于2 mL含100 mg/L Amp+的LB液體培養(yǎng)基中,于37℃、230 r/min搖床中培養(yǎng)過(guò)夜。將培養(yǎng)好的菌液按照1∶50的比例接種到50 mL含100 mg/L Amp+的LB液體培養(yǎng)基中,37℃震蕩培養(yǎng)2 h以上,至對(duì)數(shù)生長(zhǎng)期OD600約為0.5時(shí),停止培養(yǎng)。
1.2.2.1 誘導(dǎo)濃度的確定 待菌液OD600約等于0.5時(shí),向溶液中加入IPTG溶液至其終濃度分別為0、0.1、0.6和1.0 mmol/L,放于37℃、230 r/min搖床培養(yǎng)4 h。4℃、8 000 r/min離心2 min,收集菌體,SDS-PAGE電泳(濃縮膠濃度為4%,分離膠濃度為12%)檢測(cè)不同濃度誘導(dǎo)的融合蛋白表達(dá)情況,確定最適IPTG誘導(dǎo)濃度X。
1.2.2.2 誘導(dǎo)時(shí)間的確定 以最適誘導(dǎo)濃度X,溫度37℃,轉(zhuǎn)速230 r/min為固定條件,設(shè)置3個(gè)不同梯度的誘導(dǎo)時(shí)間4、6和8 h分別進(jìn)行誘導(dǎo),SDSPAGE電泳檢測(cè)不同時(shí)間誘導(dǎo)的融合蛋白表達(dá)情況,確定最適IPTG誘導(dǎo)時(shí)間Y。
確定誘導(dǎo)條件為:溫度37℃,轉(zhuǎn)速230 r/min,IPTG濃度X,誘導(dǎo)時(shí)間Y。在此條件下大量培養(yǎng)轉(zhuǎn)化菌株,于4℃、5 000×g離心15 min,收集菌體沉淀,保存于-20℃中備用。
1.2.2.3 融合蛋白的可溶性分析 用適量超聲緩沖液(50 mmol/L Tris-HCl,pH8.0,100 mmol/L NaCl,1 mmol/L PMSF)重懸菌體,300 W,超聲5 s,停7 s冰浴超聲破碎菌體。4℃、5 000×g離心15 min,分別收集菌體沉淀和上清溶液,SDS-PAGE電泳檢測(cè)融合蛋白在菌體沉淀和上清溶液中的溶解情況。
1.2.3 純化包涵體蛋白
1.2.3.1 制備細(xì)胞抽提物 收集并稱重菌體沉淀,按每克(濕重)菌體加3 mL細(xì)胞裂解緩沖液Ⅰ(50 mmol/L Tris-HCl,1 mmol/L EDTA,100 mmol/L NaCl,pH8.0)的比例重懸菌體,再加入4 μL 100 mmol/L
PMSF和80 μL 10 g/L溶菌酶,攪動(dòng)20 min。每克(濕重)菌體加入4 mg脫氧膽酸,繼續(xù)攪動(dòng)。懸液37℃放置,不用磨光玻璃棒攪動(dòng),使其變黏時(shí)每克(濕重)菌體加入20 μL 1 mg/mL DNaseⅠ。裂解液室溫放置,直至不再黏稠。
1.2.3.2 洗滌和變性溶解包涵體蛋白 將細(xì)胞裂解物于4℃、8 000×g離心15 min,棄去上清。菌體重懸于水中,4℃、8 000×g離心15 min。沉淀用包涵體洗滌緩沖液(20 mmol/L Tris-HCl pH8.0,0.5 mol/L NaCl,2 mol/L尿素)重懸后,攪拌25 min,于4℃、8 000×g離心15 min,棄去上清,重復(fù)1次。再用適量的50 mmol/L Tris-HCl pH8.0溶液洗滌1遍,于4℃、8 000×g離心15 min,棄去上清。設(shè)置尿素濃度梯度和溶解時(shí)間梯度確定最佳溶解包涵體條件:用含不同濃度尿素的包涵體溶解緩沖液(20 mmol/L Tris-HCl pH8.0,0.5 mol/L NaCl,4、6、8和10 mol/L尿素)重懸菌體,室溫?cái)嚢枞芙?、2和5 h,4℃、8 000×g離心15 min,分別收集上清溶液。
1.2.3.3 包涵體蛋白純化與復(fù)性 將Ni離子親和層析柱用雙蒸水洗兩遍,加入200 μL填料,再用Binding buffer(300 mmol/L KCl,50 mmol/L KH2PO4,10 mmol/L imidazole,1 mmol/L PMSF)洗兩次。加入9 mL蛋白上清溶液,依次用20、40和60 mmol/L imidazole溶液洗1次,最后用250 mmol/L imidazole溶液洗脫。
將收集的洗脫流出液用稀釋液(20 mmol/L Tris-HCl,pH8.0)按照1∶10的比例稀釋并裝入透析袋,用含適量甘油的0.01 mol/L PBS(pH8.0)透析48 h,每4-8 h更換1次PBS溶液,最后用雙蒸水透析2次,每次6 h。再用超濾濃縮管濃縮透析后的溶液,-80℃保存。采用Western blot的方法對(duì)復(fù)性后的蛋白質(zhì)進(jìn)行檢測(cè)分析。
2 結(jié)果
2.1 表達(dá)載體的構(gòu)建
以質(zhì)粒pcDNA3.1-DCF1-TAT為模板體外擴(kuò)增的DNA片段分子量大小理論值為1 023 bp,圖1-A結(jié)果顯示1 kb附近的條帶為所需的目的DNA片段。將擴(kuò)增得到的DCF1-TAT片段與空載pET32a用限制性內(nèi)切酶BamH I和Hind Ⅲ雙酶切,結(jié)果(圖1-B)顯示,膠回收酶切后的片段與線性載體,連接,進(jìn)一步鑒定重組質(zhì)粒是否連接正確。7個(gè)樣品中有6個(gè)樣品可以酶切出與目的片段大小相符的約1 kb的DNA片段(圖1-C),挑取2號(hào)對(duì)應(yīng)的菌液樣品測(cè)序,測(cè)序結(jié)果表明已將DCF1-TAT片段成功克隆入pET32a載體中。
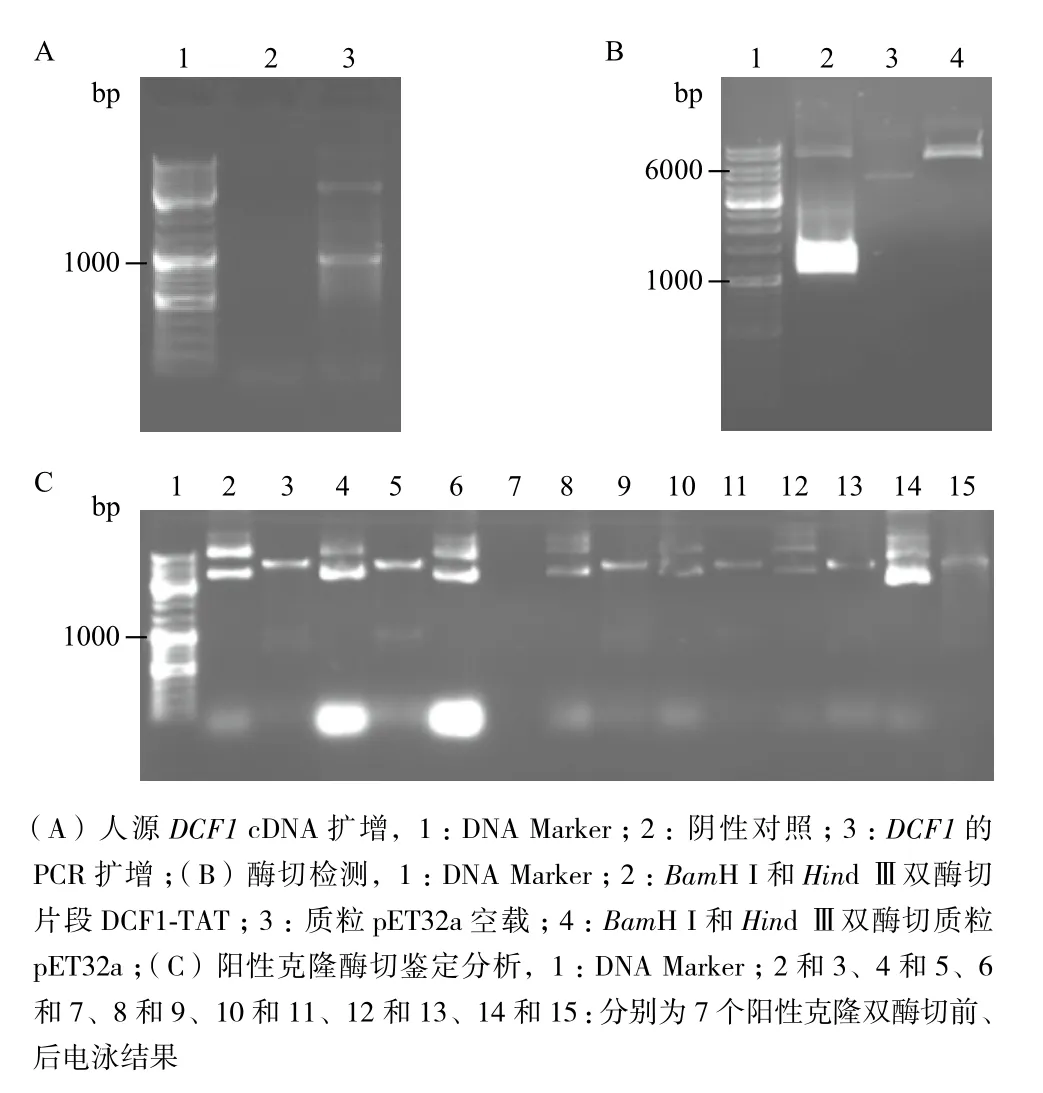
圖1 構(gòu)建表達(dá)載體pET32a-DCF1-TAT
2.2 優(yōu)化誘導(dǎo)表達(dá)融合蛋白的條件
在大腸桿菌的最適生長(zhǎng)溫度(37℃)條件下,分別設(shè)置0、0.1、0.6和1.0 mmol/L IPTG濃度梯度。隨著IPTG濃度的增加,在相同上樣量的情況下,57 kD的蛋白條帶逐漸變粗,且其中0-0.6 mmol/L IPTG誘導(dǎo)的蛋白質(zhì)含量顯著增加,而0.6-1.0 mmol/L誘導(dǎo)的蛋白質(zhì)含量增加趨勢(shì)緩慢(圖2-A)。IPTG濃度過(guò)低不利于蛋白表達(dá),過(guò)高則會(huì)影響菌體生長(zhǎng),選擇最優(yōu)誘導(dǎo)濃度為0.6 mmol/L進(jìn)行誘導(dǎo)。
在4、6和8 h三個(gè)時(shí)間梯度誘導(dǎo)時(shí)發(fā)現(xiàn),誘導(dǎo)6 h的57 kD融合蛋白表達(dá)量最多(圖2-B),選擇最優(yōu)誘導(dǎo)時(shí)間為6 h。
超聲破碎誘導(dǎo)后的菌體,發(fā)現(xiàn)目的蛋白幾乎不溶于上清溶液,而是存在于破碎后的菌體沉淀中(圖2-C)。該蛋白形成了包涵體,必須將包涵體蛋白變
性溶解于上清,才能進(jìn)行后續(xù)的純化蛋白操作。
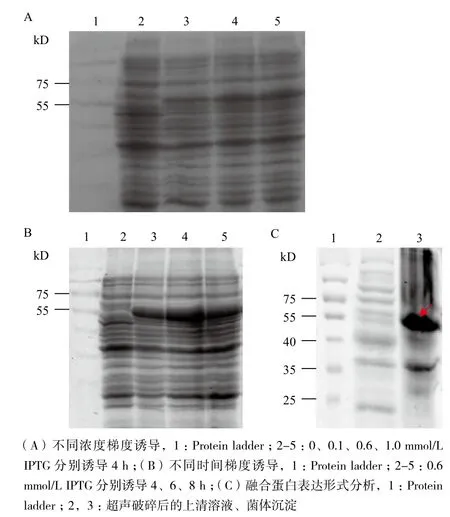
圖2 融合蛋白的誘導(dǎo)表達(dá)
2.3 包涵體蛋白的純化與Western blot鑒定
經(jīng)4、6、8和10 mol/L尿素溶解包涵體1 h后,上清溶液中均未出現(xiàn)蛋白條帶,增加溶解時(shí)間至2 h后,包涵體蛋白開(kāi)始溶解,8 mol/L和10 mol/L尿素溶解量相對(duì)較多且相近(圖3-A),選擇8 mol/L尿素進(jìn)行溶解。將溶解時(shí)間增至5 h發(fā)現(xiàn),近50%包涵體蛋白已經(jīng)溶解于上清溶液中,且用250 mmol/L imidazole溶液純化效率高,洗脫流出液中已經(jīng)沒(méi)有雜蛋白,全部為目的包涵體蛋白(圖3-B)。Western blot對(duì)復(fù)性的包涵體目的蛋白檢測(cè)顯示(圖3-C),57 kD的條帶與預(yù)期蛋白分子量大小相符。
3 討論
DCF1又稱作跨膜蛋白59(TMEM59,Transmembrane protein 59),是一種與樹(shù)突細(xì)胞的分化和遷移有關(guān)的信號(hào)分子[6,7]。DCF1編碼的蛋白分子量大小為42 kD,該蛋白能夠在大腸桿菌和神經(jīng)干細(xì)胞中成功表達(dá)[8]。目前對(duì)于DCF1詳細(xì)的功能還不是很清楚,但是據(jù)先前的研究表明,它可能與神經(jīng)系統(tǒng)中,β淀粉樣前體蛋白APP的糖基化和神經(jīng)干細(xì)胞的分化調(diào)控有關(guān)[8,9]。此外,本實(shí)驗(yàn)室先前研究結(jié)果顯示,過(guò)表達(dá)DCF1后,U251惡性膠質(zhì)瘤細(xì)胞線粒體發(fā)生腫脹,嵴結(jié)構(gòu)破壞并大部分消失,線粒體膜電位下降,細(xì)胞ATP含量減少。線粒體相關(guān)抗凋亡蛋白Bcl-2表達(dá)下調(diào),促凋亡蛋白Bax表達(dá)上調(diào),凋亡執(zhí)行蛋白半胱天冬酶 Caspase-3 被活化[2]。
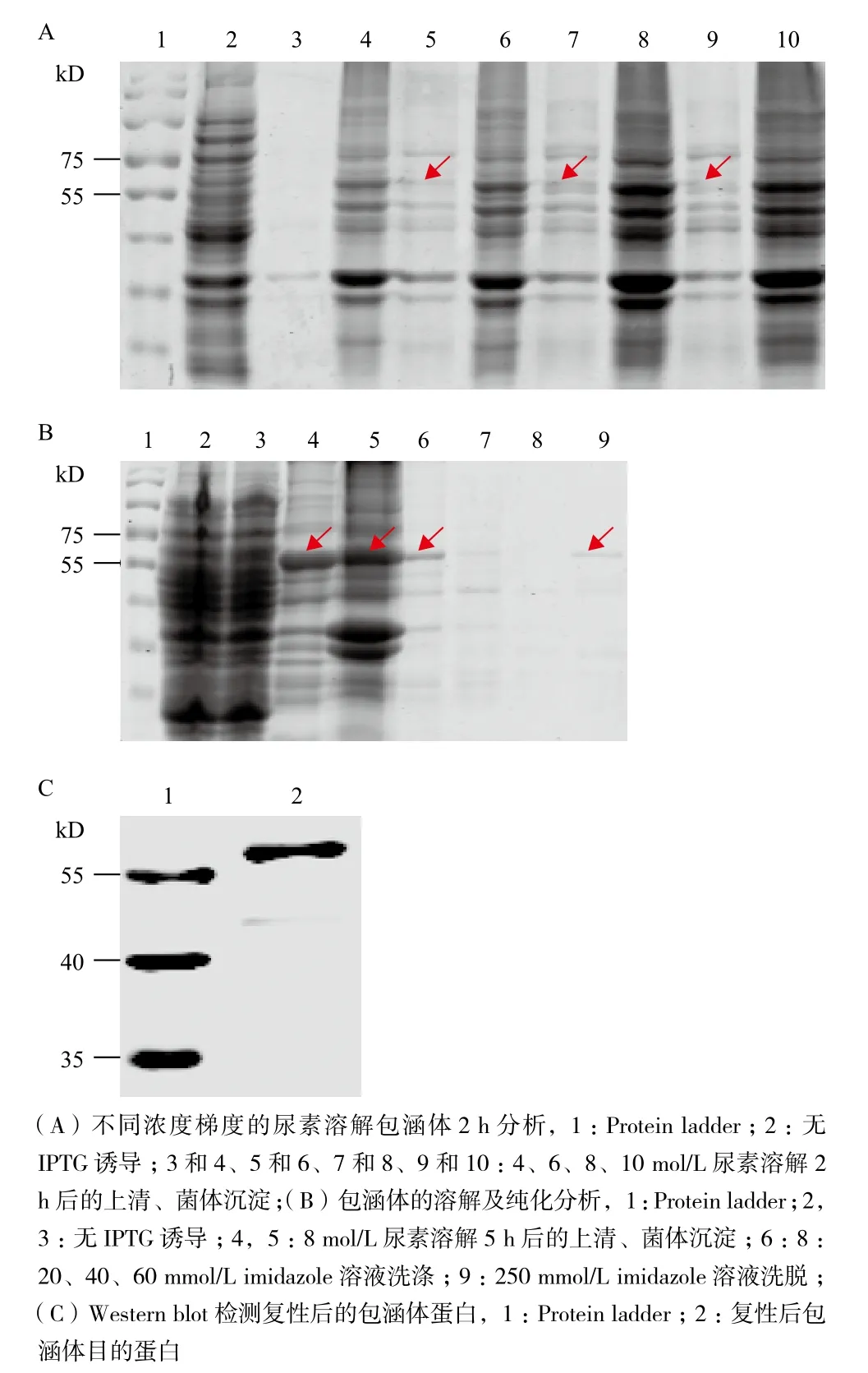
圖3 純化包涵體目的蛋白
為了進(jìn)一步研究該蛋白對(duì)腫瘤細(xì)胞的功能,獲得高純度的目的蛋白十分重要。將克隆得到的DCF1-TAT片段連接入pET32a融合表達(dá)載體,成功構(gòu)建載體pET32a-DCF1-TAT。為了獲得大量的目的蛋白,對(duì)誘導(dǎo)劑IPTG的濃度和誘導(dǎo)時(shí)間兩個(gè)表達(dá)條件進(jìn)行優(yōu)化。與對(duì)照組相比,經(jīng)過(guò)IPTG誘導(dǎo)的融合
蛋白DCF1-TAT為特異性表達(dá),并且蛋白表達(dá)量隨IPTG濃度的增加而增加,其中IPTG濃度在0.1-0.6 mmol/L范圍內(nèi)增加顯著,在0.6-1.0 mmol/L范圍內(nèi)增加緩慢。而蛋白表達(dá)量卻不與誘導(dǎo)時(shí)間呈現(xiàn)正相關(guān)關(guān)系,在誘導(dǎo)6 h的時(shí)候出現(xiàn)最大值。所以確定的最優(yōu)表達(dá)條件是0.6 mmol/L IPTG,誘導(dǎo)培養(yǎng)6 h。
在最優(yōu)表達(dá)條件下培養(yǎng)轉(zhuǎn)化菌可以提高融合蛋白的表達(dá)量,但是重組外源基因在大腸桿菌中高水平表達(dá)時(shí),往往又會(huì)形成細(xì)胞內(nèi)不溶性表達(dá)的無(wú)活性的包涵體固體顆粒。Georgiou等[10-12]發(fā)現(xiàn)天然的蛋白質(zhì)在大腸桿菌中大量表達(dá)時(shí),如內(nèi)酰氨酶和堿性磷酸酶的過(guò)量表達(dá),都形成了包涵體,前者的包涵體在外周質(zhì),后者的包涵體存在于細(xì)胞質(zhì)中。本試驗(yàn)中融合蛋白幾乎不溶于上清溶液,主要以包涵體蛋白形式存在。選用強(qiáng)變性劑尿素溶解包涵體,通過(guò)設(shè)置尿素濃度梯度和溶解時(shí)間,發(fā)現(xiàn)包涵體蛋白隨溶解時(shí)間的增加而逐漸溶解于上清溶液中,并且在8 mol/L尿素溶液中溶解量較多。但是由于尿素在堿性環(huán)境中長(zhǎng)期保存后,容易分解成異氰酸鹽導(dǎo)致多肽鏈自由基甲基化,溶解時(shí)間不宜過(guò)長(zhǎng),所以確定的最優(yōu)溶解時(shí)間為5 h,尿素溶解濃度為8 mol/L。
pET32a載體帶有6個(gè)His標(biāo)簽,是最常用的純化蛋白的融合標(biāo)簽,具有相對(duì)分子質(zhì)量小、不影響目的蛋白的功能,免疫原性相對(duì)較低、純化操作簡(jiǎn)單、成本較低等優(yōu)點(diǎn)[13,14]。溶解后的包涵體蛋白中還含有大部分的雜蛋白,為了減少雜蛋白對(duì)后續(xù)蛋白復(fù)性過(guò)程中的影響,優(yōu)先進(jìn)行蛋白純化。試驗(yàn)發(fā)現(xiàn),250 mmol/L imidazole溶液能夠洗脫下高純度的目的蛋白,但是大部分目的蛋白在低濃度imidazole溶液洗滌時(shí)便會(huì)隨雜蛋白流出,可能是變性后多肽伸展完全致使親和效率降低,所以我們多次回收流出液并重復(fù)純化,得到大量的純度較高的目的蛋白。
本試驗(yàn)成功克隆、誘導(dǎo)表達(dá)并純化包涵體蛋白,摸索出一套改進(jìn)的構(gòu)建DCF1蛋白的原核表達(dá)體系,獲取大量的包涵體目的蛋白。該蛋白可以用于下一階段的細(xì)胞穿透試驗(yàn),為進(jìn)一步研究DCF1蛋白的功能提供了前提條件,也為治療腫瘤提供新的思路。
4 結(jié)論
成功構(gòu)建原核表達(dá)載體pET32a-DCF1-TAT。優(yōu)化并得到融合蛋白DCF1-TAT的最佳誘導(dǎo)表達(dá)條件:0.6 mmol/L IPTG誘導(dǎo)6 h。該融合蛋白以包涵體形式存在,經(jīng)過(guò)8 mol/L尿素溶液溶解、250 mmol/L imidazole溶液洗脫純化,SDS-PAGE和Western bolt檢測(cè)結(jié)果顯示,獲取了純度較高的包涵體目的蛋白。
[1]Wen T, Gu P, Chen F. Discovery of two novel functional genes from differentiation of neural stem cells in the striatum of the fetal rat[J]. Neuroscience Letters, 2002, 329(1):101-105.
[2]Xie Y, Li Q, Yang Q, et al. Overexpression of DCF1 inhibits glioma through destruction of mitochondria and activation of apoptosis pathway[J]. Scientific Reports, 2014, 4:3702.
[3]Van Meir EG, Hadjipanayis CG, Norden AD, et al. Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J]. CA:a Cancer Journal for Clinicians, 2010, 60(3):166-193.
[4]Gou X, Wang Q, Yang Q, et al. TAT-NEP1-40 as a novel therapeutic candidate for axonal regeneration and functional recovery after stroke[J]. Journal of Drug Targeting, 2011, 19(2):86-95.
[5]Deng B, Gou X, Chen H, et al. Targeted delivery of Neurogenin-2 protein in the treatment for cerebral ischemia-reperfusion injury[J]. Biomaterials, 2013, 34(34):8786-8797.
[6]Wen T, Gu P, Chen F. Discovery of two novel functional genes from differentiation of neural stem cells in the striatum of the fetal rat[J]. Neuroscience Letters, 2002, 329(1):101-105.
[7]Dietz AB, Bulur PA, Knutson GJ, et al. Maturation of human monocyte-derived dendritic cells studied by microarray hybridization[J]. Biochemical and Biophysical Research Communications, 2000, 275(3):731-738.
[8]Wang L, Wang J, Wu Y, et al. A novel function of dcf1 during the differentiation of neural stem cells in vitro[J]. Cellular and Molecular Neurobiology, 2008, 28(6):887-894.
[9]Ullrich S, Münch A, Neumann S, et al. The novel membrane protein TMEM59 modulates complex glycosylation, cell surface expression, and secretion of the amyloid precursor protein[J]. Journal of Biological Chemistry, 2010, 285(27):20664-20674.
[10]Bowden GA, Paredes AM, Georgiou G. Structure and morphology
of protein inclusion bodies in Escherichia coli[J]. Nature Biotechnology, 1991, 9(8):725-730.
[11]Valax P, Georgiou G. Molecular characterization of β-Lactamase inclusion bodies produced in Escherichia coli. 1. composition[J]. Biotechnology Progress, 1993, 9(5):539-547.
[12]Georgiou G, Telford JN, Shuler ML, et al. Localization of inclusion bodies in Escherichia coli overproducing beta-lactamase or alkaline phosphatase[J]. Applied and Environmental Microbiology, 1986, 52(5):1157-1161.
[13]Graslund S, Nordlund P, Weigelt J, et al. Protein production and purification[J]. Nature Methods, 2008, 5(2):135-146.
[14]Uchinomiya S, Nonaka H, Wakayama S, et al. In-cell covalent labeling of reactive His-tag fused proteins[J]. Chemical Communications, 2013, 49:5022-5024.
(責(zé)任編輯 李楠)
《農(nóng)業(yè)展望》征訂啟事
《農(nóng)業(yè)展望》是經(jīng)國(guó)家新聞出版總署批準(zhǔn),由中華人民共和國(guó)農(nóng)業(yè)部主管、農(nóng)業(yè)部市場(chǎng)與經(jīng)濟(jì)信息司指導(dǎo)、中國(guó)農(nóng)業(yè)科學(xué)院農(nóng)業(yè)信息研究所主辦的綜合性農(nóng)業(yè)科技類刊物。2005年8月創(chuàng)刊,面向國(guó)內(nèi)外公開(kāi)發(fā)行,設(shè)有 “主編速遞”“產(chǎn)品預(yù)測(cè)”“農(nóng)業(yè)經(jīng)濟(jì)展望”“農(nóng)業(yè)生產(chǎn)展望”“農(nóng)業(yè)科技展望”“農(nóng)業(yè)貿(mào)易展望”“農(nóng)業(yè)消費(fèi)展望”和“數(shù)據(jù)信息”八大主要欄目。
本刊著重于對(duì)主要農(nóng)產(chǎn)品生產(chǎn)、供需、價(jià)格、進(jìn)出口的分品種分析與預(yù)測(cè),密切關(guān)注當(dāng)前農(nóng)業(yè)經(jīng)濟(jì)發(fā)展進(jìn)程中一些重大的關(guān)鍵性或熱點(diǎn)、焦點(diǎn)問(wèn)題,重點(diǎn)報(bào)道對(duì)農(nóng)業(yè)經(jīng)濟(jì)形勢(shì)、農(nóng)業(yè)科技與農(nóng)業(yè)、農(nóng)產(chǎn)品貿(mào)易的分析和展望,既強(qiáng)調(diào)對(duì)農(nóng)業(yè)經(jīng)濟(jì)領(lǐng)域的短期分析,也側(cè)重于對(duì)農(nóng)業(yè)政策、產(chǎn)業(yè)發(fā)展、農(nóng)業(yè)貿(mào)易、農(nóng)產(chǎn)品供需和糧食安全等的長(zhǎng)期展望,并且每期都以一定篇幅刊載國(guó)內(nèi)外主要農(nóng)產(chǎn)品數(shù)據(jù)信息。
《農(nóng)業(yè)展望》是政府機(jī)關(guān)、研究機(jī)構(gòu)、農(nóng)業(yè)企業(yè)、金融單位、期貨市場(chǎng)、進(jìn)出口商等開(kāi)展經(jīng)濟(jì)分析、市場(chǎng)預(yù)測(cè)、投資判斷、生產(chǎn)決策的可靠參考資料。
本刊為月刊,每?jī)?cè)定價(jià)15.00元,全年定價(jià)180.00元。中國(guó)標(biāo)準(zhǔn)連續(xù)出版物號(hào):CN11-5343/S;國(guó)際標(biāo)準(zhǔn)刊號(hào):ISSN 1673-3908。廣告許可證:京海工商廣字第0095號(hào)。全國(guó)各地郵局均可訂閱,郵發(fā)代號(hào):80-283。
地 址:北京市海淀區(qū)中關(guān)村南大街12號(hào)《農(nóng)業(yè)展望》編輯部
郵 編:100081
電 話:(010)82109913
E-mail:nyzw@caas.cn
Construction of a Humanized DCF1 Gene Prokaryotic Expression Vector and Protein Purification
Wang Qian Yang Mei Feng Ruili Wang Jiao Wen Tieqiao
(Laboratory of Molecular Neural Biology,School of Life Sciences,Shanghai University,Shanghai 200444)
In order to further study the role of human DCF1 gene, the target fragment DCF1-TAT was amplified from plasmid pcDNA3.1-DCF1-TAT by PCR, and then cloned into a prokaryotic expression vector pET32a to construct the recombinant plasmid pET32a-DCF1-TAT, which was then transformed into Escherichia coli Rosetta(DE3)cells to express the fusion protein and induced to express by isopropyl-β-D-thiogalactoside(IPTG), and meanwhile the expression condition was optimized. The inclusion body was dissolved by urea after the optimization of dissolution condition, purified by Ni ion affinity chromatography, and renatured by dialysis. SDS-polyaerylamide gel electrophoresis(SDSPAGE)and Western blot analysis were used to detect the fusion protein. The results indicated that the recombinant expression vector pET32a-DCF1-TAT was constructed and expressed in Rosetta successfully. The fusion protein existed in the form of inclusion body, and the target protein was obtained with high purity through the dissolution of urea and purification of affinity chromatography. SDS-PAGE and Western blot analysis showed that the molecular weight of fusion protein was in the expected line.
Humanized DCF1 gene PTD TAT
10.13560/j.cnki.biotech.bull.1985.2014.12.033
2014-05-16
國(guó)家自然科學(xué)基金項(xiàng)目(81271253)
王倩,女,研究方向:分子神經(jīng)生物學(xué);E-mail:happywangni@163.com
文鐵橋,男,教授,博士生導(dǎo)師,研究方向:神經(jīng)干細(xì)胞分化調(diào)控機(jī)制及信號(hào)傳導(dǎo)途徑、神經(jīng)退行性疾病等;E-mail:tqwen@staff.shu.edu.cn

