釀酒酵母發酵條件的研究
趙小麗,甄玉國 *,王蘭惠,陳 雪
(1.吉林農業大學 吉農博瑞奶牛飼料研發中心,吉林 長春 130118;2.長春博瑞飼料集團有限公司技術中心,吉林 長春 130114)
釀酒酵母(Saccharomyces cerevisiae)作為人類利用最早的微生物,其營養成分十分豐富,含有菌體蛋白質、多種氨基酸、維生素、脂肪、食物纖維、礦物元素及生理活性物質等[1]。由于其具有安全、生長繁殖快、代謝周期短、生產不受季節和氣候、土壤、自然災害的影響,與傳統的農業生產方式相比,過程易于控制,容易進行大規模培養、菌體蛋白質豐富等優點,一直是基礎和應用研究的主要對象,并被廣泛應用于釀造、食品、醫藥、飼料工業等領域[2-4]。實驗室酵母培養條件包括培養時間、初始pH、接種量、溫度、轉速、裝液量等[5-8]。溫度是影響酵母生長的重要因子,大多數酵母菌在28~30 ℃時生物量最大。酵母生長與溶氧速率密切相關,因此調節轉速與裝液量是調控酵母生長的有效手段。不同的酵母菌株其生物學特性也不完全相同[9],因此本試驗針對試驗用菌株利用實驗室優化的培養基,通過單因素和正交試驗設計,篩選釀酒酵母培養條件的優化組合,為工業化生產酵母蛋白提供參考。
1 材料與方法
1.1 材料與試劑
1.1.1 原料
供試菌株由實驗室前期試驗獲得,經分子生物學鑒定為釀酒酵母(Saccharomyces cerevisiae)。
甜菜糖蜜:黑龍江拜泉糖廠;尿素、甘氨酸、硫酸鎂:北京化工廠;紅糖(食品級):市售。葡萄糖、瓊脂、酵母浸粉(N>9%)、蛋白胨(N>14.5%):北京奧博星生物技術有限責任公司。
1.1.2 培養基
酵母斜面培養基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,瓊脂15 g/L,115 ℃、0.1 MPa條件下滅菌20 min。
酵母液體種子培養基—酵母浸出粉蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培養基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,115 ℃、0.1 MPa條件下滅菌20 min。
搖瓶發酵培養基為試驗前期篩選優化的培養基:糖蜜總糖含量為10%、紅糖10%、尿素0.5%、酵母粉0.5%、硫酸鎂0.05%、甘氨酸0.05%,115 ℃、0.1 MPa條件下滅菌20 min。由于尿素在高溫高壓條件下分解,因此將尿素配成一定濃度的水溶液,經0.22 μm濾膜過濾除菌后加入滅菌的培養基中。
1.2 儀器與設備
pHS-2C型數字式酸度計:上海SANXIN公司;AL104電子天平:梅特勒-托利多公司;島津UV-1201分光光度計:日本島津公司;Eppendorf 5810R高速冷凍離心機:德國艾本德股份公司;YP1200型電子天平:上海精科實業有限公司;HYG-型培養搖床:上海欣蕊自動化設備有限公司;SPX-150 型生化培養箱:上海躍進醫療器械有限公司;SW-CJ-IF型潔凈工作臺:蘇凈集團蘇州安泰空氣技術有限公司。
1.3 試驗方法
1.3.1 菌株活化
無菌條件下接1環保藏菌種至YPD斜面培養基,30 ℃培養48 h復蘇菌種。
1.3.2 種子擴大培養
取1環活化后的斜面菌種轉接到裝液量為20 mL/100 mL的種子培養基中30 ℃、180 r/min 條件下培養24 h,發酵液經20倍稀釋后OD560nm達到0.72。
1.3.3 菌體干質量測定
發酵液在5 000 r/min條件下離心10 min,蒸餾水洗滌2次后收集菌體,105℃烘干至質量恒定,稱質量并記錄數據。
1.3.4 培養基優化單因素試驗
培養基初始pH5.0、培養基裝液量20 mL/100 mL,30 ℃、4%接種量、150 r/min搖床培養24 h,菌體干質量為16.63 g/L。分別改變培養時間、接種量、初始pH、培養溫度、轉速5個因素,菌液經適當稀釋后,以同樣稀釋倍數的培養基為空白對照,用紫外可見分光光度計在波長560 nm處測定光密度值,即OD值。以菌液光密度值為考查指標,研究各因素對菌株生物量的影響。
1.3.5 培養基配方優化正交試驗
根據單因素試驗結果,選取對菌體生物量影響較大的因素設計正交試驗,以波長560 nm處的OD值為考查指標,研究發酵條件的最佳組合。
1.3.6 數據處理
試驗數據采用SPSS17.0軟件,Duncan’s 檢驗進行方差分析。
2 結果與分析
2.1 單因素試驗
2.1.1 培養時間的選擇
在培養基初始pH5.0,培養基裝液量20 mL/100 mL,溫度30 ℃,4%接種量,轉速150 r/min搖床培養的條件下培養菌體,分別在24 h、36 h、48 h、60 h、72 h取樣,發酵液經適當稀釋后測定OD560nm。培養時間對菌體OD560nm的影響見圖1。
由圖1可知,隨著培養時間的延長,菌體密度呈現逐漸增大的趨勢,經單因素方差分析,培養48 h與60 h的菌密度差異不顯著(P>0.05);因此從時間效率考慮培養時間為48 h。

圖1 培養時間對菌體OD560nm的影響Fig.1 Effect of culture time on cell OD560nm
2.1.2 培養溫度的選擇
在培養基初始pH5.0,培養基裝液量20 mL/100 mL,時間48 h,6%接種量,轉速150 r/min搖床培養的條件下培養菌體,將培養溫度設置為26 ℃、28 ℃、30 ℃、32 ℃、34 ℃分別進行培養,培養結束后發酵液經適當稀釋后測定OD560nm。培養溫度對菌體OD560nm的影響見圖2。
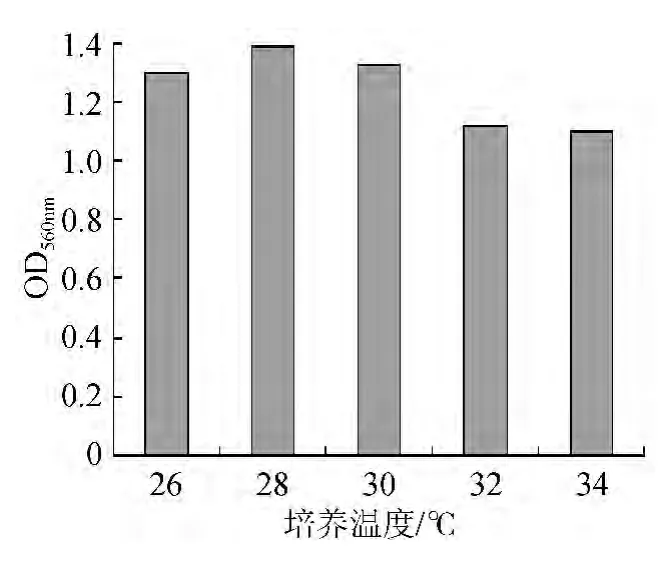
圖2 培養溫度對菌體OD560nm的影響Fig.2 Effect of culture temperature on OD560nm
在發酵過程中,溫度的變化將導致微生物生長和繁殖速度的改變以及微生物酶活性的變化,進而影響產品質量和產量。外部環境溫度的升高和微生物自身代謝放出的熱量,會導致發酵溫度升高,影響菌體的繁殖代謝[10]。由圖2可知,低溫培養較高溫培養時菌密度偏高,可能是因為培養溫度偏低,使得菌體細胞內酶的催化活性較低,延緩了菌體組成物質的合成速度,抑制細胞生長的代謝產物的積累速度放緩,從而有利于細胞的增殖;培養溫度偏高,培養初期細胞生長繁殖很快,但由于供氧速度的限制和不利于生長的代謝產物的積累,影響了最終的細胞數量。經單因素方差分析28 ℃條件下菌密度顯著高于30 ℃和26 ℃條件下的菌密度(P<0.05),因此選擇28 ℃作為適宜的培養溫度。
2.1.3 接種量的選擇
在培養基初始pH 5.0,培養基裝液量20 mL/100 mL,溫度28 ℃,培養時間48 h,轉速150 r/min搖床培養的條件下培養菌體,將接種量分別設定為2%、4%、6%、8%,培養結束后發酵液經適當稀釋后測定OD560nm。不同接種量對菌體OD560nm的影響見圖3。
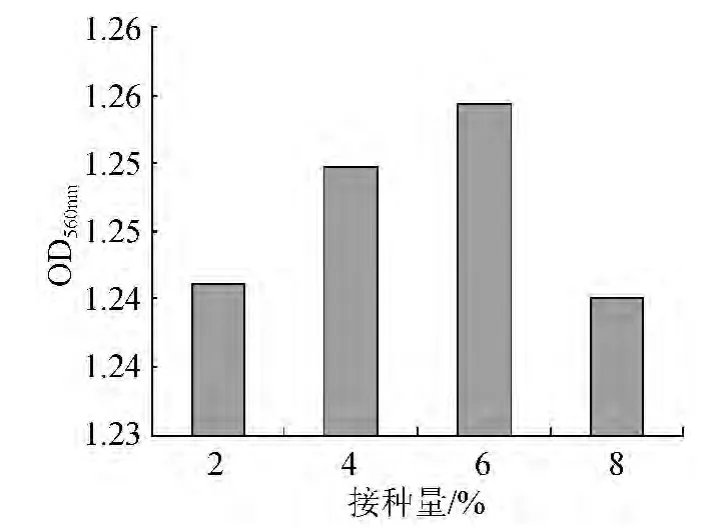
圖3 接種量對菌體OD560nm的影響Fig.3 Effect on inoculums on cell OD560nm
由圖3可知,菌密度在接種量為2%~6%范圍內隨著接種量的增加而增大,因為培養基所提供的營養水平和溶氧速率只能滿足一定數量酵母細胞生長繁殖所需。當接種量超過6%后,一方面造成一部分細胞的營養供給不足,從而限制這一部分菌體的生長繁殖,另一方面由于接種量過大,即使培養基中營養物質的供給能夠滿足其生長,但由于溶氧速率的延后性,不能滿足生長旺盛細胞對氧的需求,從而使細胞從有氧代謝轉變為厭氧代謝,伴隨厭氧代謝物(如乙醇)的積累抑制了細胞的生產,反而降低了最終的細胞濃度。過高的接種量對增加酵母數沒有積極的影響,因此選擇6%作為適宜的接種量。
2.1.4 初始pH值的選擇
在培養基裝液量20 mL/100 mL,溫度28 ℃,培養時間48 h,6%接種量,轉速150 r/min搖床培養的條件下培養菌體,將初始pH值設定為4.0、4.5、5.0、5.5、6.0分別進行培養,培養結束后發酵液經適當稀釋后測定OD560nm。不同初始pH值對菌體OD560nm的影響見圖4。
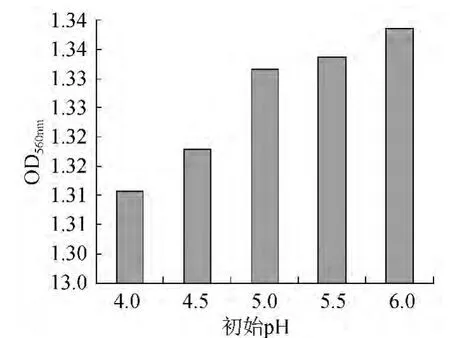
圖4 初始pH對菌體OD560nm的影響Fig.4 Effect of initial pH on OD560nm
由圖4可知,初始pH值為6.0時菌體密度最高,經方差分析,初始pH6.0與pH5.0、pH5.5條件下的菌體密度差異不顯著(P>0.05),但顯著高于pH4.5條件下(P<0.05)。原因可能是多數微生物生長適應的pH跨度為3~4個單位,但其最佳生長pH跨度為0.5~1個單位[11]。酵母菌的生長偏向于在酸性環境中,因此選擇pH 5.0作為適宜的初始pH。
2.1.5 轉速的選擇
在培養基初始pH5.0,培養基裝液量20 mL/100 mL,溫度28 ℃,培養時間48 h,6%接種量的條件下培養菌體,將搖床轉速設定為120 r/min、150 r/min、180 r/min、210 r/min分別進行培養,培養結束后發酵液經適當稀釋后測定OD560nm。不同轉速對菌體OD560nm的影響見圖5。
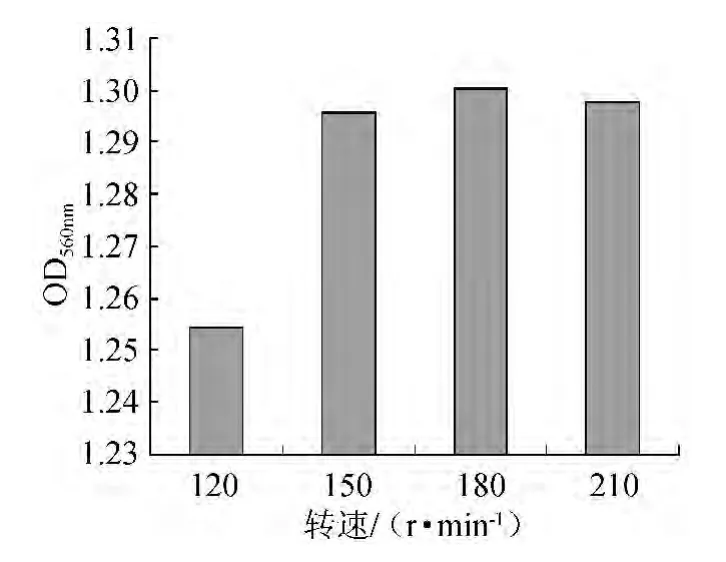
圖5 轉速對菌體OD560nm的影響Fig.5 Effect of rotate speed on cell OD560nm
由圖5可知,菌密度隨著振蕩速度增加而提高,通常在空氣流量一定的情況下,振蕩速度的變化直接影響氧在發酵液中的傳質效率,溶氧是高密度發酵過程中影響菌體生長的重要因素,溶解氧濃度過高或過低都會影響微生物的代謝[12-13],進而影響正常的細胞生長和代謝產物的形成[14]。培養液中的溶氧隨著振蕩速度的增加而增加,有利于菌體生長,但并不是轉速越大越好,過高的轉速對菌體的剪切力增大,反而不利于菌體的增殖。經單因素方差分析,轉速150 r/min與180 r/min條件下的菌體密度差異不顯著(P>0.05),但顯著高于120 r/min條件下(P<0.05),因此選擇150 r/min作為適宜的轉速。
2.2 酵母發酵條件優化正交試驗
根據單因素試驗結果,選取培養溫度、發酵液pH值、培養時間、接種量4個因素設計正交試驗,采用L9(34)的正交設計表,試驗因素與水平見表1,試驗結果與分析見表2,方差分析見表3。
由表2極差分析結果可知,RC>RB>RD>RA,即溫度對菌體生物量的影響最為顯著,然后依次為初始pH、接種量、培養時間。發酵條件的最佳組合為A1B3C1D1,即發酵時間36 h、初始pH5.5、溫度26 ℃、接種量4%。以此培養條件進行驗證試驗,3次重復驗證試驗結果表明該組合確為該株菌的最適培養條件,在此優化條件下培養菌體,其OD560nm為1.370,菌體密度為1.54×108個/mL,干質量可以達到18.48 g/L,比初始條件下菌體干質量提高了約10%。
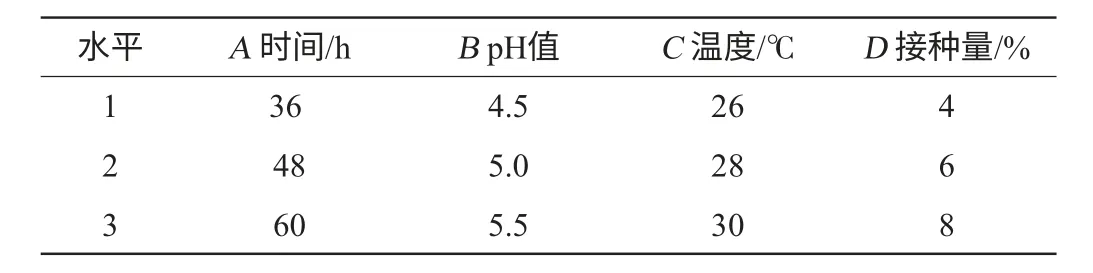
表1 酵母發酵條件優化正交試驗因素與水平Table 1 Factors and levels of orthogonal test for fermentation condition optimization
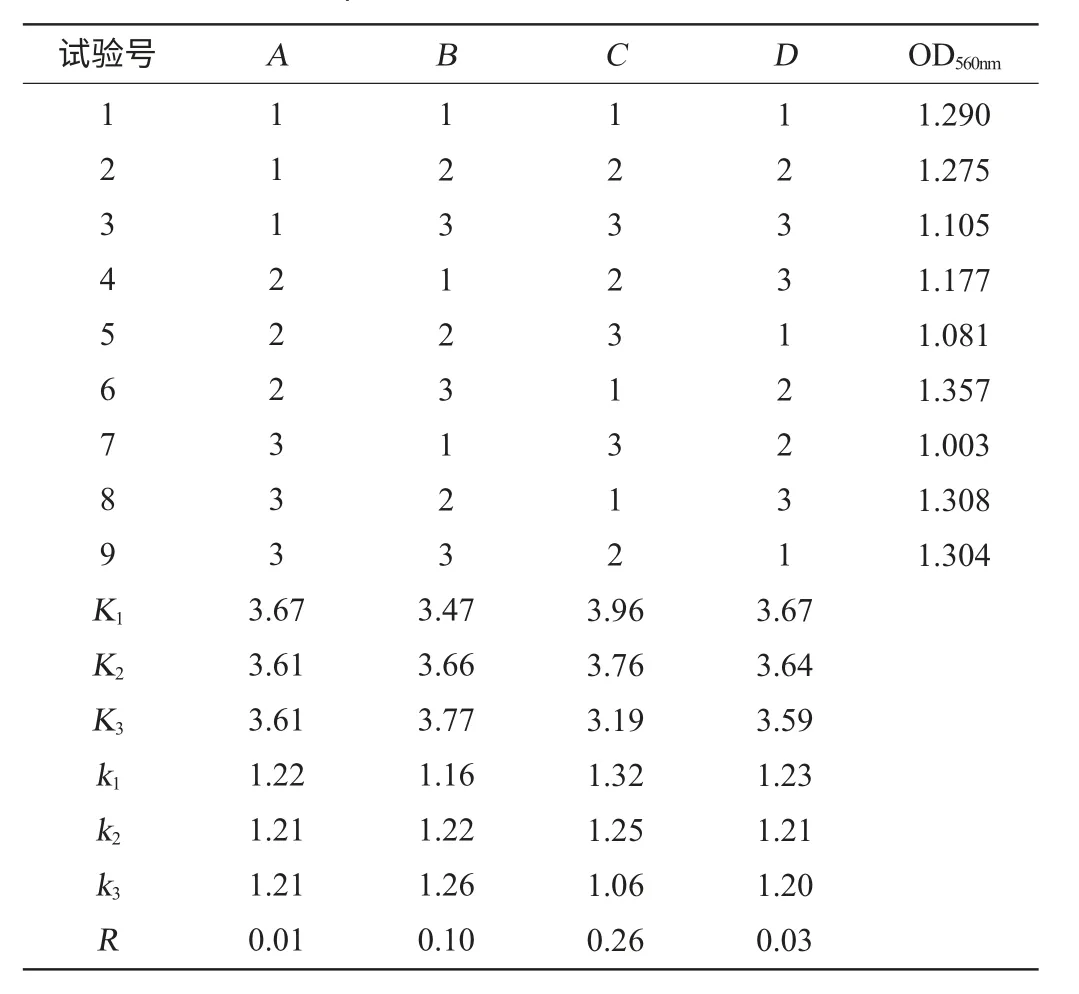
表2 酵母發酵條件優化正交試驗結果與分析Table 2 Results and analysis of orthogonal test for fermentation condition optimization
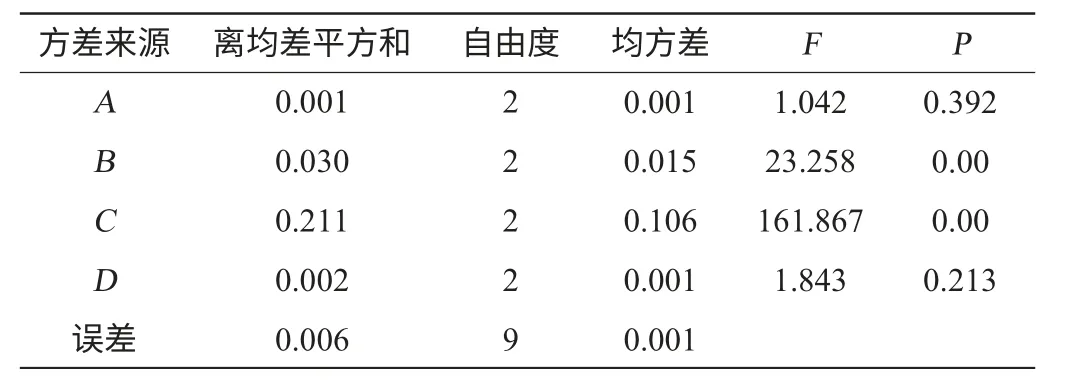
表3 正交試驗結果方差分析Table 3 Variance analysis of orthogonal test result
對試驗數據進行方差分析,由表3方差分析結果可知,在試驗設定的范圍內培養時間和接種量對菌體生物量的影響差異不顯著(P>0.05),而初始pH和培養溫度對菌體生物量有顯著影響(P<0.05)。
3 結論
采用前期篩選的發酵培養基來培養釀酒酵母,通過單因素試驗和正交試驗設計考查不同培養條件對菌體生物量的影響,得到的最佳發酵條件為發酵時間36 h、初始pH值為5.5、溫度26 ℃、接種量4%、轉速150 r/min、裝液量20mL/100mL,在此優化條件下培養菌體,其OD560nm為1.370,密度為1.54×108個/mL,干質量可以達到18.48 g/L,比初始條件下菌體干質量提高了將近10%。
[1]王定昌,賴榮婷.酵母的用途[J].糧油食品,2002,10(1):12-16.
[2]周淑芹.酵母培養物對肉仔雞的作用[D].哈爾濱:東北農業大學碩士論文,2003.
[3]劉建靜,楊曙明,宋海彬.單細胞蛋白飼料的開發與利用[J].黑龍江畜牧醫,2008(4):21-22.
[4]周向榮,夏延斌,周躍斌,等.S.cerevisiae在食品工業發酵中的研究進展[J].中國釀造,2008,27(2):1-4.
[5]李大鵬.利用廢糖蜜生產單細胞蛋白飼料的研究[J].糧食與飼料工業,2003(11):23-24.
[6]何海燕,覃擁靈.利用甘蔗糖蜜生產飼料酵母發酵條件的研究[J].中國飼料,2007(7):38-41.
[7]胡 敏,朱明軍,劉功良,等.甘蔗糖蜜廢水生產飼料蛋白質的研究[J].中國飼料,2006(17):36-39.
[8]郭 壯,白 梅,張和平,等.利用甜菜糖蜜生產單細胞蛋白的研究[J].糧食與飼料工業,2008(9):36-38,45.
[9]于景芝.酵母生產與應用手冊[M].北京:中國輕工業出版社,2005.
[10]王 敏,朱會霞,孫金旭,等.高溫酵母的分離及其特性研究[J].中國釀造,2006,25(11):38-41.
[11]肖冬光.微生物工程原理[M].北京:中國輕工業出版社,2006.
[12]林 劍,鄭舒文,徐世艾.攪拌與溶氧對黃原膠發酵的影響[J].中國食品添加劑,2003(2):20-23.
[13]何向飛,張 梁,石貴陽.利用溶氧控制策略進行高密度和高強度乙醇發酵的初步研究[J].食品與發酵工業,2008,34(1):20-23.
[14]章克昌,吳佩琮.酒精工業手冊[M].北京:中國輕工業出版社,1995.
[15]LU Y,KNOL J C,LINSKENS M H,et al.Cultivation of immobilizedDictyostelium discoideumfor the production of soluble human Fas ligand[J].Appl Microbiol Biot,2004,65(5):547-552.

