中草藥紅茶菌的制備及其體內抗口蹄疫病毒活性
符乃方,吳俊才,符啟俊,呂 律,何繼軍,李開綿,葉劍秋,蔣盛軍* ,蔣小強,邱紅輝,高李澤,何萍,謝崢嶸,陳吉雄
(1.中國熱帶農業科學院,熱帶作物品種資源研究所,海南儋州 571737;2.中國農業科學院蘭州獸醫研究所農業部畜禽病毒學重點開放實驗室家畜疫病病原生物學國家重點實驗室國家口蹄疫參考實驗室,甘肅蘭州 730046;3.海南東方市畜牧局動物疾病預防控制中心,海南東方 570100)
口蹄疫是由口蹄疫病毒(foot-and-mouth disease virus)引起的偶蹄類動物疾病。口蹄疫是影響畜牧業發展的最重要的動物傳染病,在世界動物衛生組織列為A類傳染病中的頭號傳染病,在我國,該病也列為一類動物疫病。口蹄疫的爆發會給當地畜牧業造成嚴重的損失。2001年英國爆發口蹄疫疫情,撲殺700萬頭牲畜,造成85億英鎊的損失,同時,該疫情還波及法國、荷蘭、愛爾蘭等國,這些國家共撲殺多達36萬頭牲畜[1]。在發展中國家,注射口蹄疫疫苗是預防口蹄疫最有效的措施之一。但由于口蹄疫病毒是RNA病毒,病毒的基因和病毒的抗原特性改變很快,因此,這顯著增加了研制高效的口蹄疫疫苗的難度。雖然發達國家采用動物撲殺可以有效預防口蹄疫,但一旦爆發口蹄疫,大量沒有免疫的動物面臨更大的感染風險[2]。因此,口蹄疫的防控依然是畜牧業中動物疫控研究最重要的研究課題之一。采用有效的衛生措施也是預防口蹄疫的技術措施之一。
口蹄疫病毒是一種對酸高度敏感的病毒。這是因為口蹄疫病毒在酸性條件下脫下蛋白衣殼進行繁殖;如果它還沒有侵染進入動物細胞,提前脫下蛋白衣殼將會影響病毒的繁殖而導致病毒的死亡[3-4]。中草藥紅茶菌是一種利用紅茶菌發酵茶葉、羅漢果、甘草、野菊花等中草藥提取液的新型紅茶菌菌液。由于它保留了紅茶菌的產酸特性,因此中草藥紅茶菌制劑可以體外有效殺滅口蹄疫病毒。茶葉、羅漢果、甘草、野菊花是一些具有藥食兩用的中草藥植物,這些植物的提取液普遍具有提高動物免疫力、拮抗病原細菌、病毒等方面的作用。為了進一步挖掘中草藥紅茶菌抑制口蹄疫病毒潛力,筆者在此介紹了這種中草藥紅茶菌的制備、中草藥紅茶菌體內抗口蹄疫病毒活性的試驗結果。
1 材料與方法
1.1 試驗材料
1.1.1 中草藥紅茶菌的制備。所用紅茶菌菌種購自北京食品研究所。紅茶菌母液的制備參考呂愛軍等提供的方法[5]。制備中藥提取液是將0.2%茶葉、0.5%甘草、0.2%羅漢果和0.2%野菊花放入水溶液中煮沸,過濾后冷卻到約30℃以下時加入20%紅茶菌母液,靜置發酵2周后用于檢測或臨床使用。
1.1.2 口蹄疫病毒。豬O型O/China/99株,系豬源O型口蹄疫乳鼠組織毒。該毒株對乳鼠半數致死量(LD50)為10-8.0,對豬半數感染量(SID50)為10-6.0,攻毒時用0.04 mol/L的磷酸鹽緩沖液(pH=7.6)稀釋成1 000 SID50病毒懸液,即 1∶1 000 倍稀釋。
1.1.3 試驗動物。2月齡左右健康試驗豬,口蹄疫O型液相阻斷ELISA檢測口蹄疫O型抗體效價小于1∶4,非結構蛋白3ABC抗體陰性。試驗用豬購自甘肅省莊浪縣某小型養豬場。
1.1.4 檢測試劑。O型口蹄疫抗體液相阻斷ELISA檢測試劑盒(LPB-ELISA)、口蹄疫病毒非結構蛋白3ABC抗體檢測ELISA試劑盒(FMDV NSP 3ABC-I-ELISA Kit),均由中國農業科學院蘭州獸醫研究所提供。口蹄疫病毒實時定量RT-PCR檢測試劑盒由國家口蹄疫參考實驗室提供。
1.2 試驗方法
1.2.1 試驗動物分組及給藥。隨機選取陰性健康豬20頭,隨機分為4組,分別為H組(高劑量組)、M組(中劑量組)、L組(低劑量組)和C組(健康對照組),每組5頭。試驗組H組、M組、L組及C組給藥時間、劑量、途徑等按照表1操作。

表1 試驗動物分組、給藥量及時間
1.2.2 病毒復制水平檢測。在給藥第3天以及攻毒后第1、第3、第5、第7天采集抗凝血,應用real-time RT-PCR方法測定口蹄疫病毒復制copy數。
1.2.3 口蹄疫病毒抗體水平檢測。給藥第3天及攻毒后第3、第10天,用口蹄疫O型液相阻斷ELISA方法檢測豬體內O型口蹄疫病毒抗體水平。
1.2.4 攻毒試驗。給藥3 d后,進行O型口蹄疫毒株(豬O型O/China/99株鼠毒)攻毒試驗。攻毒濃度為1 000 SID50,劑量為3 ml/頭,耳后肌肉注射。對照組和試驗組均攻毒。攻毒后連續觀察10 d。攻毒期間各組按照不同給藥比例繼續給藥。
1.2.5 體溫測定。給藥和攻毒期間,每天測定、記錄直腸體溫。攻毒后,體溫僅為參考值,不做統計分析。
2 結果與分析
2.1 測試樣品安全性評價 攻毒試驗前,連續給藥3 d,試驗豬均未見明顯的臨床副反應,精神狀態、采食等情況基本正常。表2顯示,第1天有3頭豬體溫高于39.5℃,第2天有1頭豬體溫高于39.5℃,第3天有7頭豬體溫高于39.5℃,可見試驗豬體溫基本在正常范圍。

表2 試驗豬攻毒前給藥期間體溫記錄
2.2 攻毒試驗結果 給藥3 d后,進行O型口蹄疫攻毒試驗,結果對照組全部發病(其中1只第3天發病,后表現為拉稀、體弱,于第6天死亡)。從H組、M組、L組攻毒結果(表3)可以看出,低劑量給藥豬3/5保護,中劑量給藥豬1/5保護,高劑量給藥豬0/5保護;在低劑量給藥條件下,攻毒保護效果優于中劑量和高劑量;攻毒后發病豬臨床癥狀與對照組相似,試驗組與對照組差異不明顯。
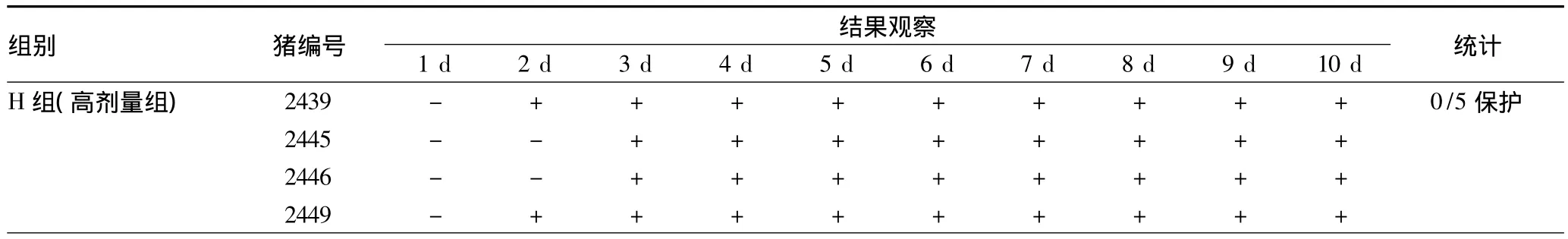
表3 攻毒試驗結果統計

續表3
2.3 病毒復制水平 熒光定量RT-PCR方法檢測給藥第3天采集的全血(本底樣品),未檢測到口蹄疫病毒copy數。試驗對照成立。從攻毒后的第1天到第7天,陸續從試驗豬全血中檢測到口蹄疫病毒,M組復制水平最高,L組復制水平最低(表4)。
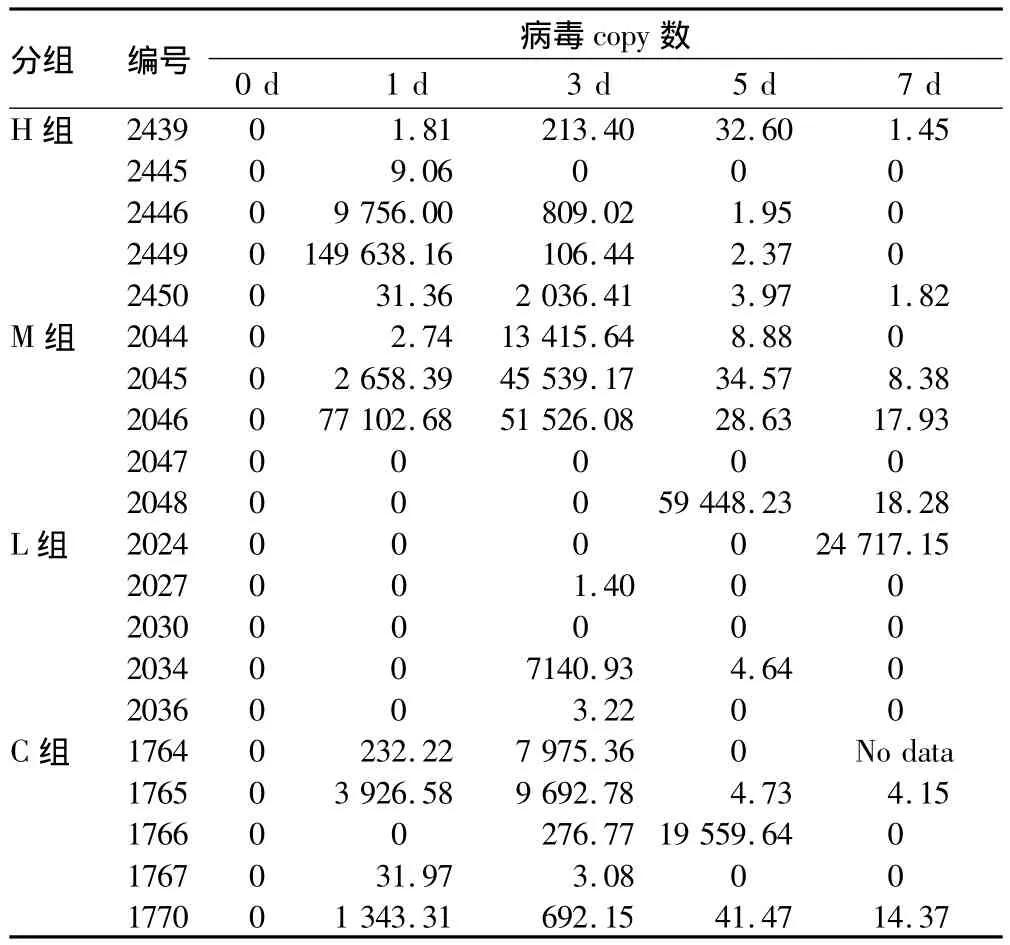
表4 不同試驗組病毒copy數測定結果
2.4 口蹄疫病毒抗體水平檢測 給藥第3天及攻毒后第3、第10天,用口蹄疫O型液相阻斷ELISA方法檢測豬體內O型口蹄疫病毒抗體水平。結果(表5)顯示,第3天僅有H組1頭豬O型抗體≥1∶64,其他試驗豬抗體水平均低于1∶64;第10天時,H組和M組試驗豬口蹄疫抗體水平均≥1∶64;L組和C組各有1頭豬抗體水平均低于1∶64。可見,給藥組與對照組在攻毒后10 d,口蹄疫病毒抗體水平無差別。根據中草藥紅茶菌體內抗口蹄疫病毒試驗結果,可以得出中低濃度的中草藥紅茶菌在體內對口蹄疫病毒具有一定的抑制作用。
3 討論
一種理想的口蹄疫防控試劑應該具有在體外和體內均能殺滅或抑制口蹄疫病毒,且這種殺滅或抑制又是廣譜性的;同時,這種制劑必須無毒副作用,可以經常性來使用;最好,這種制劑必須物美價廉,才能大量推廣使用。如果使用這樣的口蹄疫防控試劑,對動物養殖環境噴霧消毒,可以殺滅動物周圍環境的病毒;如果對動物進行口服和鼻噴,讓這樣的制劑進入動物消化道和呼吸道,殺滅動物呼吸道和消化道內的口蹄疫病毒;口服進入體內后,這種制劑又能殺滅或抑制體內的口蹄疫病毒。因此,使用這樣的制劑就可以構建一個立體的、多層次的口蹄疫防控體系,從而起到有效防控口蹄疫的發生。即使局部發生,這種制劑也可以達到快速使用來預防口蹄疫的目標。由于滿足理想口蹄疫防控制劑的標準難度大,目前尚無這樣的制劑出現,僅有一些具備某方面的口蹄疫防控制劑,如口蹄疫疫苗、口蹄疫消毒劑、RNA干擾劑等,所以利用上述制劑都難以構建一個完善的口蹄疫防控體系。

表5 不同試驗組口蹄疫病毒O型抗體測定結果
紅茶菌是一個以醋酸菌、酵母菌為主的復合共生菌群。醋酸菌是自然界產酸性最強的產酸菌之一,因此,醋酸菌和酵母菌所形成的復合共生菌群是產生最強的復合產酸菌群之一。相對于其他產酸的益生菌如單一的乳酸菌、酵母菌,紅茶菌通過產生大量有機酸可以有效抑制口蹄疫病毒在體外以及動物消化道或呼吸道的繁殖。在紅茶菌基礎上研制的中草藥紅茶菌,含有大量廣譜性抗病毒的中草藥如甘草、菊花、茶葉等提取液成分,因此,動物口服中草藥紅茶菌后,在體內也可以有效抑制口蹄疫病毒在體內的繁殖。這種機制有可能是如其中的甘草提取液中的甘草多糖可以刺激細胞產生干擾素來提高動物機體的抗病毒特性[6-7]。由于中草藥紅茶菌是利用紅茶菌發酵常見的中草藥提取液而成,生產工藝簡單,本身無毒副作用,因此,可以廣泛用于對口蹄疫的防控。由于中草藥紅茶菌對口蹄疫病毒在體外和體內均有良好的抑制作用,因此,對動物養殖場地噴霧消毒、對偶蹄類動物口服(口噴)和鼻噴就可以形成有效預防口蹄疫的三道防線,從而能夠有效預防口蹄疫。中草藥紅茶菌預防口蹄疫的機理如圖1所示。該研究表明,使用一次中草藥紅茶菌,在1周之內,從豬的糞便中分離出大量醋酸菌,表明紅茶菌中的醋酸菌和酵母復合共生菌群在豬的消化道中能存活長達1周或更長的時間。因此,每周對動物噴霧1次左右,就可以實現對口蹄疫的長效預防。其次,對動物噴霧中草藥紅茶菌,還可以預防其他細菌性和病毒性疾病,因此,噴霧中草藥紅茶菌還可以帶有其他額外的預防效益。當前,我國的口蹄疫無疫區建設正逐漸與國際接軌,逐漸從口蹄疫疫苗注射防控下的無疫區轉向非免疫的無疫區。但我國的動物養殖規模大小不一、氣候和環境多樣性大,口蹄疫疫情復雜,因此,如何實現口蹄疫疫苗注射防控下的無疫區平穩轉變為非免疫的無疫區,困難和挑戰很多。中草藥紅茶制劑作為一種無毒、高效、低成本的非免疫的口蹄疫防控制劑和防控技術將會在我國未來的口蹄疫無疫區建設中發揮重要作用。
圖1 噴霧中草藥紅茶菌預防口蹄疫的作用路線
[1]袁文澤,蘇永生,李春陣,等.1990-2001世界口蹄疫流行情況及其防治對策[J].中國動物檢疫,2002,19(2):43-44.
[2]PATON D J,SUMPTION K J,CHARLESTON B.Options for control of foot-and-mouth disease:Knowledage,capability and polity[J].PHil Trans R Soc B,2009,364:2657-2667.
[3]CURRY S,ABRAMS C C,FRY E,et al.Viral RNA modulates the acid sensitivity of foot-and-mouth disease virus capsids[J].J Virol,1995,69:430-438.
[4]JOHNS H L,BERRYMAN S,MONAGHAN P,et al.A dominant-negative mutant of rab5 inhibits infection of cells by foot-and-mouth disease virus:implications for virus entry[J].J Virol,2009,83:6247-6256.
[5]呂愛軍,尹建美,胡秀彩,等.紅茶菌形態及菌液抑菌作用的研究[J].徐州師范大學學報,2004,22(1):73-75.
[6]王彥芳,秦林,王焱,等.中藥抗病毒研究進展[J].中醫中藥,2008,14(22):3488-3490.
[7]蘇俊喜,周穎,門文軍,等.甘草有效成分應用的研究進展[J].畜牧與飼料科學,2010,31(8):111-113.

