水體凍結過程中鹵乙酸前體物在水-冰體系中的分配研究
薛 爽,陳 靜,鐵 梅,惠秀娟,張麗娜,張 營 (遼寧大學環境學院,遼寧 沈陽 110036)
水體凍結過程中鹵乙酸前體物在水-冰體系中的分配研究
薛 爽,陳 靜,鐵 梅*,惠秀娟,張麗娜,張 營 (遼寧大學環境學院,遼寧 沈陽 110036)
通過室內模擬試驗,研究了水體凍結過程中,水體中溶解性有機物(DOM)和鹵乙酸前體物在水-冰體系中的分配規律.按照DOM在XAD樹脂上的吸附特性將其分為5個部分:疏水性有機酸(HPO-A),疏水性中性有機物(HPO-N),過渡親水性有機酸(TPI-A),過渡親水性中性有機物(TPI-N)和親水性有機物(HPI).結果表明:在水體凍結過程中,5種DOM組分在水相中的DOC濃度均隨冷凍時間的增長而增加,呈現冷凍濃縮效應.與溶解性有機碳(DOC)所表征的整體有機物相比,5種DOM組分中的鹵乙酸(HAAs)前體物更傾向于停留在水相中濃縮.在5種DOM組分中,HPI是主要的HAAs前體物.5種DOM組分在未凍結水中的UV-254與HAAFP均表現出一定相關性,其中HPO-A, TPI-A和HPI的UV-254與HAAFP達到極顯著水平.然而在融冰水中,這5種DOM組分的UV-254與HAAFP的相關性均不顯著.
凍結;溶解性有機物;分級;紫外光譜;鹵乙酸前體物
我國北方地區每年11月份江河水面開始結凍,約在11月下旬水面形成冰蓋,由暢流期轉為冰封期[1].冰封期河流由于受水流量小,冰層覆蓋水體自凈能力下降等影響,出現水質嚴重惡化的情況[2-3].在水體凍結過程中,污染物質不可避免地會進入冰層,從而對水體中污染物質的濃度和總量產生顯著影響.在第二年冰層融化時會釋放污染物質,對水質產生威脅.因此研究水體凍結過程中污染物質在水-冰體系中的分配規律對于準確掌握冰封期和融冰期河流中的污染物質動態,以及實施有效的水質控制具有重要的理論意義和實用價值.目前關于污染物質在水-冰體系中的環境行為雖然相對研究較少,但從不同方面仍有成果報道.Nomura等[4]考察了海冰融化時溶解性無機碳在冰中和冰下海水中的變化情況.黃繼國等[5]研究了長春市南湖冰封期間,冰和水中營養鹽、葉綠素a和藻類的濃度變化.李志軍等[6]研究了硝基苯在水-冰兩相間的遷移情況.然而,目前關于溶解性有機物(DOM)在水-冰體系中的遷移轉化規律卻基本處于空白.DOM是原水中色、嗅、味的主要來源,在很大程度上影響著水質的感官指標[7-8].在消毒過程中,DOM會和氯反應生成三鹵甲烷(THMs)、鹵乙酸(HAAs)、鹵乙腈(HANs)等消毒副產物(DBPs)[9-11].在DBPs的總致癌風險中,HAAs的致癌風險占91.9%以上,構成DBPs的致癌風險首要因素[12].DOM的組成非常復雜,一直以來沒有恰當的方法對DOM進行完全的逐一分析.近年發展起來的 XAD樹脂吸附分級法為研究有機物不同組分的特性提供了一種有效手段[13].本研究以渾河河水為研究對象,考察了水體凍結過程中,DOM組分和HAAs前體物在水-冰體系中的分配規律.
1 材料與方法
1.1 試驗水質分析
于2012年4月27日采集渾河河水,采樣地點設置在東陵大橋.所采集水樣的水質情況見表1.

表1 渾河河水的水質情況Table 1 Water quality data for Hunhe River
1.2 水體凍結試驗
河流的結冰過程是從水體表面開始,而河道兩側和河底的介質為土壤,可假定為絕熱.因此,為了使水體凍結試驗接近河流的實際結冰效果[14],采用冰柜作為冷卻裝置,并用聚苯乙烯泡沫塑料做成保溫裝置,保溫裝置內設6個圓柱形凹槽(高度:100cm,直徑:5cm).將水樣用0.45μm濾膜過濾后,裝入6個圓柱形塑料瓶(高度:100cm,直徑:5cm,底部設有取樣口)中,每瓶裝入水樣1.8L.將塑料瓶放入保溫裝置的圓柱形凹槽中,進行水體凍結試驗.塑料瓶四周和底部的接觸介質為聚苯乙烯泡沫塑料,僅從頂部接受冷氣,從而避免水樣從四周和底部損失熱量,以起到更好的保溫效果.試驗溫度設為-25℃.試驗過程中,定時(取樣時間為36, 48, 60, 72, 84, 96h.在96h時,水樣達到完全凍結狀態)取出1個塑料瓶,將瓶中未凍結的水樣從瓶底部的取樣口倒出,然后使塑料瓶中的冰樣在室溫(約15℃)條件下自然融化,收集融化后的水樣(融冰水樣).測定未凍結水樣和融冰水樣的溶解性有機碳(DOC)濃度,UV-254和鹵乙酸生成勢(HAAFP).
1.3 DOM的分級分離
水樣經過0.45μm濾膜過濾后,依次通過串聯的XAD-8和XAD-4樹脂柱,按其在不同樹脂上的吸附特性將其分為疏水性有機酸(HPO-A),疏水性中性有機物(HPO-N),過渡親水性有機酸(TPI-A),過渡親水性中性有機物(TPI-N)和親水性有機物(HPI)等5種組分[15].
1.4 HAAFP的測定
HAAFP是指在保證加氯量足夠的條件下,與氯反應足夠長的時間后,水樣中所能產生的5種HAAs,包括一氯乙酸(MCAA),二氯乙酸(DCAA),三氯乙酸(TCAA),一溴乙酸(MBAA),二溴乙酸(DBAA))的最大量.具體測定步驟為:將水樣用高純水(Milli-Q water)稀釋至DOC為1.0mg/L,并加磷酸緩沖液調節水樣pH值為7.0±0.1;然后向水樣中加入NaClO進行氯化, NaClO的投加量按公式[Cl2]=(3×[DOC])+(7.5× [NH4+])計算確定[16].加蓋后將水樣放入(20.0± 0.5)℃的生化培養箱中,在避光條件下,放置120h, 120h后用硫代硫酸鈉終止反應,并馬上進行HAAs的測定[17].
1.5 分析方法
DOC采用Shimadou TOC-5000型總有機碳分析儀測定.UV-254采用Cary 50型紫外-可見分光光度計測定.HAAs采用C7-3800型氣象色譜儀測定.
2 結果與分析
2.1 DOM組分在水,冰兩相中的DOC
在水體凍結過程中,未凍結水與融冰水中的DOC濃度隨冷凍時間的變化如圖1所示.未凍結前,HPO-A, HPO-N, TPI-A, TPI-N, HPI水樣的DOC濃度分別為1.11, 1.08, 0.97, 1.17, 1.69mg/L.由圖1(a)可知,在水體凍結過程中,未凍結水中5種DOM組分的DOC濃度都是隨著冷凍時間的增加而增加的,呈現出冷凍濃縮效應.由圖1(b)可知,在水體凍結過程中,融冰水中HPO-A, HPO-N, TPI-A, TPI-N, HPI的DOC濃度分別在0.49~1.07, 0.23~1.01, 0.38~0.95, 0.28~1.05, 0.24~1.63mg/L范圍之內.冷凍時間為36h時,融冰水中HPO-A, HPO-N, TPI-A, TPI-N, HPI的DOC濃度分別為0.76, 0.42, 0.45, 0.43, 0.53mg/L;隨著冷凍時間的延長,冰層厚度增加,當冷凍時間為36~60h時,這5種組分在融冰水中的DOC濃度下降;當冷凍時間為60~96h時,這5種組分在融冰水中的DOC濃度則開始升高.在水體凍結的初始階段(0~36h), HPO-A, HPO-N, TPI-A, TPI-N, HPI在冰相中的DOC濃度較高,但隨著冷凍時間的延長,冰層厚度增加,此時冷能通過冰層更平穩地傳遞[18],從而有利于水分子有規則地結晶,并將這5種DOM組分排斥到水相中,因此融冰水中DOC濃度降低.當繼續延長冷凍時間時,未凍結水中DOC濃度增加.這是由于在凍結過程中,晶核形成速率與溶質濃度成正比,溶液中的潛在晶核隨著溶液濃度的提高而隨之增多[19],液體黏性增大,擴散系數減小,因此增加了二次成核概率,冰晶生長速度增快,致使固-液界面穩定性隨之下降,冰晶的夾帶量增多,因此在這種條件下未凍結水中的5種DOM組分就可能有部分被包裹進冰層中,形成“包夾”,從而導致融冰水中的DOC濃度升高.
由圖1(b)還可以發現,在冷凍時間為84~96h時,HPO-A, HPO-N, TPI-A, TPI-N, HPI 的DOC濃度都有一個快速上升的過程.這5種組分在對應于冷凍時間96h的融冰水中的濃度分別是1.07, 1.01, 0.95, 1.05, 1.63mg/L,都分別接近于這5種組分未凍結前的DOC濃度.這是因為在冷凍時間96h時,這5種組分的水樣達到完全凍結狀態,此時水相中的DOM組分全部轉入冰相中,所以融冰水中DOC濃度接近于未凍結前的濃度.同時,這5種組分在對應于冷凍時間96h的融冰水中的濃度都略低于未凍結前的濃度.Spencer等[20]發現地表水經過冷凍之后DOC濃度下降了約10%,他們認為DOC濃度的降低是由于凍融作用對DOM結構的改變所致.
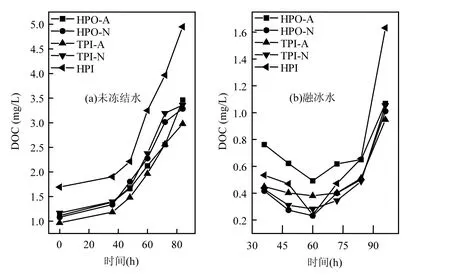
圖1 未凍結水與融冰水中DOM組分的DOC隨冷凍時間的變化Fig.1 DOC for DOM fractions in unfrozen liquid samples and melted ice samples as a function of freezing time
2.2 DOM組分在水,冰兩相中的UV-254
UV-254常用來表征DOM中芳香族C=C的含量,因為含有取代基的苯環和多酚中的π→π*躍遷就發生在該處[21-22].
圖2為DOM組分在未凍結水和融冰水中的UV-254隨冷凍時間的變化情況.由圖2(a)可知,未凍結水中5種DOM組分的UV-254值都隨著冷凍時間的增加而增加.這就說明在水體凍結過程中,這5種DOM組分中的芳香性物質發生冷凍濃縮效應.許多研究者認為,單位濃度DOC在紫外254nm處的吸光度值SUVA可以反映有機物的芳香性[23],SUVA 由(UV-254/DOC)×100計算得出[24].未凍結前,HPO-A的SUVA值最高,為4.76L/(m·mg),其次是TPI-A和HPI,分別是2.37L/(m·mg)和1.61L/(m·mg).而HPO-N與TPI-N的SUVA值較低,分別為0.61L/(m·mg)和0.75L/(m·mg).說明在這5種DOM組分中, HPO-A的芳香性最高,而HPO-N與TPI-N的芳香性較低.由圖2(a)還可以看出,在整個水體凍結過程中,隨著冷凍時間的增加,HPO-A與TPI-A的變化幅度比較明顯,而HPO-N, TPI-N, HPI的變化趨勢比較平緩,這說明在水體凍結過程中,芳香性較強的物質更難于進入冰相,而是停留在水相中濃縮.Fellman等[25]通過對阿拉斯加東南部水體采樣進行冷凍研究發現,冷凍不僅對DOM有濃縮效應,而且芳香性較大的DOM更容易沉淀析出.
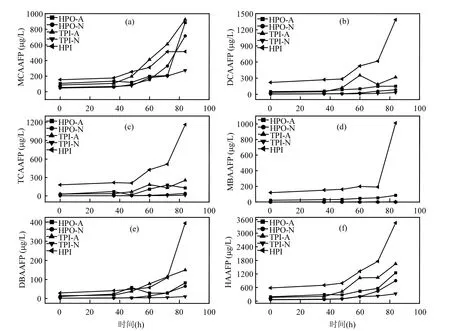
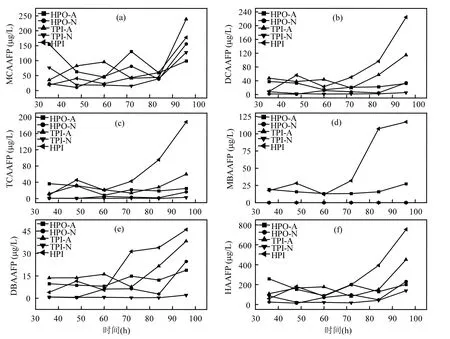
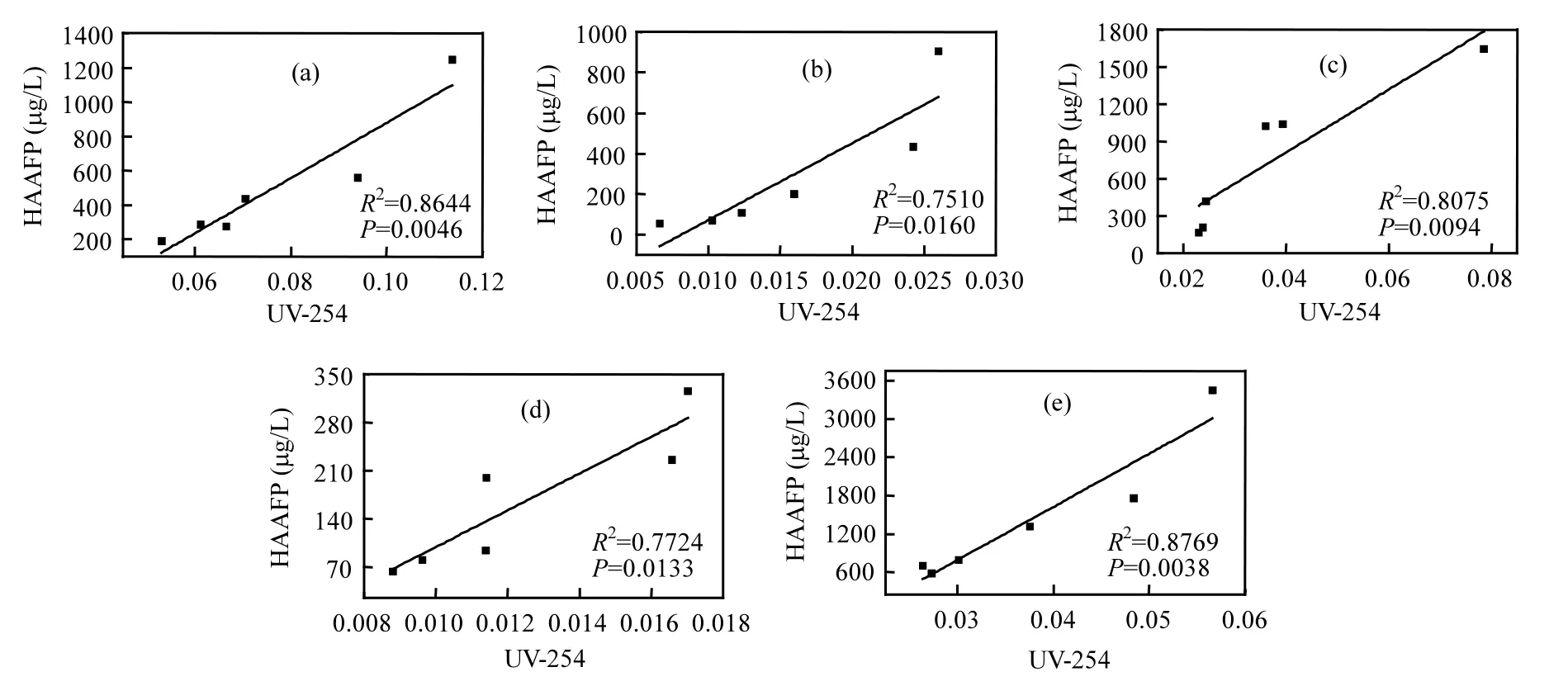
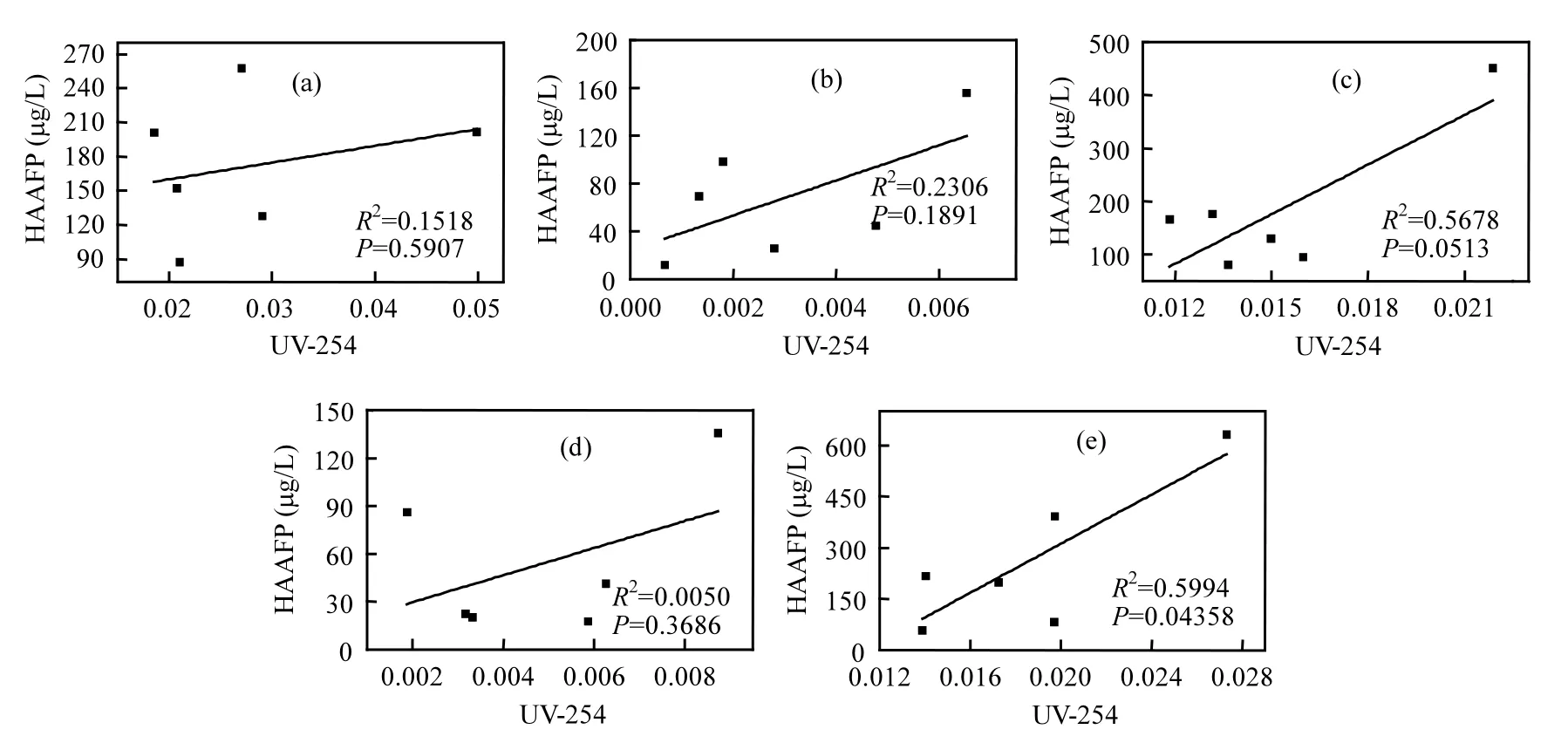
由圖2(b)可以看出,5種DOM組分在融冰水中的UV-254的變化趨勢未表現出一致性.本研究中DOM組分是根據其在XAD-8/XAD-4 樹脂上的選擇吸附性進行富集和分離的.HPO-A是吸附在XAD-8樹脂上的疏水性酸性物質,主要是含有C5~C9的脂肪族羧酸,及1~2個環的芳香酸和酚類;HPO-N是吸附在XAD-8樹脂上的疏水性中性物質,主要是>C9的脂肪酸和胺及>C3的芳香酸和胺;TPI-A是吸附在XAD-4樹脂上的過渡親水性酸性物質,其主要成分為多聚糖;TPI-N是吸附在XAD-4樹脂上的過渡親水性中性物質,幾乎全是蛋白質類物質;HPI是既不吸附在XAD-8樹脂上也不吸附在XAD-4 樹脂上的親水性物質,結構簡單、分子量較小,主要包括 圖2 未凍結水與融冰水中DOM組分的UV-254值隨冷凍時間的變化Fig.2 UV-254 values for DOM fractions in unfrozen liquid samples and melted ice samples as a function of freezing time 2.3 DOM組分在水,冰兩相中的HAAFP 水體中HAAs前體物的含量通常用HAAFP來表征.由圖3可知,未凍結前,HPO-A,TPI-A和HPI的一氯乙酸生成勢(MCAAFP),二氯乙酸生成勢(DCAAFP),三氯乙酸生成勢(TCAAFP),二溴乙酸生成勢(DBAAFP)以及HAAFP均高于HPO-N和TPI-N,這說明在5種DOM組分中,中性組分對HAAs前體物的貢獻較小.一溴乙酸生成勢(MBAAFP)只在HPI和HPO-A水樣中被檢測到.如圖3所示,5種DOM組分在未凍結水中的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP以及HAAFP均隨著冷凍時間的增長而增加. HPO-A, HPO-N, TPI-A, TPI-N, HPI這5種DOM組分未凍結前的HAAFP分別為191.0, 56.2, 164.1, 63.2, 577.4μg/L.冷凍時間為84h時,這5種DOM組分在未凍結水中的HAAFP分別達到1248.5, 903.9, 1643.7, 326.0, 3452.8μg/L,分別是未凍結前HAAFP的6.5, 16.1, 10.0, 5.2和6.0倍.而5種組分的相應DOC濃縮倍數分別為3.1, 3.0, 3.1, 2.9和2.9.這說明與DOC所表征的整體有機物相比,5種組分中的HAAs前體物在水體凍結過程中更傾向于停留在水相中濃縮.在整個水體凍結過程中,HPI的HAAFP在5種組分中最高,說明在DOM組分中,HPI是主要的HAAs前體物. 圖3 未凍結水中DOM組分的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP和HAAFP隨冷凍時間的變化Fig.3 MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP and HAAFP for DOM fractions in unfrozen liquid samples as a function of freezing time 由圖4可知,DOM組分在融冰水中的MCAAFP, MBAAFP, DCAAFP, TCAAFP, DBAAFP以及HAAFP隨冷凍時間的增長呈現出總體上升的趨勢(HPO-N, TPI-A, TPI-N的融冰水中未檢測出MBAAFP).這是由于冷凍濃縮效應[30-31],HAAs在水體凍結過程中,被水分子排斥,不易進入冰相,從而使得水相中HAAs前體物濃度增加,使得潛在晶核增多,增加二次成核的概率,導致冰晶的生長速度加快,生成樹枝狀冰晶,由于水-冰相界面處的濃度很大,部分HAAs前體物來不及“逃逸”,被包含在冰晶中[19,30].直到水體完全凍結(冷凍時間為96h), HAAs前體物全部進入冰相.然而在整個水體凍結過程中,DOM組分在融冰水中的MCAAFP, MBAAFP, DCAAFP, TCAAFP, DBAAFP以及HAAFP隨冷凍時間的變化存在忽高忽低的變化,這可能是由于凍融效應和凍結時間的影響,使得這5種DOM組分在融冰水中的5種HAAs前體物的變化趨勢較復雜,并且缺乏一致性. 圖4 融冰水中DOM組分的MCAAFP, DCAAFP, TCAAFP, MBAAFP, DBAAFP和HAAFP隨冷凍時間的變化Fig.4 MCAAFP, DCAAFP,TCAAFP, MBAAFP, DBAAFP and HAAFP for DOM fractions in melted ice samples as a function of freezing time 2.4 DOM組分的UV-254與HAAFP的相關性分析 由于UV-254與THMFP有較好的相關性,因此UV-254常被作為THMs前體物的替代參數[32].為確定UV-254能否作為水-冰體系中HAAs前體物的替代參數,本研究分別對5種DOM組分的未凍結水樣和融冰水樣進行UV-254與HAAFP的相關性分析(圖5,圖6). 由圖5可知,在未凍結水中,HPO-A, HPON, TPI-A, TPI-N, HPI的UV-254與HAAFP的線性相關系數分別為0.86, 0.75, 0.81, 0.78, 0.88,即5種DOM組分的UV-254與HAAFP均有一定的相關性,且HPO-A, TPI-A和HPI的UV-254與HAAFP達到極顯著的線性相關關系(P<0.01).由此可見,DOM組分中的芳香性有機物是主要的HAAs前體物.這與Chin等[33]的研究一致. 然而在融冰水中,這5種DOM組分的UV-254與HAAFP的相關性均不顯著(圖6).Spencer等[20]的研究表明凍融改變了DOM的結構和光譜學特性.本研究中的融冰水樣均經過了凍結和融化過程,所有融冰水樣的融化條件相同,但是凍結時間不同.由圖2和圖3可以看出,對于5種DOM組分來說,水樣完全凍結后得到的融冰水樣(冷凍時間為96h)中的UV-254和HAAFP均不同于未凍結前的水樣,說明凍融改變了DOM組分的UV-254和HAAFP.并且凍結時間不同,對DOM組分的UV-254和HAAFP的改變程度不同,導致融冰水中5種DOM組分的UV-254與HAAFP的的線性相關不明顯. 圖5 未凍結水中HPO-A, HPO-N, TPI-A, TPI-N和HPI的HAAFP與UV-254的相關性Fig.5 Correlations between HAAFP and UV-254for HPO-A, HPO-N, TPI-A, TPI-N and HPI in unfrozen liquid samples 圖6 融冰水中HPO-A, HPO-N, TPI-A, TPI-N和HPI的HAAFP與UV-254的相關性Fig.6 Correlations between HAAFP and UV-254for HPO-A, HPO-N, TPI-A, TPI-N and HPI in melted ice samples 3.1 在水體凍結過程中,5種DOM組分在水相中的DOC濃度均隨冷凍時間的增長而增加,呈現冷凍濃縮效應.并且,與DOC所表征的整體有機物相比,5種DOM組分中的HAAs前體物更傾向于停留在水相中濃縮.在5種DOM組分中,HPI是主要的HAAs前體物. 3.2 5種DOM組分在未凍結水中的UV-254與 HAAFP均表現出一定的相關性,其中HPO-A, TPI-A和HPI的UV-254與HAAFP達到極顯著的線性相關水平.然而在融冰水中,5種DOM組分的UV-254與HAAFP的相關性均不顯著. [1] 王憲恩,董德明,趙文晉,等.冰封期河流中有機污染物削減模式[J]. 吉林大學學報(理學版), 2003,41(3):392-395. [2] 黃曼君,李明玉,任 剛,等.PFS-PDM復合混凝劑對微污染河水的強化混凝處理 [J]. 中國環境科學, 2011,31(3):384-389. [3] 鄭秋紅,伍永秋,張永光.冰封期河流中污染物損耗估算模型 [J].北京師范大學學報(自然科學版), 2006,42(6):615-617. [4] Nomura D, Takatsuka T, Ishikawa M, et al. Transport of chemical components in sea ice and under-ice water during melting in the seasonally ice-covered Saroma-ko Lagoon, Hokkaido, Japan [J]. Estuarine, Coastal and Shelf Science, 2009,81(2):201-209. [5] 黃繼國,傅鑫廷,王雪松,等.湖水冰封期營養鹽及浮游植物的分布特征 [J]. 環境科學學報, 2009,29(8):1678-1683. [6] 李志軍,王 昕,李青山,等.不同條件下硝基苯在水-冰體系中的分配研究 [J]. 中國科學(E輯:技術科學), 2008,38(7):1131-1138. [7] 郭 瑾,馬 軍.天然有機物提取及表征技術近期發展動態 [J].現代化工, 2007,27(2):12-16. [8] 付 軍,滕曼,肖 華.不同管材對氯胺消毒副產物生成與水質生物穩定性的影響 [J]. 中國環境科學, 2010,30(9):1189-1194. [9] Marhaba T F, Mangmeechai A, Chaiwatpongsakorn C, et al. Trihalomethanes formation potential of shrimp farm effluents [J]. Journal of Hazardous Materials, 2006,136(2):151-163. [10] 李偉光,安 東,崔福義,等.生物降解與吸附作用協同去除鹵乙酸生成勢 [J]. 中國環境科學, 2005,25(1):61-64. [11] 孟麗蘋,董兆敏,胡建英.全國自來水廠鹵乙酸濃度調查,風險評估與標準建議 [J]. 中國環境科學, 2012,32(4):721-726. [12] Uyak V, Ozdemir K, Toroz I. Multiple linear regression modeling of disinfection by-products formation in Istanbul drinking water reservoirs [J]. Science of the Total Environment, 2007,378(3):269-280. [13] Leenheer J A, Croué J P. Peer reviewed: characterizing aquatic dissolved organic matter [J]. Environmental Science and Technology, 2003,37(1):18A-26A. [14] 姜慧琴.烏梁素海營養鹽在冰體中的空間分布及其在凍融過程中釋放規律的試驗研究 [D]. 呼和浩特:內蒙古農業大學, 2011. [15] Aiken G, McKnight D, Thorn K., et al. Isolation of hydrophilic organic acids from water using nonionic macroporous resins [J]. Organic Geochemistry, 1992,18(4):567-573. [16] Kwon B, Lee S, Cho J, et al. Biodegradability, DBP formation, and membrane fouling potential of natural organic matter: Characterization and controllability [J]. Environ. Sci. Technol., 2005,39(3):732-739. [17] USEPA. Method 552.3Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction derivatization, and gas chromatography with electron capture detection [S]. 2003. [18] 余海靜.自然冷凍法在污水處理中的應用研究 [J]. 水處理技術, 2012,38(3):107-110. [19] Mizuike A. Enrichment techniques for inorganic trace analysis [M]. United States: Springer-Verlag Berlin and Heidelberg, New York, 1983. [20] Spencer R G, Bolton L, Baker A. Freeze/thaw and pH effects on freshwater dissolved organic matter fluorescence and absorbance properties from a number of UK locations [J]. Water Research, 2007,41(13):2941-2950. [21] Fuentes M, González-Gaitano G, García-Mina J M. The usefulness of UV–visible and fluorescence spectroscopies to study the chemical nature of humic substances from soils and composts [J]. Organic Geochemistry, 2006,37(12):1949-1959. [22] 宋亞麗,董秉直,高乃云.不同氧化劑降低膜污染效果的研究 [J].中國環境科學, 2009,29(1):11-16. [23] Edzwald J K, Tobiason J E. Enhanced coagulation: US requirements and a broader view [J]. Water Science and Technology, 1999,40(4):63-70. [24] Reckhow D A, Singer P C, Malcolm R L. Chlorination of humicmaterials: byproduct formation and chemical interpretations [J]. Environmental Science and Technology, 1990,24:1655-1664. [25] Fellman J B, D'Amore D V, Hood E. An evaluation of freezing as a preservation technique for analyzing dissolved organic C, N and P in surface water samples [J]. Science of the Total Environment, 2008,392(2/3):305-312. [26] Barber L B, Leenheer J A, Noyes T I, et al. Nature and transformation of dissolved organic matter in treatment wetlands [J]. Environ. Sci. Technol., 2001,35(24):4805-4816. [27] Chow A T, Guo F, Gao S, et al. Size and XAD fractionations of trihalomethane precursors from soils [J]. Chemosphere, 2006, 62(10):1636-1646. [28] 王立英,吳豐昌,張潤宇.應用XAD系列樹脂分離和富集天然水體中溶解有機質的研究進展 [J]. 地球與環境, 2006,34(1):90-96. [29] Chen J, Gu B, LeBoeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions [J]. Chemosphere, 2002,48(1):59-68. [30] Gao W, Smith D, Sego D. Release of contaminants from melting spray ice of industrial wastewaters [J]. Journal of Cold Regions Engineering, 2004,18(1):35-51. [31] Daigger G T, Bailey E. Improving aerobic digestion by prethickening, staged operation, and aerobic-anoxic operation: Four full-scale demonstrations [J]. Wat. Environ. Res., 2000, 72(3):260-270. [32] Chellam S, Krasner S W. Disinfection byproduct relationships and speciation in chlorinated nanofiltered waters [J]. Environ. Sci. Technol., 2001,35(19):3988-3999. [33] Chin Y P, Aiken G., O'Loughlin E. Molecular weight, polydispersity, and spectroscopic properties of aquatic humic substances [J]. Environ. Sci. Technol., 1994, 28(11):1853-1858. Ratio of haloacetic acids precursor in water-ice system during the freezing processes of water. XUE Shuang, CHEN Jing, TIE Mei*, HUI Xiu-juan, ZHANG Li-na, ZHANG Ying (School of Environmental Science, Liaoning University, Shenyang 110036, China). China Environmental Scenice, 2014,34(11):2773~2780 It was studied the partition of dissolved organic matter (DOM) fractions and haloacetic acids (HAAs) precursors in water-ice system during the freezing processes of water by the indoor simulating tests. DOM was fractionated using XAD resins into five fractions: hydrophobic acid (HPO-A), hydrophobic neutral (HPO-N), transphilic acid (TPI-A), transphilic neutral (TPI-N) and hydrophilic fraction (HPI). The results showed that the freezing rate of water samples containing acid fractions wove higher than samples containing neutral fractions. DOC concentrations for five DOM fractions in liquid phase increased with freezing time, presenting the freeze-concentration effect, during the freezing processes of water. HAAs precursors were more liable to be concentrated in liquid phase, as compared with the bulk DOM represented by dissolved organic carbon (DOC). HPI, among the five DOM fractions, was the main HAAs precursors. There was significant correlation between UV-254 and HAAFP for five DOM fractions in unfrozen liquid samples. Moreover, for HPO-A, TPI-A and HPI achieved very significant linear correlation. However, there was no significant correlation between UV-254 and HAAFP for all five DOM fractions in melted ice samples. freeze;dissolved organic matter;fractionation;ultraviolet spectroscopy;haloacetic acids precursors X703,TU992 A 1000-6923(2014)11-2773-08 薛 爽(1977-),女,副教授,博士,河南洛陽人,主要研究方向為低溫條件下污染物的地球化學行為.發表論文30余篇. 2013-12-31 國家自然科學基金(21107039);遼寧省教育廳項目(L2011002);遼寧省科學技術計劃項目(2011230009) * 責任作者, 教授, ldxslw666@126.com.cn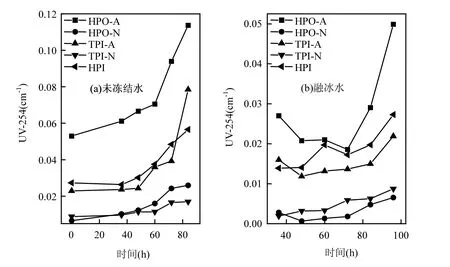
3 結論

