果蠅嗅覺學習記憶遺傳與分子機制研究進展
呂卉卉 屠仁軍
LV Hui-huiTU Ren-jun
(東南大學生命科學研究院,江蘇 南京 210096)
(Institute of Life Sciences,Southeast University,Nanjing,Jiangsu 210096,China)
學習記憶是動物神經系統的高級功能,一直都是神經科學研究的焦點之一。對果蠅嗅覺聯想式學習記憶的深入研究,為了解大腦是如何行使學習記憶功能做出了很大貢獻。一種經典的嗅覺學習記憶方式是將一種氣味和一種懲罰或者獎勵措施偶聯在一起,形成一種氣味偶聯式嗅覺學習記憶,其中氣味分子作為一種條件刺激(conditioned stimulus,CS),懲罰性的(電擊)或獎賞性的(蔗糖獎勵)刺激做為一種非條件刺激(unconditioned stimulus,US)。這需要果蠅的大腦中特定的分子、神經元、神經環路,才能夠將這兩種信息整合在一起。
對果蠅學習記憶研究,一方面不斷獲取新的突變體種類,發現與果蠅學習記憶相關的新的基因及其產物;另一方面,對己經分離出來的突變體果蠅,進一步分析其分子生物學以及細胞生物學等方面的功能。學習記憶突變體果蠅可以分為腦結構突變體和生化突變體。對前者的研究[1]發現了果蠅的蘑菇體結構以及中央復合體結構在果蠅學習記憶中具有重要的中樞作用,對后者的研究[2,3]發現了眾多與果蠅學習記憶相關的分子信號通路和神經元環路。
1 學習記憶模式劃分
結合行為學分析手段、藥物學方法和各種單基因突變體果蠅,人們提出了果蠅在嗅覺聯想式學習記憶過程中的多時程模型:短暫記憶(short-lived memory),即麻醉敏感記憶(anesthesia-sensitive memory,ASM),包 括 短 時 程 記 憶(short-term memory,STM)和 中 時 程 記 憶 (medial-term memory,MTM);長持續時間記憶(long-lasting memory),包括抗麻醉記憶(anesthesia-resistant memory,ARM)和長時程記憶(long-term memory,LTM)[4]。持續時間不同的學習記憶,它們各自所形成的機制也是不相同的。單次訓練后產生的是不穩定的記憶ASM,這種記憶可以被冷麻醉處理所阻斷,同時這些早期的記憶形式根據其分子機制的不同,又可以進一步區分成STM和 MTM。這些記憶將會在數小時內消退,而留下的ARM可以維持到1 d。假如多次間隔訓練,則可以產生一種相對更穩定的晚期記憶——LTM,這種記憶依賴于蛋白質合成,能夠維持超過1個星期。
在過去30年的研究中,有報道[5]揭示了果蠅中的一些介導短時記憶和長時記憶的遺傳分子機制。在分子生物學水平上,通過單個基因突變引起單個記憶階段的缺失,提示人們形成記憶的通路是按照一定的順序產生的。到目前為止,對突變體果蠅的研究表明,當阻斷短時程記憶,往往跟隨著影響了后階段記憶的形成。例如,果蠅rutabaga(adenylyl cyclase),dunce(c AMPphosphodiesterase),以及 NF1基因的突變產生短時程記憶的缺陷,從而隨后造成長時程記憶的缺陷[6,7]。
在神經解剖學水平上,不同時程的記憶在大腦中的存儲區域在空間上是相互獨立的。蘑菇體是昆蟲的高級活動中樞,被稱為昆蟲的智能中心,是記憶形成的中樞。蘑菇體神經元可以分成三類:α/β,α’/β’,γ,每一個蘑菇體神經元細胞,都把它們的軸突延伸至蘑菇體的神經纖維區域,稱之為葉(lobes)。α/β,α’/β’神經元的軸突分成兩個分支,α和α’分支構成蘑菇體的垂直葉(vertical lobes),同時β和β’分支形成蘑菇體的水平葉(horizontal lobes),γ神經元只形成一個水平葉。蘑菇體的γ神經元參與短時記憶,而α/β神經元則參與長時程記憶[6,8]。記憶的形成也會在其他神經解剖學組織中發生和形成,包括觸角葉(antennal lobe,AL)、橢圓體(ellipsoid body,EB)、扇型體(fanshap body,FB)和 DAL神經元等[3,9],這些證據表明不同時相記憶的神經通路是相互獨立的。
Rugose(rg)基因在蘑菇體中調控獎罰性短時程嗅覺記憶的形成[10]。到目前為止,只有rg基因突變的果蠅,表現出短時程記憶的缺陷,而抗麻醉記憶和需要蛋白質合成參與的長時程記憶卻都表現正常[11]。這提示,在分子和神經解剖學水平上,短時程記憶和長時程的記憶鞏固也存在分離。
2 嗅覺學習記憶的形成需要多種分子參與
很多基因對嗅覺學習記憶的生理基礎起著重要作用,這些基因突變后會影響到嗅覺記憶形成,文獻[12]介紹了關于這些基因及其主要的生理學功能。很多參與學習記憶的基因在蘑菇體神經元中高表達,例如dunce(dnc),rutabaga(rut),DCo,PKA-RI,leonardo (leo),Volado (Vol),fasciclin II(fasII)和pumilio (pum)等,其它一些基因(cre,osk,eIF-5C)通過報告基因的表達而推測出在蘑菇體中高表達。
很多影響學習記憶的新基因及其表達產物也被逐漸鑒定出來,盡管更加精確的機制并不清楚。Zeng等[13]發現突觸粘附分子Neurexin參與到了果蠅幼蟲的嗅覺聯想學習記憶,Neurexin突變體果蠅表現出嗅覺學習記憶的缺陷。Neurexin是一類神經粘附分子,它們在突觸的發生、維持以及功能中都扮演重要的角色[14],在果蠅的大腦中廣泛表達,特別集中于蘑菇體。Knapek等[15]報道了一種廣泛表達的突觸前分子Bruchpilot(BRP),對抗麻醉記憶的形成是必須的。利用RNAi的方法降低BRP在蘑菇體中的表達,影響了果蠅的抗麻醉記憶的形成。BRP能夠促進突觸前活性區的組裝,Ca2+離子通道的募集以及突觸囊泡的釋放[16,17]。突觸前的Neurexin,BRP,Syd-1之間能夠形成一類復合體,起到募集組裝突觸的功能[18],這些證據表明這些分子在同一條通路中參與學習記憶的形成。CHICO是脊椎動物胰島素受體在果蠅中的同源蛋白,它在果蠅的大腦中廣泛表達,包括蘑菇體,Naganos等[19]發現果蠅CHICO突變體也表現出嗅覺聯想學習記憶的缺陷,但是其機制并不清楚。隨著更多的學習記憶分子被鑒定出來,相信人們將能夠更深入的了解學習記憶的遺傳分子機制。
3 不同類型神經元在嗅覺學習記憶中的作用
上級神經元通過突觸前釋放的神經遞質作用于突觸后的遞質受體,進而傳遞信號到下級神經元。果蠅大腦中神經遞質有谷氨酸(glutamate)、多巴胺(dopamine,DA)、章胺(octopamin,OA)、γ-氨基丁酸(GABA)、5-羥色胺(5-hydroxy tryptamine,5-HT)等[20],根據神經遞質以及遞質受體的不同,神經元可以分為不同類型。多巴胺能神經元(dopaminergic neurons)能夠傳遞懲罰性刺激信號,而章胺能神經元(octopaminergic neurons)傳遞獎賞性刺激信號到蘑菇體。來自GABA能神經元的抑制性輸入作為控制嗅覺信號到蘑菇體的出入口,以此來控制果蠅學習某種氣味的能力。
3.1 多巴胺能神經元
多巴胺是一種兒茶酚胺類神經遞質,涉及到大腦的眾多功能,包括行為、認知、學習和記憶等。在果蠅中,一般認為多巴胺能神經元傳遞懲罰性無條件刺激到蘑菇體[21]。多巴胺神經元的軸突投射到蘑菇體的神經纖維區,和臨近的蘑菇體神經元形成突觸。根據在果蠅腦中的分布,多巴胺能神經元可以分成13類,其中有三類(PAM,PPL1,PPL2ab)投射到蘑菇體的神經纖維區[22]。電刺激果蠅的腹部,可以引起從多巴胺神經元投射到蘑菇體lobes明顯的鈣信號[23]。這些證據表明多巴胺能神經元能夠響應電刺激,因此可以介導非條件刺激到蘑菇體中。15 min之前或者給出懲罰的條件刺激的同時阻斷多巴胺能神經元的突觸傳遞,能夠阻斷刺激1 h之后的果蠅學習表現[24]。這表明條件刺激的同時多巴胺能神經元突觸釋放對記憶的形成是必須的,這與這些神經元在非條件信號呈現中所扮演的角色是一致的。dDA1和DAMB基因編碼蘑菇體神經元中的D1樣DA受體,其中d DA1的突變體(dumb)表現出很少的或者幾乎缺失的嗅覺學習記憶[25]。
但是多巴胺能神經元并不是僅僅或者專一的在懲罰性嗅覺刺激的非條件刺激通路中起到作用。這些神經元的激活對獎賞性記憶形成也是需要的[26]。同時與學習記憶相反,多巴胺能神經元還參與了遺忘的過程[27]。
3.2 章胺能神經元
章胺做為節肢動物中的神經激素、神經調質以及神經遞質,是生命所必須的一種胺類物質。其中被鑒定出的一個章胺受體基因優先在蘑菇體中表達,同時和腺苷環化酶相偶聯,這暗示章胺在調控行為可塑性中的重要作用。酪氨β羥化酶,一種合成章胺所必須的酶,其突變體果蠅獎賞性學習記憶受到損傷,但是懲罰性條件刺激學習記憶正常。訓練前在果蠅的食物中添加章胺能夠挽救這種突變體的獎賞學習的缺陷[24]。阻斷章胺能神經元的突觸傳遞,能夠損傷幼蟲的嗅覺獎賞學習[28]。這些結果暗示,章胺對獎賞的加固是充分且必須的,這可能是通過激活章胺受體在蘑菇體神經元中的表達起作用的。
3.3 GABA能神經元
γ-氨基丁酸是調節神經興奮的主要的抑制性遞質[29]。在果蠅和哺乳動物中,學習和記憶的神經環路都受GABA能神經元的抑制性輸入高度調控。昆蟲的蘑菇體受到GABA能中間神經元的支配,利用Gad-Gal4(限制在GABA神經元中表達)驅動UAS-GFP的表達,顯示GFP全部在蘑菇體Calyx處聚集。由于GFP和突出前的標記分子Synaptobrevin共表達,因此推測這些投射在蘑菇體的Calyx部位形成了功能性的突觸[30]。有人[31]發現蘑菇體的lobes區表達GABA 受體 RDL(resistance to dieldrin),這暗示 GABA能神經元的投射可能在記憶的形成中扮演重要的角色。在蘑菇體中過表達RDL損害了嗅覺記憶的形成。另外,利用RNAi的方法降低RDL在蘑菇體中的表達增強了記憶的獲得,而不是記憶的穩定,因此,蘑菇體中RDL的表達水平影響了記憶的獲取水平。
APL (anterior paired lateral)神經元投射的 GABA能輸入到蘑菇體lobes區。APL的胞體定位于蘑菇體Calyx的側面,靠近側角(lateral horn,LH)[30]。通過特異性 RNAi方法阻斷APL神經元中GABA的生物合成能夠增強嗅覺記憶的獲取。APL神經元的功能成像分析顯示在接受氣味和電刺激時能夠增加細胞內的鈣離子水平和遞質的釋放。這些結果顯示APL神經元通過釋放抑制性神經遞質GABA,抑制嗅覺學習,而GABA則是通過激活蘑菇體突觸后的RDL受體起作用的。這些都表明,GABA能神經元的信息傳遞在學習和記憶中扮演著重要的角色。
4 腺苷酸環化酶
c AMP信號通路是了解最多的第二信使介導的信號途徑,在脊椎動物和無脊椎動物的突觸可塑性以及學習和記憶中都起著重要的作用。在果蠅中,有一系列c AMP信號通路中的效應分子都是學習記憶所必須的。
腺苷酸環化酶(adenylate cyclase,AC)能夠催化 ATP脫去一個焦磷酸生成c AMP,生成的c AMP作為第二信使通過激活PKA(c AMP依賴性蛋白激酶),使靶細胞蛋白磷酸化,從而調節細胞反應。腺苷酸環化酶在蘑菇體神經元中表達,參與嗅覺學習記憶,由rut基因編碼。rut突變體表現出嗅覺學習的缺陷,在成蟲蘑菇體中表達rut能夠恢復學習能力[32]。很長時間以來,人們發現這種形式的細胞信號傳導對條件刺激與非條件刺激信號的整合至關重要。該酶對鈣和鈣調蛋白以及G蛋白的刺激很敏感[33]。因此,由于同時發生的電刺激和氣體分子的刺激,嗅覺學習記憶可以引發兩種通路。刺激非條件刺激通路能夠激活多巴胺或者章胺受體相關聯的G蛋白,刺激條件刺激通路能夠通過電壓門控離子通道增加蘑菇體神經元的鈣離子內流。
通過果蠅大腦神經元功能成像試驗,Tomchik等[34]報道多巴胺、章胺或者乙酰膽堿(Ach)能夠提高蘑菇體中c AMP的濃度。把ACh添加到蘑菇體的Calyx能夠模擬氣味的信號,把多巴胺添加到蘑菇體的lobes能夠模擬電刺激信號,同時能夠增加c AMP的積累。重要的是,同時把乙酰膽堿添加到蘑菇體的Calyx,把多巴胺添加到蘑菇體的lobes能夠產生一個協同的增加c AMP的信號。這種協同作用增加的c AMP的濃度要比它們單獨作用增加的總和還要多得多。這種c AMP信號的協同作用依賴于腺苷酸環化酶,突變體則不能夠顯示這種協同效應。報道[35]也證實腺苷酸環化酶激活c AMP的一個效應分子PKA,做為條件刺激和非條件刺激信號同時發生的檢測器。
5 嗅覺學習記憶神經環路
5.1 嗅覺信號、電刺激傳遞途徑
果蠅的嗅覺器官由天線(antennae)和下顎須(maxillary palps)組成,它們上面存在許多毛狀突起(sensilla),起到感知環境中氣味分子的作用。在果蠅的頭部,大約有1 300個嗅覺受體神經元(olfactory receptor neurons,ORN),它們的樹突深入毛狀突起,其中嗅覺受體(olfactory receptor,OR)則分布在嗅覺受體神經元中[36]。如圖1所示,嗅覺受體能夠識別環境中的氣味分子,從而引發嗅覺受體神經元去極化,進而傳導該信號。嗅覺受體神經元的軸突投射至觸角葉區,它是昆蟲大腦的嗅覺中心。嗅覺神經元和投射神經元(projection neurons,PN)在小球區(glomeruli)形成突觸。小球區是突觸密集、球形的神經纖維結構,起到翻譯來自嗅覺神經元信號的作用。大約180個投射神經元把它們的突觸伸展到蘑菇體的Calyx區域以及側角。蘑菇體神經元也把它們的樹突投射到Calyx區域,和投射神經元的軸突形成突觸。通常,科學家們用全細胞記錄或者鈣離子成像來研究嗅覺信號[37]。目前,人們還不明確果蠅接受電擊信號的神經環路,但確切的是多巴胺能神經元在傳遞懲罰性電擊信號中扮演著重要的角色。
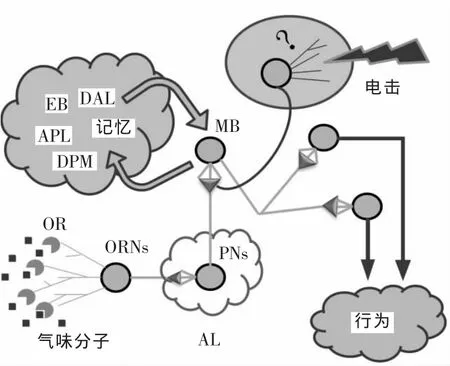
圖1 果蠅嗅覺學習記憶神經環路簡圖Figure 1 Neuronal circuit of Drosophila learning & memory
5.2 DAL神經元
長時程記憶依賴于蛋白質的合成,Chen等[9]利用溫度敏感的毒素介導的核糖體失活抑制蛋白質合成的方法,對果蠅中條件性嗅覺學習記憶后蛋白質合成進行單個神經元的篩選。令人意外的是,在一對 DAL(dorsal-anterior-lateral)神經元中抑制蛋白質的合成破壞了長時程記憶的形成,而不是在通常認為學習記憶的中樞——蘑菇體。利用光轉變熒光蛋白KAEDE報告內源性蛋白質合成技術,在間斷性訓練后,它們可以直接觀察到DAL神經元中c AMP反應元件結合蛋白 CREB依賴的 Ca MKII(calcium/calmodulin-dependent protein kinase II)和period 基因的轉錄激活。阻斷 DAL神經元的輸出后,會破壞記憶的索取,而不是記憶的獲得和鞏固。這些發現提示一個蘑菇體之外的記憶環路:長時程記憶的鞏固(從蘑菇體到DAL神經元),記憶的存儲(DAL神經元),記憶的索取(DAL神經元到蘑菇體)。同時這些發現也表明了蘑菇體之外的CREB介導的基因轉錄表達在學習記憶中的重要作用。
5.3 橢圓體R2/R4m神經元
橢圓體位于蘑菇體的后方,是中央復合體比較靠前的結構,它由四類Large-field ring神經元(R1-R4)構成了典型的圓環形結構。有人[38]報道了橢圓體中的NMDA受體對長時程記憶的鞏固起到重要的作用。Zhang等[3]發現激活橢圓體中的R2/R4m神經元并不影響果蠅的學習指數,而是特異的消除了麻醉敏感記憶。他們又進一步發現,其中約有2/3的R2/R4m是GABA能神經元,起到抑制麻醉敏感記憶的作用。利用 GRASP (GFP reconstitution across synaptic partners)技術,他們又揭示了位于橢圓體神經元突觸區域的橢圓體和蘑菇體之間潛在的突觸聯系,暗示了存在于這兩種重要的大腦結構之間的雙向連接。他們的發現揭示了橢圓體和蘑菇體之間的直接連接,為對嗅覺學習記憶之間的神經環路基礎提供了新的見解。
5.4 調節神經元:APL和DPM
DPM(dorsal paired medial)神經元能夠支配蘑菇體,同時它們主要投射到蘑菇體α’和β’lobes區域,懲罰性和獎賞性的嗅覺記憶的形成均需要DPM神經元的輸出[39]。神經元細胞之間也會形成縫隙連接(gap junction),它們形成的連接能夠使得小分子穿梭于細胞之間,同時使得細胞之間的活性同步化,從而起到調節神經元的代謝和穩態的作用,而且已經發現縫隙連接和記憶的形成有一定的關系[40]。Wu等[41]發現APL和DPM神經元,能夠和 MB之間形成異性的縫隙連接。利用RNA干擾技術,分別降低APL和DPM神經元中in x 7和in x 6基因的表達水平,他們發現果蠅表現出正常的嗅覺學習能力和完整的抗麻醉記憶,但是不能夠形成麻醉敏感記憶。這些結果提示APL、DPM神經元和蘑菇體之間形成的異嗜性縫隙連接是形成記憶的蘑菇體神經環路中至關重要的組成部分,潛在的構成穩固麻醉敏感記憶的新的神經網絡。
6 結語和展望
從信息的加工處理角度來看,記憶需要被接收,編碼,存儲,保留以及索取等一系列過程[42],最后才能形成一個完整的學習記憶回路,其中記憶的鞏固顯得尤為重要。在該過程中,每個涉及到的單個神經元內,都會發生很多的變化,比如配體與受體結合,神經遞質的釋放,蛋白質的磷酸化,新基因的合成等等。此外,也需要不同類型的神經元以及腦區組織之間信息交流、傳遞。目前,對此了解依然很有限,很多的科學問題仍需探索解決。
基于果蠅強大的分子工具以及遺傳學操作,已經了解了很多學習記憶的潛在機制。這幫助人們闡釋了關于學習的條件刺激和非條件刺激的神經通路以及整合的調控分子、實時分子動態。由于果蠅的大腦結構比高等生物簡單得多,人們能夠很容易地鑒定出參與形成學習記憶的神經元、相關的神經元環路,從而解析出學習記憶的遺傳與分子機制。至今,對果蠅學習記憶的研究已經歷了一個從行為學到分子神經生物學的過程。得益于新的生物學手段技術的改進,人們能夠更加微觀地研究、揭示學習記憶的遺傳分子機制。除此之外,為了進一步解析嗅覺信息的傳遞通路,人們目前最關心的是如何將果蠅中得到的研究成果推廣到高等動物的研究中去。學習記憶是一個復雜的生物學過程,在神經科學研究的漫漫長路中我們還有很長的路要走,其明確的機制將會對日后神經系統疾病的治療,尤其是學習記憶相關神經退行性疾病的治療帶來巨大的飛躍。
1 Balling A,Technau G M,Heisenberg M.Are the structural changes in adult Drosophila mushroom bodies memory traces?Studies on biochemical learning mutants[J].J.Neurogenet.,2007,21(4):209~217.
2 Mayford M,Kandel E R.Genetic approaches to memory storage[J].Trends Genet.,1999,15(11):463~470.
3 Zhang Z,Li X,Guo J,et al.Two clusters of GABAergic ellipsoid body neurons modulate olfactory labile memory in Drosophila[J].J.Neurosci.,2013,33(12):5 175~5 181.
4 Margulies C,Tully T,Dubnau J.Deconstructing memory in Drosophila[J].Curr Biol.,2005,15(17):R700~713.
5 McGuire S E,Deshazer M,Davis R L.Thirty years of olfactory learning and memory research in Drosophila melanogaster[J].Prog Neurobiol.,2005,76(5):328~347.
6 Blum A L,Li W,Cressy M,et al.Short-and long-term memory in Drosophila require c AMP signaling in distinct neuron types[J].Curr Biol.,2009,19(16):1 341~1 350.
7 Ho I S,Hannan F,Guo H F,et al.Distinct functional domains of neurofibromatosis type 1 regulate immediate versus long-term memory formation[J].J.Neurosci.,2007,27(25):6 852~6 857.
8 Trannoy S,Redt-Clouet C,Dura J M,et al.Parallel processing of appetitive short-and long-term memories in Drosophila[J].Curr Biol.,2011,21(19):1 647~1 653.
9 Chen C C,Wu J K,Lin H W,et al.Visualizing long-term memory formation in two neurons of the Drosophila brain[J].Science,2012,335(6 069):678~685.
10 Volders K,Scholz S,Slabbaert J R,et al.Drosophila rugose is a functional homolog of mammalian Neurobeachin and affects synaptic architecture,brain morphology,and associative learning[J].J.Neurosci.,2012,32(43):15 193~15 204.
11 Zhao J,Lv Y,Zhao X,et al.Dissociation of rugose-dependent short-term memory component from memory consolidation in drosophila[J].Genes Brain Behav.,2013,12(6):626~632.
12 Dubnau J,Chiang A S,Grady L,et al.The staufen/pumilio pathway is involved in Drosophila long-term memory[J].Curr Biol.,2003,13(4):286~296.
13 Zeng X,Sun M,Liu L,et al.Neurexin-1 is required for synapse formation and larvae associative learning in Drosophila[J].FEBS Lett,2007,581(13):2 509~2 516.
14 Tian Y,Li T,Sun M,et al.Neurexin regulates visual function via mediating retinoid transport to promote rhodopsin maturation[J].Neuron,2013,77(2):311~322.
15 Knapek S,Sigrist S,Tanimoto H.Bruchpilot,a synaptic active zone protein for anesthesia-resistant memory[J].J.Neurosci.,2011,31(9):3 453~3 458.
16 Kittel R J,Wichmann C,Rasse T M,et al.Bruchpilot promotes active zone assembly,Ca2+channel clustering,and vesicle release[J].Science,2006,312(5 776):1 051~1 054.
17 Fouquet W,Owald D,Wichmann C,et al.Maturation of active zone assembly by Drosophila Bruchpilot[J].J.Cell Biol.,2009,186(1):129~145.
18 Owald D,Khorramshahi O,Gupta VK,et al.Cooperation of Syd-1 with Neurexin synchronizes pre-with postsynaptic assembly[J].Nat Neurosci,2012,15(9):1 219~1 226.
19 Naganos S,Horiuchi J,Saitoe M.Mutations in the Drosophila insulin receptor substrate,CHICO,impair olfactory associative learning[J].Neurosci Res,2012,73(1):49~55.
20 Sehgal A,Mignot E.Genetics of sleep and sleep disorders[J].Cell,2011,146(2):194~207.
21 Davis R L.Traces of Drosophila memory[J].Neuron,2011,70(1):8~19.
22 Mao Z,Davis R L.Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil:anatomical and physiological heterogeneity[J].Front Neural Circuits,2009,3:5.doi:10.3389/neuro.04.005.2009.
23 Riemensperger T,Voller T,Stock P,et al.Punishment prediction by dopaminergic neurons in Drosophila[J].Curr Biol.,2005,15(21):1 953~1 960.
24 Schwaerzel M,Monastirioti M,Scholz H,et al.Dopamine and octopamine differentiate between aversive and appetitive olfactory memories in Drosophila[J].J.Neurosci,2003,23(33):10 495~10 502.
25 Kim Y C,Lee H G,Han K A.D1 dopamine receptor dDA1 is required in the mushroom body neurons for aversive and appetitive learning in Drosophila[J].J.Neurosci,2007,27(29):7 640~7 647.
26 Krashes M J,DasGupta S,Vreede A,et al.A neural circuit mechanism integrating motivational state with memory expression in Drosophila[J].Cell,2009,139(2):416~427.
27 Berry J A,Cervantes-Sandoval I,Nicholas E P,et al.Dopamine is required for learning and forgetting in Drosophila[J].Neuron,2012,74(3):530~542.
28 Honjo K,Furukubo-Tokunaga K.Distinctive neuronal networks and biochemical pathways for appetitive and aversive memory in Drosophila larvae[J].J.Neurosci,2009,29(3):852~862.
29 Moult PR.Neuronal glutamate and GABAA receptor function in health and disease[J].Biochem Soc Trans,2009,37(Pt 6):1 317~1 322.
30 Leiss F,Groh C,Butcher N J,et al.Synaptic organization in the adult Drosophila mushroom body calyx[J].J.Comp Neurol,2009,517(6):808~824.
31 Liu X,Krause W C,Davis R L.GABAA receptor RDL inhibits Drosophila olfactory associative learning[J].Neuron,2007,56(6):1 090~1 102.
32 McGuire S E,Mao Z,Davis R L.Spatiotemporal gene expression targeting with the TARGET and gene-switch systems in Drosophila[J].Sci.STKE,2004,2004(220):pl6.
33 Levin L R,Han P L,Hwang P M,et al.The Drosophila learning and memory gene rutabaga encodes a Ca2+/Calmodulin-responsive adenylyl cyclase[J].Cell,1992,68(3):479~489.
34 Tomchik S M,Davis R L.Dynamics of learning-related c AMP signaling and stimulus integration in the Drosophila olfactory pathway[J].Neuron,2009,64(4):510~521.
35 Gervasi N,Tchenio P,Preat T.PKA dynamics in a Drosophila learning center:coincidence detection by rutabaga adenylyl cyclase and spatial regulation by dunce phosphodiesterase[J].Neuron,2010,65(4):516~529.
36 Kaupp U B.Olfactory signalling in vertebrates and insects:differences and commonalities[J].Nat Rev Neurosci,2010,11(3):188~200.
37 Turner G C,Bazhenov M,Laurent G.Olfactory representations by Drosophila mushroom body neurons[J].J.Neurophysiol,2008,99(2):734~746.
38 Wu C L,Xia S,Fu T F,et al.Specific requirement of NMDA receptors for long-term memory consolidation in Drosophila ellipsoid body[J].Nat Neurosci,2007,10(12):1 578~1 586.
39 Keene A C,Krashes M J,Leung B,et al.Drosophila dorsal paired medial neurons provide a general mechanism for memory consolidation[J].Curr Biol.,2006,16(15):1 524~1 530.
40 Kielian T.Glial connexins and gap junctions in CNS inflammation and disease[J].J.Neurochem,2008,106(3):1 000~1 016.
41 Wu C L,Shih M F,Lai J S,et al.Heterotypic gap junctions between two neurons in the drosophila brain are critical for memory[J].Curr Biol.,2011,21(10):848~854.
42 Dubnau J,Chiang A S.Systems memory consolidation in Drosophila[J].Curr Opin Neurobiol,2013,23(1):84~91.

