華南漢族成人煙霧病的危險因素分析
馬國奮,蔣曉江,陳海坤
(1河源市人民醫院,廣東河源517000;2第三軍醫大學第三附屬醫院)
煙霧病(自發性基底動脈環閉塞癥)是一種以雙側頸內動脈末端及其大分支血管進行性狹窄或閉塞,且顱底伴異常新生血管網形成為特征的血管性疾病[1],因腦血管造影時呈現許多密集成堆的小血管影,似吸煙時吐出的煙霧,故名煙霧病[2]。國內學者對煙霧病的病因學、流行病學、臨床特征、診斷、治療等方面的研究已有較多報道。然而,目前關于華南地區煙霧病的臨床特點和危險因素報道較少[3]。2003年1月~2012年6月,我科收治煙霧病患者128例,現分析其危險因素。
1 資料與方法
1.1 臨床資料 選取2003年1月~2012年6月我科收治的煙霧病患者128例,其中男87例、女41例,年齡19~68(44.5±23.8)歲。臨床表現為腦梗死93例,腦出血15例,蛛網膜下腔出血6例,短暫性腦缺血發作(TIA)9例,無癥狀6例。既往史包括鼻咽癌放療后5例,腦外傷3例,結核病7例,腦膜炎4例,高脂血癥25例,糖尿病28例,高血壓病32例。均均符合日本厚生省1998年修訂的成人煙霧病診斷標準:①雙側或單側頸內動脈末端或大腦前、大腦中動脈的起始端狹窄或閉塞;②腦血管造影動脈期可見顱底異常煙霧狀血管網;③無臨床癥狀,或與閉塞的血管供血區域相比,癥狀體征相對較輕;④年齡>18歲,有多種病因,或者病因不明[4]。排除標準:除外顱腦外傷、腦膜炎、腦腫瘤、唐氏綜合征、神經纖維瘤病等[5]。
1.2 危險因素篩選 根據國內外文獻報道,篩選可能與煙霧病發病相關的因素[6],包括高血壓病、糖尿病、高脂血癥、肥胖、嗜煙酒、缺乏運動和長期精神緊張共7個危險因素,統計每項危險因素的患者例數,計算每項危險因素的發生率。
1.3 統計學方法 采用SPSS13.0統計學軟件,危險因素分析采用Logistic二元回歸分析,將煙霧病發病賦值為1,無發病為0;各危險因素如存在則賦值為1,無則為0。采用逐步回歸法處理數據。P<0.05為差異有統計學意義。
2 結果
回歸共分5步進行,每個步驟的檢驗方程均有統計學意義(P均<0.05),說明調查表的條目設置較合理、所收集的患者信息較客觀。逐步回歸發現危險因素包括高血壓病、糖尿病、血脂異常、肥胖、嗜煙酒、缺乏運動和長期精神緊張(P均<0.05)。見表1。
3 討論
煙霧病的病理改變主要為病變血管的血管內膜明顯增厚,內彈力層彎曲,間質萎縮變薄,血管壁上出現附壁血栓及脂質沉積等現象。煙霧病有兩個發病高峰期,一個是10歲以內的幼兒期,主要表現為缺血性腦卒中,另一個是30~40歲,主要表現為腦出血[1]。但美國學者通過對116例煙霧病患者研究發現,美國成年人煙霧病以缺血性卒中多見,隨訪發現每年卒中再發生率為10.3%,預后好于亞洲患者。而亞洲煙霧病患者中,超過66%的患者以腦出血為主要表現,表現為腦內血腫、側腦室出血和蛛網膜下腔出血,以側腦室出血多見;兒童患者中僅約10%表現為腦出血,絕大多數表現為腦缺血,其中40%左右表現為TIA,30%表現為腦梗死,少數表現為頭痛、癲癇等,因此,亞洲與西方人群煙霧病的表現存在差異[7]。
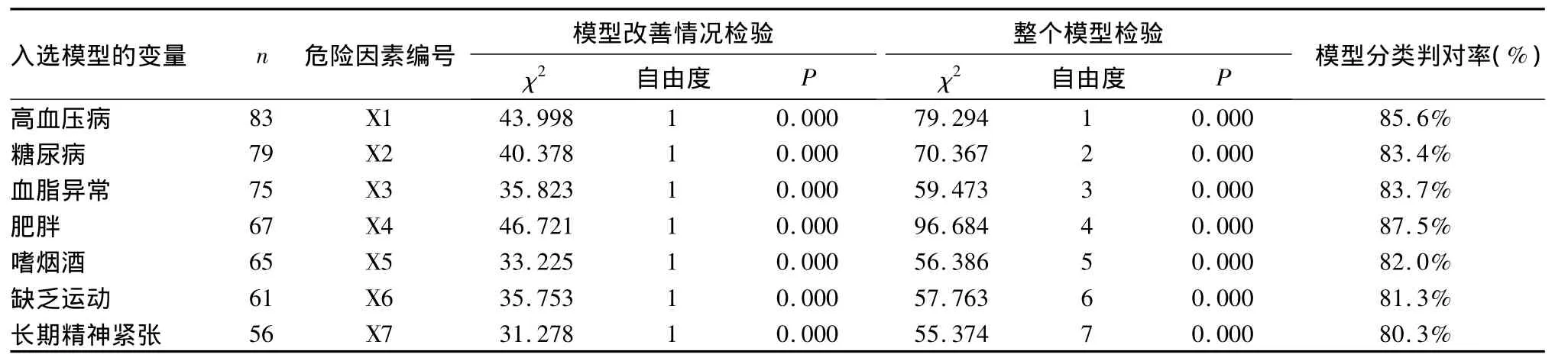
表1 128例煙霧病患者危險因素分析結果
煙霧病的發病原因尚不清楚,遺傳和環境因素可能與該病發病有關。日本有8%~10%的病例呈家族性發病,且家族性患者中女性更多見、發病年齡更小。最近研究顯示,煙霧病患者染色體8q23和12p12位點均存在遺傳連鎖現象[8]。部分細胞因子的變化在煙霧病的病變過程中也起重要作用。研究發現煙霧病患者的腦脊液中堿性成纖維細胞生長因子水平升高,提示該因子在煙霧病病理改變過程中可能發揮作用。肝細胞生長因子(HGF)是一種促血管生成的強烈誘導劑,研究發現煙霧病患者腦脊液及腦組織中HGF mRNA及蛋白表達增高,提示煙霧病發病與HGF有關。煙霧病患者血清中其他細胞因子如轉化生長因子、血小板衍化生長因子及細胞維甲酸結合蛋白-Ⅰ等均表達增高。因此,炎癥后的自身免疫性反應可能導致腦血管的閉塞性病變,也可能是煙霧病的病因之一[9]。
本研究發現,入選的128例華南地區煙霧病患者以腦梗死最為多見,腦出血次之,TIA占第三位,這與 Felbaum 等[1]及 Oh等[2]所報道的日本及韓國煙霧病的特點大體一致。在一定程度上為該病的預防提供了依據。
[1]Felbaum D,Henning E,Payne BR.Moyamoya in a non-Asian patient:a case report and review of the literature[J].W V Med J,2012,108(2):18-19.
[2]Oh CH,Chung J,Hyun D,et al.Cerebrovascular disease and stroke in Korean male adolescent[J].Yonsei Med J,2012,53(3):467-476.
[3]Li H,Zhang ZS,Liu W,et al.Association of a functional polymorphism in the MMP-3 gene with Moyamoya Disease in the Chinese Han population[J].Cerebrovasc Dis,2010,30(6):618-625.
[4]Liu W,Hashikata H,Inoue K,et al.A rare Asian founder polymorphism of Raptor may explain the high prevalence of Moyamoya disease among east Asians and its low prevalence among Caucasians[J].Environ Health Prev Med,2010,15(2):94-104.
[5]Kraemer M,Heienbrok W,Berlit P.Moyamoya disease in Europeans[J].Stroke,2008,39(12):3193-3200.
[6]Uchino K,Johnston SC,Becker KJ,et al.Moyamoya disease in Washington State and California[J].Neurology,2005,65(6):956-958.
[7]Liu W,Hitomi T,Kobayashi H,et al.Distribution of moyamoya disease susceptibility polymorphism p.R4810K in RNF213 in east and southeast Asian populations[J].Neurol Med Chir(Tokyo),2012,52(5):299-303.
[8]Shi KL,Wang JJ,Li JW,et al.Arterial ischemic stroke:experience in Chinese children[J].Pediatr Neurol,2008,38(3):186-190.
[9]Ueno M,Kira R,Matsushima T,et al.Moyamoya disease and transforming growth factor-beta1[J].J Neurosurg,2000,92(5):907-908.

