苦參堿的提取純化工藝研究
郭德祥,郭亞楠,李向陽
(國家獸用藥品工程技術研究中心,河南洛陽471003)
苦參為豆科植物苦參(Sophora flavescens Ait.)的干燥根,具有清熱燥濕、殺蟲利尿的功效[1-2],臨床上常用于治療豬感冒、無名高熱,仔豬白痢,家兔疥癬,雞球蟲病等。現代研究表明,苦參主要的有效成分為苦參堿、氧化苦參堿等生物堿[3],本研究采用最為方便、易于工業化生產的水煎煮法,以浸膏得率、苦參堿提取率為評價指標,通過正交試驗篩選苦參提取的最佳工藝條件,為新藥研究和充分利用苦參藥材資源提供理論依據。
1 儀器與材料
1.1 儀器 依利特高效液相色譜儀(P230型高壓輸液泵;UV230型檢測器;EC2000色譜工作站);ZORBAX NH2色譜柱,4.6 mm ×250 mm,5 μm(Agilent公司,美國);Ab265-s電子分析天平(梅特勒-托利多公司,瑞士)。
1.2 儀器 苦參,購自洛陽康鑫中藥飲片公司,符合《中華人民共和國獸藥典》二○一○年版二部苦參項下的有關規定[4];苦參堿對照品,批號:110805-200507,由中國藥品生物制品檢定所提供;乙腈為色譜純,水為重蒸水,其他試劑均為分析純。
2 方法與結果
2.1 含量測定方法 色譜條件與系統適用性試驗:ZORBAX NH2柱(4.6 mm ×250 mm,5 μm);以乙腈-無水乙醇-3%磷酸溶液(80∶10∶10)為流動相;檢測波長為220 nm。理論板數按苦參堿峰計算應不低于1500。
線性范圍考察:精密稱取苦參堿對照品20.9 mg于100 mL容量瓶中,加乙腈-無水乙醇(80:20)溶解、定容,制成濃度為209 μg/mL的儲備液,將上述儲備液用乙腈-無水乙醇(80∶20)稀釋成濃度分別為 104.5、52.2、26.1、13.1 μg/mL 的對照品溶液,分別精密吸取上述5個不同濃度的對照品溶液10 μL,以峰面積(Y)與對照品濃度(X)進行線性回歸,回歸方程為 Y=4396.7X -0.8696,r=0.9999。表明在 0.13 ~2.09 μg范圍內,線性關系良好。
對照品溶液的制備:精密稱取5 mg苦參堿對照品于100 mL容量瓶中,加乙腈-無水乙醇(80∶20)溶解定容,制成每1 mL含苦參堿0.05 mg的溶液,即得。
供試品溶液的制備:精密稱取10 mg干燥物甲醇超聲溶解,并定容于10 mL容量瓶中,即得。
測定法:分別精密吸取對照品溶液與供試品溶液各10 μL,注入液相色譜儀,測定。
2.2 正交試驗法提取苦參堿
2.2.1 苦參堿提取工藝條件的選擇[5]采用水煎煮法進行提取,以用水量、提取時間和提取次數為3個因素,設計3個水平,進行L9(34)正交試驗,篩選最佳工藝條件。因素水平表見表1。

表1 因素水平表
2.2.2 考察指標的確定和測定 苦參堿為苦參的主要有效成分,將其作為考察指標,同時結合浸膏收率優選最佳工藝。分別稱取苦參藥材9份各100 g,按照L9(34)正交表2設計的條件進行煎煮,合并煎煮液,濾過,濾液濃縮,置已恒重的蒸發皿中,水浴蒸干,70℃減壓干燥至完全干燥后,稱重并計算浸膏收率(浸膏收率%=浸膏重量/樣品重量×100%),結果見表2。
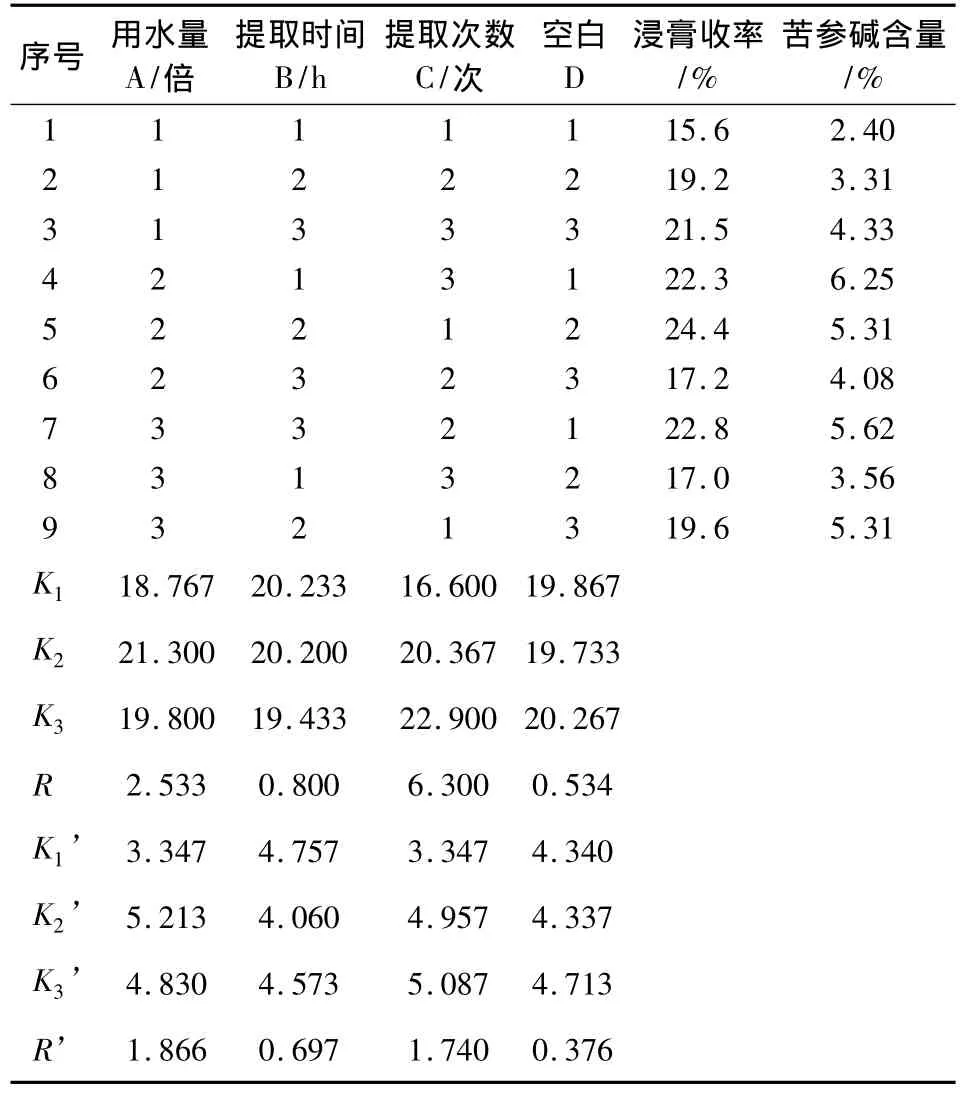
表2 正交試驗結果
由表2直觀分析可知,以浸膏收率為評價指標時,在所考察的影響因素中,重要性依次為C>A>B;以苦參堿含量為評價指標時,在所考察的影響因素中,重要性依次為A>C>B。得到最佳工藝條件A2B1C3。
以浸膏收率為指標方差分析結果表明,以浸膏收率作為評價指標時,C因素具有顯著意義,A因素和B因素均無顯著意義(表3);以苦參堿含量為指標方差分析結果表明,以苦參堿含量作為評價指標時,A因素、B因素和C因素均無顯著意義。綜合考慮環保節能因素,確定最佳提取工藝條件為A2B1C3,即加8倍量水提取3次,每次提取2 h(表4)。
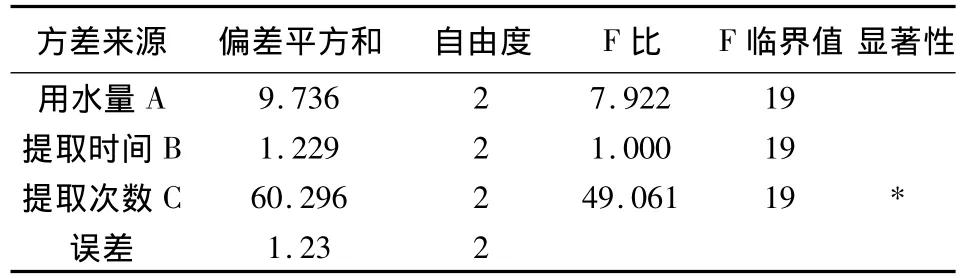
表3 以浸膏收率為指標方差分析結果

表4 以苦參堿含量為指標方差分析結果
2.2.3 驗證試驗 稱取苦參藥材3份,按正交試驗優選的最佳提取工藝進行放大驗證試驗,即加8倍量水提取3次,每次提取2 h。三次驗證試驗干膏收率(%)分別為 22.4、22.0、22.1,苦參總堿含量(%)分別為 6.08、5.94、5.87;干膏收率(%)和苦參總堿含量(%)的平均值分別為 22.2、5.94。驗證試驗結果表明正交設計篩選出的最佳提取工藝條件重現性良好,說明此工藝穩定、可行。
2.3 苦參堿純化工藝的優化 苦參提取之后,除有效成分外,還含有較多的淀粉等雜質,而這些雜質將影響其質量,因此需要對粗提物進行純化。本文采用乙醇沉淀及三氯甲烷萃取相結合的方法對苦參粗提物進行純化。
2.3.1 乙醇沉淀 取苦參提取液濃縮成1.0、1.5、2.0 g生藥/mL,每份取相當于生藥100 g,加乙醇使含醇量達75%,4℃冷藏,上清液回收乙醇,比較不同藥液濃度對收膏率及苦參堿含量的影響,結果見表5。

表5 不同藥液濃度對收膏率及苦參堿含量影響的比較
從表中可以看出,當藥液濃度為1.0 g生藥/mL時,收膏率高,從苦參堿含量比較,當藥液濃度為2.0 g生藥/mL時,苦參堿的含量較高,但是此時收率比較低。綜合考慮收膏率及苦參堿含量,選擇將藥液濃縮至1.0 g生藥/mL進行醇沉。
2.3.2 三氯甲烷萃取 利用生物堿的堿性,將苦參提取液中生物堿加堿堿化,用三氯甲烷萃取,回收三氯甲烷,即可得到純度較高的生物堿。
取經苦參醇沉并回收乙醇后的藥液3份,每份相當于生藥 100 g,加水至1 mL∶1.5 g生藥,用20%氫氧化鈉溶液調pH值至11,用三氯甲烷分別萃取1、2、3次,比較不同萃取次數對收膏率及苦參堿含量的影響,結果見表6。

表6 萃取次數的比較
從表中可以看出,萃取3次,收膏率高,從苦參堿含量比較,藥液萃取2次,苦參堿的含量較高,但此時收率相對較低。綜合考慮收膏率及苦參堿含量,選擇萃取3次。
2.3.3 pH的考察 取經苦參醇沉并回收乙醇后的藥液3份,每份取相當于生藥100 g,加水至1 mL∶1.5 g生藥,分別用20%氫氧化鈉溶液調pH值至9、10、11,用三氯甲烷各萃取3次,比較不同pH值對收膏率及苦參堿含量的影響,結果見表7。

表7 不同pH值的比較
從表中可以看出,調整pH值至9~11,對收膏率及苦參堿含量影響不明顯。因此,萃取時調節藥液的pH值至9~11。
2.3.4 批驗證試驗 稱取苦參粗提物3份各1 kg,按照篩選出的最佳純化工藝進行放大驗證試驗。驗證試驗結果無顯著性差異,說明該工藝穩定、可行。
3 討論與小結
苦參粗提物被20%氫氧化鈉溶液堿化后,生物堿被游離出來,易被三氯甲烷等溶劑萃取,但生物堿還能與苦參粗提物中的淀粉等雜質生成不溶或難溶沉淀,同時非堿溶性物質也析出,形成咖啡色沉淀,包埋并帶走部分生物堿,造成生物堿的損失。所以采用乙醇沉淀及三氯甲烷萃取相結合的方法先除去苦參粗提物中的淀粉等雜質。
苦參藥材用8倍量水提取3次,每次提取2 h,合并藥液并濃縮至1.0 g生藥/mL時進行醇沉,醇沉后調節藥液的pH值為9~11,并用三氯甲烷萃取3次。優選出的提取、純化工藝穩定、可行,可用于苦參堿的工業化提取。
[1]劉 梅,劉雪英,程建峰.苦參堿的藥理研究進展[J].中國中藥雜志,2003,28(9):801-804.
[2]李 燕,何立人.苦參堿類生物堿的心血管系統藥理研究[J].中草藥,2000,31(3):227-229.
[3]馬方勵,程 怡.苦參堿多種制劑的藥效學研究進展[J].中成藥,2004,26(5):420-422.
[4]中國獸藥典委員會.《中華人民共和國獸藥典》二○一○年版二部[S].
[5]鄧麗琴.苦參中苦參堿提取工藝研究[J].時珍國醫國藥,2006,17(2):233-234.

