新型銫選擇性吸附劑的合成及性能
游新鋒,張振濤
中國(guó)原子能科學(xué)研究院放射化學(xué)研究所,北京102413
新型銫選擇性吸附劑的合成及性能
游新鋒,張振濤
中國(guó)原子能科學(xué)研究院放射化學(xué)研究所,北京102413
在金屬鎳粉表面原位合成了與金屬基體緊密結(jié)合的亞鐵氰化鎳鉀(KNiFC/Ni)吸附劑。經(jīng)分析,其表面為面心立方晶系的亞鐵氰化鎳鉀(KNiFC),厚度約為40~80 nm,晶格參數(shù)為0.996 0 nm,化學(xué)組成可表示為K1.4Ni1.3Fe(CN)6。結(jié)果表明:該吸附劑不水解,對(duì)137Cs具有較高的吸附容量,非常快的吸附速率,很高的選擇性,Cs的吸附分配系數(shù)(Kd)可達(dá)105mL/g,即使在1.0 mol/L NaNO3溶液中,Kd值也大于103mL/g;該吸附劑吸附137Cs為典型的離子交換機(jī)制,NH4+由于具有和Cs+相近的離子半徑所以競(jìng)爭(zhēng)最為強(qiáng)烈。本吸附劑有望用于含銫廢液的處理及137Cs的分離或提取。
亞鐵氰化鎳鉀;137Cs;離子交換;選擇性吸附
137Cs裂變產(chǎn)額高,半衰期長(zhǎng)(30.17 a),γ射線能量適中,廣泛存在于各種放射性廢液中,具有中等放射性毒性、易進(jìn)入環(huán)境等特點(diǎn)。因此,必須對(duì)其進(jìn)行妥善的處理。由于離子交換樹脂具有較高的交換容量,目前137Cs廢液主要采用離子交換樹脂處理。但離子交換樹脂耐輻照性差、選擇性差,廢樹脂固化困難等。相對(duì)而言,無機(jī)離子交換劑具有耐輻照、固化包容量高等優(yōu)點(diǎn),所以用無機(jī)吸附劑處理放射性廢液成了近年來研究的熱點(diǎn)。目前銫的無機(jī)離子交換劑可大致分為:過渡金屬亞鐵氰化物、雜多酸鹽、鋯的磷酸鹽、硅鈦化合物、鋁硅酸鹽及其復(fù)合材料等[1-10],其中亞鐵氰化物類吸附劑對(duì)銫的選擇性最好,適用于較高的酸度和鹽度的含銫放射性廢液的處理[2-7]。前人曾對(duì)幾乎所有的過渡金屬亞鐵氰化物進(jìn)行了研究,結(jié)果發(fā)現(xiàn),Cu、Co、Fe、Ni及Zn的亞鐵氰化物對(duì)Cs具有很高的選擇性,并且給出了這些過渡金屬氰化物對(duì)金屬離子的親和順序及親和能力:Cs+>Rb+>NH4+≥K+>Na+>Li+[2-6]。但這些合成吸附劑大多易水解、固相流失嚴(yán)重,應(yīng)用困難。為此研究人員相繼開發(fā)了溶膠-凝膠技術(shù)、多孔支撐體技術(shù)和有機(jī)物粘接技術(shù)等進(jìn)行造粒,并取得了一定的成績(jī)。如美國(guó)專利WO2008002282提供的SiO2-KCoFC吸附劑是將CoCl2溶液浸泡于多孔二氧化硅中,然后再逐漸加入亞鐵氰化鉀在二氧化硅孔道和表面形成KCoFC[7],該技術(shù)是典型的多孔支撐體技術(shù),類似的還可以采用沸石活性炭等支撐體進(jìn)行表面反應(yīng)制備。1993年,美國(guó)橡樹嶺實(shí)驗(yàn)室為處理高放廢液用溶膠-凝膠法[9]開發(fā)了以二氧化鈦水合物為基體的NaCoCF/KCoCF復(fù)合離子交換劑及相應(yīng)的磷酸鹽形式的復(fù)合微球交換劑,該吸附劑可在pH=1~10的范圍內(nèi)使用,但是Cs吸附交換過程非常緩慢。芬蘭開發(fā)了一種Cs-Treat無機(jī)離子交換劑[11],以聚丙烯腈為粘結(jié)劑,活性成分為KCoFeCN,其操作pH=1~13,最高分配系數(shù)可達(dá)106mL/g,典型的分配系數(shù)為104~105mL/g,并用該吸附劑處理核電廢水蒸發(fā)濃縮液,對(duì)137Cs的去污因子約為2 000,處理后的137Cs比活度約為150 Bq/L。雖然上述造粒技術(shù)解決了亞鐵氰化物顆粒太細(xì)的問題,但仍存在水溶液中亞鐵氰化物水解的問題。本工作擬合成一種不易水解、選擇性高的無機(jī)吸附材料,希望為含銫廢液的處理提供一種新的選擇。
1 實(shí)驗(yàn)部分
1.1 儀器和試劑
采用日本電子公司(TEOLcompany) JSM6360LV型高分辨冷場(chǎng)發(fā)射掃描電鏡對(duì)樣品進(jìn)行表面形貌和斷層掃描。用美國(guó)ThermoFisher Scientific公司的ESCALAB 250型電子能譜儀對(duì)樣品進(jìn)行表面組分分析(XPS)。用日本Shimadzu公司的XRD-6000分析其晶體結(jié)構(gòu)。
JJ-1BA型恒速攪拌器,轉(zhuǎn)速精度大于1%,江蘇榮華儀器有限公司;NaI(Tl)γ譜儀,探頭表面對(duì)137Cs 667.6 keV γ的探測(cè)效率為5.2%,北京核儀器廠;X-SeriesⅡ型電感耦合等離子質(zhì)譜儀(ICP-MS),美國(guó)ThermoFisher Scientific公司。
實(shí)驗(yàn)所用化學(xué)試劑均為市售分析純;137Cs為放化純CsCl水溶液,中國(guó)同位素公司生產(chǎn)。
1.2 KNiFC/Ni的合成
準(zhǔn)確稱取一定量Ni粉和K4Fe(CN)6·3H2O于50 mL燒杯中,加入20 mL去離子水將K4Fe (CN)6·3H2O溶解完全。然后,在(95±5)℃水浴下緩慢滴加2 mL 2.4 mol/L的HCl,攪拌反應(yīng)30 min,之后室溫靜置約30 min。然后,用去離子水洗滌沉淀,直到洗滌液澄清透明,且pH基本不變?yōu)橹埂W詈髮⒊恋碇糜?10℃烘箱中恒溫干燥24 h,得到固體粉末用磁分離的方法將具有磁性的顆粒收集便得到目標(biāo)產(chǎn)物KNiFC/Ni。
為了合成對(duì)銫具有高分配系數(shù)的KNiFC/Ni,研究了攪拌速度、K4Fe(CN)6濃度、反應(yīng)時(shí)間、KCl濃度、Ni粉及其粒度的影響,并根據(jù)Kd值的大小,確定出了最佳合成條件,并對(duì)在最佳合成條件下制備的吸附劑進(jìn)行了表征和性能測(cè)試。
1.3 吸附容量的測(cè)定
準(zhǔn)確稱取0.05 g吸附劑于15 mL的離心管內(nèi),然后,向其中加入5mL不同濃度的銫溶液,振蕩約2 min,靜置4 h;接著在4 000 r/min下離心15 min;取上清液用電感耦合等離子體質(zhì)譜(ICPMS)測(cè)定溶液中銫的濃度,根據(jù)公式(1)計(jì)算出吸附量q,作吸附量q對(duì)平衡濃度c的等溫吸附曲線。根據(jù)Langmiuer公式(2)擬合,求出吸附劑的飽和容量Q。
Cs在固相吸附劑上的平衡吸附量q(mmol/g)通過下式計(jì)算:

其中:c0,溶液中Cs的初始濃度,mmol/L;c,溶液中Cs的平衡濃度,mmol/L;V,吸附液的體積,L;m,吸附劑的質(zhì)量,g。
Langmiuer吸附公式:

其中:Q,吸附劑的理論飽和吸附容量,mmol/g;K,該溫度下的吸附常數(shù)。
1.4 靜態(tài)法
吸附分配系數(shù)(Kd)表示吸附平衡時(shí)吸附質(zhì)在兩相間的平衡濃度之比,其表達(dá)式如式(3)所示。為了評(píng)價(jià)KNiFC/Ni吸附劑對(duì)Cs的吸附性能,采用靜態(tài)法測(cè)定其Kd值:準(zhǔn)確稱取0.05 g吸附劑于15 mL的聚乙烯離心管內(nèi),加入不同pH、含不同陽離子的137Cs溶液5 mL,振蕩1~2 min,靜置吸附4 h。然后在4 000 r/min下離心15 min,取上清液1 mL在NaI(Tl)γ譜儀上測(cè)量,求出Kd值。實(shí)驗(yàn)中所用137Cs溶液的活度濃度約為2.0× 104Bq/L,使用前用NaI(Tl)γ譜儀準(zhǔn)確測(cè)定其活度濃度(或計(jì)數(shù)率)。

其中:C0,137Cs的初始活度濃度,Bq/L;Ct,吸附平衡后137Cs的活度濃度,Bq/L;V,吸附溶液的體積,mL;m,吸附劑的質(zhì)量,g。
2 結(jié)果和討論
2.1 KNiFC/Ni的合成
該合成過程涉及的離子反應(yīng)式有:主反應(yīng)

副反應(yīng)

該合成過程涉及一個(gè)表面反應(yīng),整個(gè)反應(yīng)歷程為氧化-擴(kuò)散-絡(luò)合。首先,鹽酸與Ni粉表面接觸,在Ni粉本體表面反應(yīng)破壞鎳金屬鍵,形成鎳離子(非自由離子)。溶液中的Fe(CN)46-和K+從溶液本體穿過擴(kuò)散層到達(dá)Ni粉表面,與還未完全脫離的鎳離子快速絡(luò)合,在Ni粉表面形成亞鐵氰化鎳鉀K4-2xNix[Fe(CN)6](x=1~2)吸附核心,圖1為反應(yīng)過程示意圖。同時(shí)溶液中還會(huì)發(fā)生反應(yīng)(5)和(6),鎳粉會(huì)被氧化形成自由Ni2+進(jìn)入溶液,而在溶液本體形成亞鐵氰化物沉淀。為了盡量在鎳粉表面原位合成亞鐵氰化鎳鉀,而不是在溶液本體中形成沉淀,要合理控制反應(yīng)條件,使得H+和鎳粉的反應(yīng)不能太快。否則,F(xiàn)e(CN)46-和K+還未擴(kuò)散至其表面,鎳已經(jīng)完全脫離了基體形成自由的Ni2+,那么,便會(huì)在溶液中形成大量的沉淀,而不形成與Ni結(jié)合緊密的吸附劑。由于KNiFC/Ni具有磁性,而亞鐵氰化鎳鉀沉淀沒有磁性,因此,可將最后干燥后的產(chǎn)品采用磁分離的方法得到目標(biāo)產(chǎn)物KNiFC/Ni。

圖1 KNiFC/Ni吸附劑合成示意圖Fig.1Synthesis schematic diagram of KNiFC/Ni adsorbent

圖2 攪拌速度對(duì)Kd值的影響Fig.2Influence of stirring rate on the Kdvalue
圖2 —7分別為攪拌速度(ω)、亞鐵氰化鉀濃度、反應(yīng)時(shí)間(t)、氯化鉀濃度、不同鎳粉和鎳粉粒度(D)等條件對(duì)合成的吸附劑吸附Cs的吸附分配系數(shù)的影響曲線。從圖2和3可知,攪拌速度和亞鐵氰化鉀的濃度對(duì)Kd有很大的影響。這是因?yàn)樵摵铣煞磻?yīng)為表面反應(yīng),攪拌改變了溶液中離子擴(kuò)散的路徑和進(jìn)程。攪拌速度增大,擴(kuò)散層厚度減小,成核離子的擴(kuò)散速度增大,因此,表面形成KNiFC/Ni增多Kd增大。另一方面,攪拌對(duì)材料表面有一定的沖洗作用,當(dāng)擴(kuò)散層厚度達(dá)到極限值后,沖洗作用顯著;隨著攪拌速度的增大,表面結(jié)晶成核幾率和速度降低;同時(shí),由于H3+O、K+、Fe(CN)46-的離子本身電性、電荷和離子大小的差異,攪拌對(duì)擴(kuò)散影響的程度不同,因此對(duì)反應(yīng)進(jìn)程有很大的影響,Kd值變化會(huì)很大。K+、Fe (CN)46-為成核離子,其濃度大小直接影響產(chǎn)物組成,化學(xué)組成不同的產(chǎn)物其Kd值有很大的差異,當(dāng)攪拌速度為750 r/min,亞鐵氰化鉀濃度為0.09 mol/L時(shí)形成了高Kd值(4.0×104mL/g)的產(chǎn)物。由圖4可知,反應(yīng)時(shí)間主要影響反應(yīng)程度,隨著反應(yīng)時(shí)間增加,得到的KNiFC/Ni越多,Kd值越大。但該反應(yīng)為擴(kuò)散控制,化學(xué)反應(yīng)速度非常快,因此,反應(yīng)一旦開始,很快接近平衡,Kd值緩慢增大。反應(yīng)到一定程度,Ni粉表面的反應(yīng)核心越來越少,但攪拌對(duì)表面不斷沖洗,KNiFC開始減少。因此,隨著反應(yīng)時(shí)間的增加,Kd值先增大后減小。在20、40 min時(shí)Kd值分別為7.5×104、1.0 ×105mL/g,因此,反應(yīng)時(shí)間為20~40 min較為合適。從圖5可知,K+濃度的變化對(duì)Kd值的影響不大。在沒有添加KCl時(shí),該溶液中的K+與Fe(CN)46-的物質(zhì)的量的比為4∶1。亞鐵氰化鉀本身提供的K+濃度已經(jīng)滿足形成KNiFC/Ni吸附劑所需的配比,所以,增加K+的濃度也不會(huì)影響Kd值。從圖6可知,用不同生產(chǎn)工藝的鎳粉合成的吸附劑Kd值有一定的差異,這主要與其表面存在不同的薄層結(jié)構(gòu)有關(guān),一旦外層薄膜結(jié)構(gòu)破壞掉,差異基本上消除,因此差異不大。由圖7可知,隨著鎳粉直徑的減小,Kd值卻不斷增大,且在60 μm時(shí)突然增大,之后基本成線性緩慢增大。

圖3 K4Fe(CN)6的濃度對(duì)Kd值的影響Fig.3Influence of K4Fe(CN)6concentration on the Kdvalue

圖4 反應(yīng)時(shí)間對(duì)Kd值的影響Fig.4Influence of reaction time on the Kdvalue
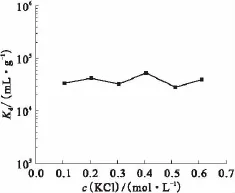
圖5 KCl濃度對(duì)Kd值的影響Fig.5Influence of KCl concentration on the Kdvalue

圖6 不同鎳粉對(duì)Kd值的影響Fig.6Influence of nickel powder on the Kdvalue

圖7 鎳粉粒度對(duì)Kd值的影響Fig.7Influence of nickel powder mesh on the Kdvalue
綜上所述,最佳合成條件和流程為:0.09 mol/L的亞鐵氰化鉀20 mL和約60 μm的鎳粉置于50 mL的燒杯中。然后,在(95±5)℃水浴下緩慢滴加2 mL 2.4 mol/L的HCl,在750 r/min下攪拌反應(yīng)30 min,之后室溫靜置約30 min。然后,用去離子水洗滌沉淀,直到洗滌液澄清透明,且pH基本不變?yōu)橹埂W詈髮⒊恋碇糜?10℃烘箱中恒溫干燥24 h,得到固體粉末,再用磁分離的方法便可分離出目標(biāo)產(chǎn)物KNiFC/Ni。在該最佳條件下KNiFC/Ni的收率約為62%,合成的KNiFC/Ni吸附劑在中性水溶液中Kd可達(dá)105mL/g。
2.2 KNiFC/Ni的表征
為了確定是否在Ni基體上原位合成了與其化學(xué)結(jié)合的KNiFC,分析了最佳條件下合成的樣品,樣品表面形貌和斷面形貌電鏡圖示于圖8和9。由圖8和9可知,在Ni粉表面確實(shí)包覆了一層物質(zhì),且兩相之間結(jié)合緊密,并非簡(jiǎn)單的物理連接,而是一個(gè)平滑的過渡相,因此,可以確定其為化學(xué)結(jié)合。但是該結(jié)合層僅40~80 nm,因此無法用能譜分析(EDS)確定其化學(xué)組成,需要XPS來確定其包覆層的化學(xué)組成是否為KNiFC。KNiFC/Ni和基體Ni的XPS譜圖示于圖10。從圖10可知,KNiFC/Ni的XPS圖譜比Ni粉的圖譜明顯增加了KNiFC/Ni的特征峰K 2p、N 1s、Fe 2p3等。根據(jù)相對(duì)峰強(qiáng),給出其相對(duì)原子含量,確定出該表面化學(xué)組成為K1.4Ni1.3Fe(CN)6。從圖10還發(fā)現(xiàn),該鎳粉基體表面有較高含量的O和C元素,這可能是鎳粉表面吸附了有機(jī)碳和部分氧化造成,這與圖8觀察到在Ni表面不規(guī)則地存在一些小顆粒的結(jié)果相符。

圖8 KNiFC/Ni表面掃描電鏡Fig.8Surface SEM image of KNiFC/Ni
KNiFC/Ni在2θ=10°~40°的XRD掃描圖示于圖11。該圖與面心立方晶系亞鐵氰化鎳鉀的標(biāo)準(zhǔn)圖譜的峰位、相對(duì)峰強(qiáng)等完全一致,這說明該吸附劑為立方晶系亞鐵氰化鎳鉀,并計(jì)算得出其晶格參數(shù)(a)為0.996 0 nm。因此可以確定,合成了與Ni粉表面通過NiNi鍵緊密結(jié)合的KNiFC吸附劑——KNiFC/Ni,其結(jié)構(gòu)示于圖12,其中吸附核心為KNiFC,Ni本身為KNiFC晶體結(jié)構(gòu)的一部分,但是另一端與金屬Ni本體通過NiNi鍵連結(jié),因此結(jié)合緊密,避免了它的水解問題。在該結(jié)構(gòu)中K+處于KNiFC結(jié)構(gòu)的正中心,為可交換離子,根據(jù)離子半徑大小而選擇性地吸附Cs離子。Ni2+處于KNiFC晶體的一個(gè)面上,起電荷平衡作用。

圖9 KNiFC/Ni斷面掃描圖Fig.9Cross section SEM image of KNiFC/Ni

圖10 KNiFC/Ni和基體Ni的XPS譜圖Fig.10XPS spectrum of KNiFC/Ni and matrix Ni

圖11 KNiFC/Ni吸附劑10°~40°XRD譜圖Fig.1110°-40°XRD spectrum of KNiFC/Ni adsorbent

圖12 KNiFC/Ni的結(jié)構(gòu)示意圖Fig.12Structure schematic diagram of KNiFC/Ni adsorbent
2.3 吸附性能測(cè)試
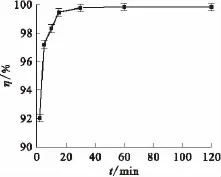
圖13 吸附動(dòng)力學(xué)曲線Fig.13Sorption kinetic curve
2.3.1 吸附平衡時(shí)間的確定吸附平衡時(shí)間實(shí)驗(yàn)同靜態(tài)法操作完全相同,做了7個(gè)吸附時(shí)間點(diǎn),每個(gè)時(shí)間點(diǎn)等精度做3個(gè)樣品,到吸附時(shí)間后,取出上清液,分析137Cs的比活度,求出吸附率(η),然后做η隨吸附時(shí)間t的變化曲線,結(jié)果示于圖13。由圖13可知,5 min后吸附率大于90%,經(jīng)過1 h基本達(dá)到吸附平衡,這說明吸附速度非常快。2.3.2背景電解質(zhì)濃度對(duì)Kd值的影響HNO3濃度對(duì)Kd值的影響示于圖14(a)。從圖14(a)可知,隨著硝酸濃度的增加,Kd值逐漸減小,但當(dāng)c(HNO3)=3 mol/L時(shí),Kd仍大于104mL/g,說明即使在較高的酸度下該吸附劑仍對(duì)Cs有很好的吸附。實(shí)際廢液中硝酸濃度大多小于3 mol/L。NaNO3濃度對(duì)Kd值的影響示于圖14(b)。從圖14(b)可知:隨著硝酸鈉濃度的增加,Kd值逐漸減小,當(dāng)c(NaNO3)=1 mol/L時(shí),其Kd值仍大于103mL/g;當(dāng)c(NaNO3)=0.1 mol/L時(shí),其Kd>104mL/g。一般中低放廢水中Na+濃度都遠(yuǎn)小于1 mol/L。這說明該吸附劑對(duì)Cs具有很好的選擇性,即使在高鹽條件下,仍然具有很高的Kd值。一般含銫低放廢液中均共存有一定活度的放射性90Sr,Sr的量雖不大但為二價(jià)相鄰主族元素,在離子交換中具有很強(qiáng)的競(jìng)爭(zhēng)性。因此,研究了不同Sr2+濃度對(duì)Kd值的影響,結(jié)果示于圖15(a)。由圖15(a)可知,Kd值先快速減小然后穩(wěn)定,當(dāng)c (Sr2+)=0.1 mol/L時(shí),Kd值仍大于103mL/g。實(shí)際廢水中一般90Sr的量遠(yuǎn)小于0.1 mol/L,因此,對(duì)KNiFC/Ni的吸附性能影響不大。NH4+濃度對(duì)Kd值的影響示于圖15(b)。從圖15(b)可知,NH4+濃度對(duì)Kd值有很大的影響,隨著c(NH4+)的增大Kd值迅速減小,當(dāng)c(NH4+)=1.0 mol/L時(shí),Kd值小于300 mL/g。這是因?yàn)镵NiFC/Ni吸附Cs為離子交換機(jī)理,NH4+和Cs+的離子半徑最為接近,競(jìng)爭(zhēng)也最為激烈。在整個(gè)實(shí)驗(yàn)過程中,沒有出現(xiàn)吸附劑水解現(xiàn)象,這說明該吸附劑具有很好的水解穩(wěn)定性。

圖14 HNO3(a)和NaNO3(b)濃度對(duì)Kd值的影響Fig.14Influence of HNO3(a)and NaNO3(b)concentration on the Kdvalues
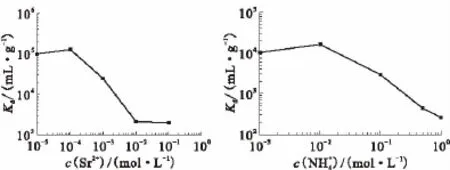
圖15 Sr(NO3)2(a)和NH+4(b)濃度對(duì)Kd值的影響Fig.15Influence of Sr(NO3)2(a)and NH+4(b)concentration on the Kdvalues
2.3.3 吸附容量的測(cè)定在室溫(15℃)下,采用等溫吸附法分別測(cè)定了該吸附劑在水溶液(pH=7)和1 mol/L HNO3溶液中對(duì)Cs的吸附容量,結(jié)果示于圖16。從圖16可知:在水溶液中吸附劑對(duì)Cs的吸附容量為0.23 mmol/g;在1 mol/L HNO3介質(zhì)下,吸附容量變化不大為0.21 mmol/g。這說明酸度對(duì)吸附容量影響不大,該吸附劑對(duì)Cs具有較高的選擇性。該吸附容量與離子交換樹脂相比,容量較小,但選擇性非常好,受酸度影響較小,其交換容量基本全部用于Cs的吸附交換。
2.4 吸附機(jī)理
在室溫下,做出該吸附劑對(duì)Cs的吸附等溫線,對(duì)該吸附等溫線分別采用Langmiur和Freundlich擬合,得到的結(jié)果示于圖17。
將公式(2)轉(zhuǎn)化可得Langmuir擬合直線方程:

Freundlich吸附模型實(shí)際是一個(gè)多分子層吸附的經(jīng)驗(yàn)公式,其表達(dá)式見式(8)。

將式(8)進(jìn)行變換得到:
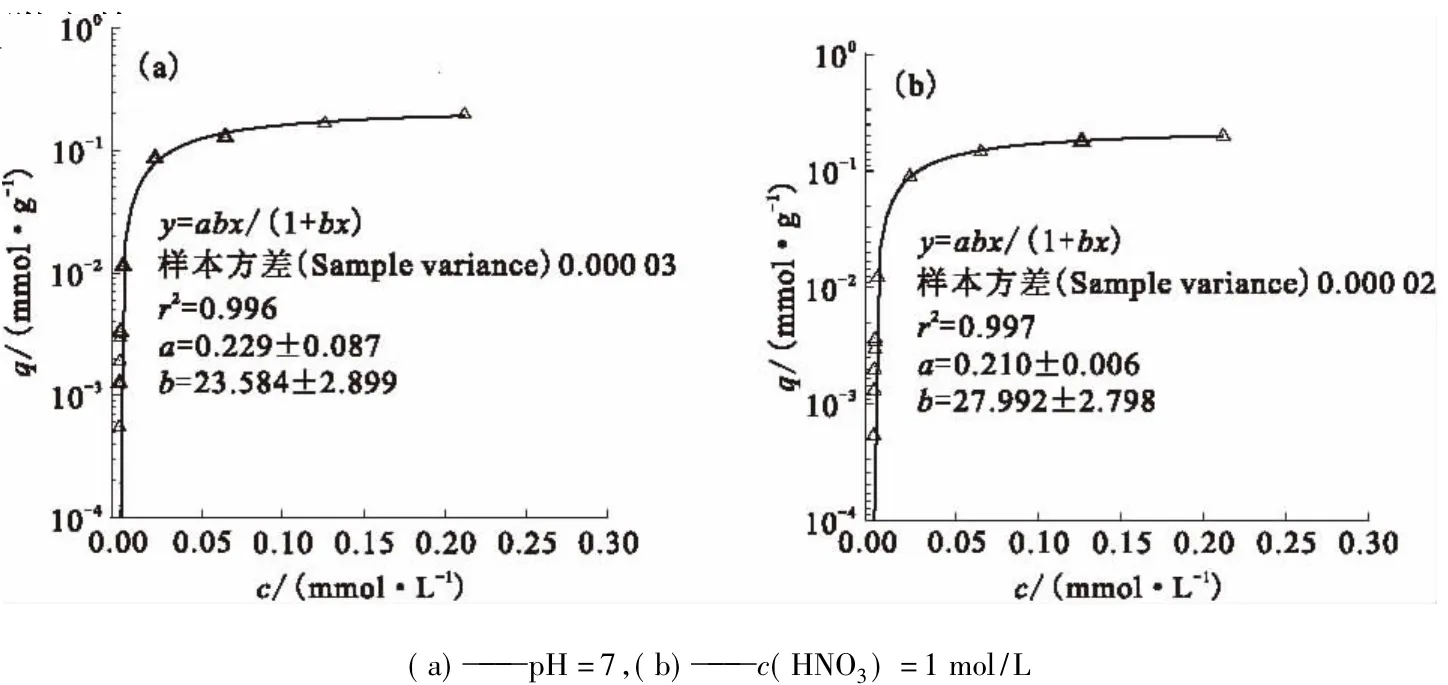
圖16 Cs的吸附量隨酸度變化曲線Fig.16Cs sorption amount curves on the H+concentration


圖17 Langmuir(a)和Freundlich(b)擬合的吸附等溫線Fig.17Langmuir(a)and Freundlich(b)fitting lines of sorption
其中:Kf、n,經(jīng)驗(yàn)常數(shù);c,吸附平衡時(shí)液相吸附質(zhì)的濃度,mmol/L。
從圖17(a)和(b)比較可知,用Langmuir擬合等溫吸附數(shù)據(jù)的誤差為0.028,相關(guān)系數(shù)r= 0.996,而采用Freundlich擬合誤差大了一個(gè)量級(jí),為0.17,相關(guān)系數(shù)r=0.985<0.996。因此,該吸附更符合Langmuir單分子層吸附模型,可初步認(rèn)為該吸附為單分子層的化學(xué)吸附。
為了確定該吸附是否為化學(xué)吸附,對(duì)KNiFC/Ni吸附劑進(jìn)行Cs吸附后進(jìn)行光電子能譜XPS分析和溶液分析。吸附Cs前后樣品的XPS能譜分析數(shù)據(jù)列入表1。從表1可知,吸附Cs后XPS能譜中發(fā)現(xiàn)了Cs元素,從而可以確定該吸附劑在含銫溶液中浸泡后,該吸附劑確實(shí)吸附了Cs離子。從能譜分析的相對(duì)含量看,吸附Cs后K元素的相對(duì)含量減少,Cs的含量增加,且K的減少量基本等于Cs的增加量。這說明溶液中的Cs取代了K,該吸附劑的吸附機(jī)理涉及離子交換過程,是典型的離子交換吸附。
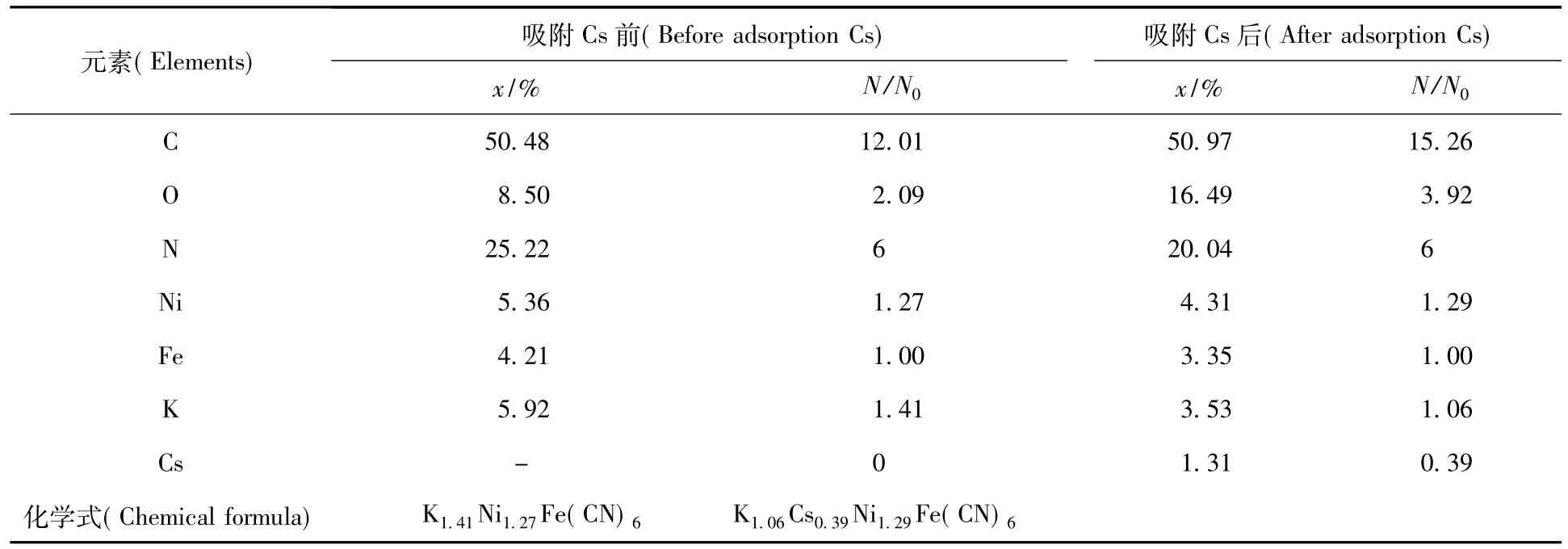
表1 吸附Cs前后XPS能譜元素含量分析Table 1XPS elements content analysis of the adsorbent after and before sorption Cs
KNiFC/Ni吸附Cs前后的溶液數(shù)據(jù)分析列入表2。從表2可知,吸附Cs后K元素的減少量基本等于Cs的增加量,即為該吸附劑吸附一個(gè)Cs+的同時(shí)解脫下一個(gè)K離子,這可以說明該吸附過程實(shí)際上是一個(gè)Cs+取代了一個(gè)K+的離子交換吸附機(jī)理。
3 結(jié)論
采用水溶液的方法在金屬Ni粉表面原位合成了與基體Ni通過化學(xué)鍵緊密結(jié)合的KNiFC/Ni吸附劑。經(jīng)分析,該KNiFC覆蓋層約為40~80 nm,為面心立方晶系亞鐵氰化鎳鉀,其化學(xué)組成為K1.4Ni1.3Fe(CN)6。該KNiFC/Ni具有如下特點(diǎn):
(1)該吸附劑不水解,對(duì)Cs具有很高的選擇性,對(duì)Cs的Kd值可達(dá)105mL/g,并且pH、Na+濃度和Sr2+濃度等對(duì)其影響較小,當(dāng)c(Na+)=0.1 mol/L時(shí),其Kd值仍大于104mL/g;
(2)該吸附劑的吸附動(dòng)力學(xué)很好,約5 min吸附率可達(dá)90%,吸附平衡時(shí)間約為1 h;

表2 吸附平衡后Cs的吸附量和K的釋放量Table 2Equilibrium sorption amount of Cs andthe release amount of K
(3)NH4+濃度對(duì)其吸附Cs的Kd值有較大影響,隨著c(NH4+)的增大,Kd值迅速減小;當(dāng)c(NH4+)=1.0 mol/L時(shí),Kd值比最大值低了約2個(gè)量級(jí);
(4)該吸附劑對(duì)Cs的吸附為離子交換吸附機(jī)理,由于NH4+對(duì)Cs有很強(qiáng)的競(jìng)爭(zhēng),因此NH4+的存在會(huì)影響銫的吸附效果。
[1]Perkárek V,Vesely V.Synthetic inorganic ion-exchangerⅡ:salts of heteropolyacids,insoluble ferrocyanides,synthetic aluminosilicates and miscellaneous exchangers[J].Talanta,1972,19:1245-1283.
[2]Schneemeyer L F,Spengler S E,Murphy D W.Ion selectivity in nickel hexacyanoferrate films on electrodes surfaces[J].Inorg Chem,1985,24:3044-3046.
[3]Hass P A.A review of information on ferrocyanide solids for removal of cesium from solutions[J].Sep Sci Technol,1993,28(17-18):2479-2506.
[4]Kourim V,Rais J,Million B.Exchange properties of complex cyanidesⅠ:ion exchange of cesium on ferrocyandies[J].Inorg Nucl Chem,1964,26:1111-1115.
[5]Sz?ke S,Pátay G,Weiser L.Development of selective cobalt and cesium removal from the evaporator concentrates of the PWR paks[J].Radiochim Acta,2003,91:229-232.
[6]Avramenko V A,Bratskaya S Y,Egorin A M,et al.Colloid-stable nanosized selective sorbents for decontamination of bulk materials[J].Doklandy Chem,2008,422(5):251-254.
[7]Internat S A,Kotvitskyy O G,Gachenko M V,et al.Method for decontamination of liquid radioactive waste and Cs-selective sorbent:EP,WO2008002282A1[P].2008-01-03.
[8]Sharygin L,Muromskiy A,Kalyagina M.A granular inorganic cation-exchanger selective to cesium[J].J Nucl Sci Technol,2007,44(5):767-773.
[9]Collins J L,Davidson D J,Chase C W,et al.Development and testing of ion exchangers for treatment liquid waste at Oak Ridge National Laboratory:ORNL/ TM-12315[R].US:Tennessee Technological University,1993.
[10]Waste Technology Section of IAEA.New development and improvement in processing of“problematic”radioactive waste[G].Austria:IAEA,2007:41-42.
[11]Tusa E,Harjula R,Lehto J.Use of novel highly selective ion exchange media for minimizing the waste arisings from different NPP and other liquids[C]∥Department of Energy.Waste Management 2003 Symposium,Tucson,AZ(US),2003-02-23.Tucson: WM Symposia,Inc.,2003.
Fabrication of a Novel Selective Adsorbent for Cesium and Its Performance Research
YOU Xin-feng,ZHANG Zhen-tao
China Institute of Atomic Energy,P.O.Box 275(93),Beijing 102413,China
A novel inorganic selective adsorbent for cesium,potassium nickel hexacyanoferrate (KNiFC/Ni)based on the surface of nickel matrix,was synthesized in site by a simple water chemical method.Its surface chemical composition is K1.4Ni1.3Fe(CN)6determined by X-ray photoelectron spectrometry(XPS),and the crystalline structure of KNiFC is face-centered lattice with a= 0.996 0 nm determined by the X-ray diffractometry(XRD),and its thick is about 40-80 nm.The adsorbent is stable in aqueous media.It has high adsorption capacity,rapid adsorption kinetics and high selectivity for Cs+.The distribution coefficient(Kd)for137Cs is up to 105mL/g,and even in the 1.0 mol/L NaNO3solution,it is still over 103mL/g.It is found that the adsorbent for137Cs is typical ion-exchange mechanism.Because NH4+ion radius is close to Cs+,NH4+has the strongest competition as compared to Na+,Sr2+,and H+.The adsorbent is promising for137Cs separation and treatment of137Cs liquid waste.
potassium nickel hexacyanoferrate;137Cs;ion-exchange;selective adsorption
TL941
A
0253-9950(2014)03-0140-09
10.7538/hhx.2014.36.03.0140
2013-10-30;
2014-01-24
游新鋒(1982—),男,河南漯河人,博士,助理研究員,核燃料循環(huán)與材料專業(yè)

