動態光散射研究鹽對Gemini表面活性劑網狀聚集體的影響
劉 芬 謝丹華 趙劍曦
(福州大學化學化工學院膠體與界面化學研究所,福州350108)
1 引言
Gemini表面活性劑分子中的聯接鏈是主導其自組織行為的關鍵結構因素,人們對柔性聚亞甲基聯接鏈的各種作用已有了深刻認識,1-8但迄今很少涉及長剛性聯接鏈.所謂的長剛性聯接鏈有兩個特點,一是它無法像柔性鏈那樣可以彎曲以適應環境的要求,2二是它的長度遠超過了被分隔開的兩個離子頭基間的靜電平衡距離,我們最近的工作9已證實這樣聯接鏈構成的Gemini分子具有獨特新穎的自組織行為.由于長剛性聯接鏈的分隔,兩根烷烴尾鏈無法靠攏,分子呈現似柱形狀,因此極易形成蠕蟲膠束.10-13也是由于水溶液中分子的兩根烷烴尾鏈難以被有效保護,即使在很低濃度時體系已具有了高能量,Gemini分子的兩根烷烴尾鏈于是更傾向于采取反式構型(trans-configuration),這不僅因為長剛性聯接鏈給烷烴尾鏈繞聯接鏈的旋轉提供了方便,而且反式構型允許不同分子烷烴尾鏈間相接觸,可以部分地降低體系能量,這種相互作用導致在很稀溶液中就形成了由烷烴尾鏈搭建起來的網狀聚集體(示意圖見圖1).9如果向這種網狀聚集體溶液中加入少量鹽,鹽的反離子將中和聚集體中Gemini頭基的電荷,破壞了該結構脆弱的親油親水平衡,迫使體系能量增高,這將崩解網狀聚集體,使之轉化成穩定性高的核-殼結構膠束.本文研究這種鹽效應,以期利用添加少量鹽來敏感地調節和控制這種體系分子聚集體的結構與形貌.

圖1 網狀聚集體示意圖Fig.1 Schematic diagram of network-like aggregates
2 實驗部分
2.1 試劑
合成了羧酸鹽Gemini表面活性劑O,O′-雙(2-月桂酸鈉)-p-二苯氧,9簡記為C12?2C12,分子結構式為:
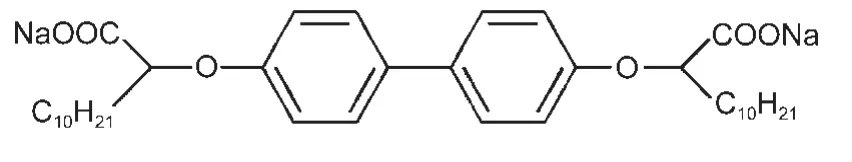
NaCl和MgCl2·6H2O(分析純,國藥集團化學試劑有限公司).四甲基溴化銨(Me4NBr),四乙基溴化銨(Et4NBr),四丙基溴化銨(Pr4NBr)和四丁基溴化銨(Bu4NBr)均購于 Acros,USA,純度>98%.1,6-二苯基-1,3,5-己三烯(DPH)購于Sigma-Aldrich,USA,純度98%.所有溶液用Milli-Q級超純水(電阻率18.2 MΩ·cm)制備.
2.2 實驗方法
2.2.1 動態光散射
由裝備有BI-200SM測角儀、BI-9000AT數字相關儀(522通道)和高靈敏光電倍增檢測器的Brookhaven光散射系統(美國Brookhaven)測定.測試光源由功率15 mW的632.8 nm波長He-Ne激光器(美國JDS Uniphase)提供.精密控溫儀(美國Polyscience,控溫精度±0.01°C)控制樣品池溫度.所有測試溶液升溫至40°C后用0.22 μm微孔過濾器過濾,棄去剛開始的約1 mL溶液,隨后的溶液直接濾入直徑15 mm的安剖瓶中,在25°C水浴中平衡3天.以自拍模式測定散射光強度的時間相關函數G(2)(τ,q),τ為弛豫時間,q為散射矢量.實驗數據由CONTIN或雙指數程序擬合分析.
2.2.2 DPH增溶
用Hitachi F-4500熒光分光光度計(日本Hitachi)測定DPH探針(~1 μmol·L-1)在表面活性劑水溶液中的熒光發射譜,激發波長為360 nm,提取發射波長430 nm處平行于和垂直于入射方向的熒光偏振強度IVV和IVH,由下式求算各向異性參數r:16

式中G=IHV/IHH,代表儀器校正因子.
2.2.3 溶液流變
用應力控制的AR2000ex流變儀(TA instruments,USA),以錐板法測量溶液的流變行為.錐板由標準的ETC鋼制造,直徑40 mm,錐角2°.錐中心和板的縫隙為50 μm.在控溫下,放入樣品溶液靜置5 min以達到平衡,開始檢測前先以6.28 rad·s-1(1 Hz)的頻率進行應力掃描,隨后在一個能保證樣品處于線性粘彈區的應力值下進行振蕩剪切測量.
所有測試溫度均為25°C.
3 結果與討論
3.1 鹽引起網狀聚集體轉變為核-殼結構膠束
如引言所述,我們9已經證實了C12?2C12在稀溶液中形成了網狀聚集體,此時10 mmol·L-1溶液的動態光散射(DLS)結果見圖2(b)中無添加鹽情況,散射光強度圍繞著Rh,app~100 nm分布.當向這個溶液中添加NaCl和MgCl2可以看到散射光強度從原先的單分布向雙分布轉變,圖2給出NaCl添加的光強轉變圖像.添加四烷基銨鹽也有類似情況,DLS圖不再重復列舉.這些結果表明鹽使網狀聚集體發生了轉變,在一定鹽濃度時出現了圍繞較小尺寸的新分布.對雙分布的實驗數據以雙指數程序(doubleexponential expression)擬合更為精確,14圖2(c)給出處理實例,由此以小尺寸分布的光強對鹽濃度作圖(圖3(a)),從光強急劇增強的轉折點可得到引起小尺寸聚集體的臨界鹽濃度Cc,salt,數據列于表1.
初始形成的小聚集體流體力學半徑Rh,app約為1.6 nm.由Tanford公式可以計算烷烴鏈長度lc(nm)=0.15+0.1265n,式中n表示烷烴鏈上的碳原子數,15由此可得出C12?2C12尾鏈長度為1.54 nm,接近上述Rh,app,表明這種小聚集體很可能為核-殼結構的膠束.倘若如此,油溶性的探針可以被很好地增溶,為此我們設計了DPH探針的增溶實驗.圖3(b)為DPH各向異性參數r隨鹽濃度的變化,r值急劇上升說明DPH被很好地增溶,此時一定存在核-殼膠束,曲線轉折點為探針方法獲得的臨界鹽濃度C′c,salt.表1比較了它和光散射方法得到的Cc,salt,兩者吻合相當好,這證實了光散射出現的小尺寸強度分布是生成了核-殼結構的膠束.

圖2 (a)90°測試的C12?2C12(10 mmol·L-1)時間相關函數(G(τ))隨NaCl濃度的變化;(b)CONTIN模型處理得到的散射光強度-粒徑分布;(c)雙指數模型處理結果Fig.2 (a)Time correlation functions(G(τ))measured at 90°for C12?2C12(10 mmol·L-1)with different concentrations of NaCl;(b)their corresponding scattering intensity-radius fraction distributions dealt by CONTIN model,and(c)the results of double distributions analyzed by double-exponential(Dblexp)model
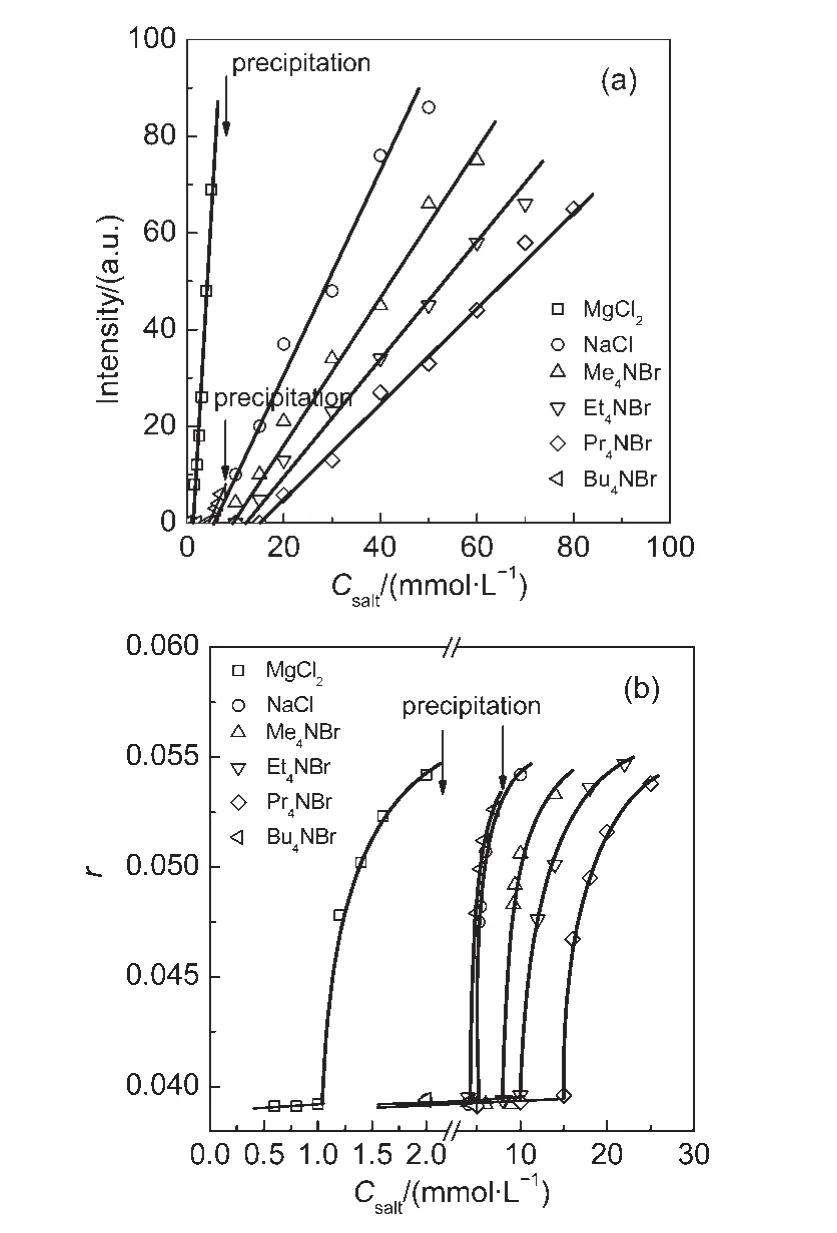
圖3 C12?2C12體系:根據雙指數模型得到的小尺寸聚集體散射光強(a)和1,6-二苯基-1,3,5-己三烯(DPH)各向異性參數r(b)隨鹽濃度的變化Fig.3 C12?2C12systems:Variation of the scattering intensity of small micelles derived from Dblexp model(a)and the anisotropy parameter r of 1,6-diphenyl-1,3,5-hexatriene(DPH)(b)with salt concentration
3.2 聚集體轉變的機理
將各種鹽對應的臨界濃度C′c,salt作圖(圖4),可見除了Bu4NBr外,它們呈現了有規律的遞進.與NaCl相比,MgCl2的C′c,salt明顯更小,Me4NBr的則較大,而且隨著季銨離子上取代基鏈增長(從Me4NBr?Et4NBr?Pr4NBr),離子體積逐漸增大,17,18與羧酸頭的結合力減弱,C′c,salt因此進一步增大.從反離子角度看,圖4的這個順序很好地說明了它們對C12?2C12負離子頭基的電荷效應,即兩者庫侖作用力愈強,C′c,salt愈小.于是我們可以理解鹽加入引起網狀聚集體轉變的原因:如引言所述,C12?2C12是由于長剛性聯接鏈導致烷烴尾鏈暴露在水溶液中,于是它們采用反式構型以便與鄰近分子的烷烴鏈相互交搭成網狀結構.很顯然,這種網狀聚集體中的烷烴鏈并沒有像核-殼膠束那樣被有效保護,體系仍具有較高的能量.當加入鹽后,反離子通過靜電相互作用與C12?2C12的羧基結合,破壞了網狀結構中本來就很脆弱的親水親油平衡,致使其中的分子轉化為核-殼結構的膠束.

表1 小聚集體散射光強急劇增大點和DPH各向異性曲線拐點對應的臨界鹽濃度Cc,salt和C′c,saltTable 1 Critical concentration of salt Cc,saltinducing rapid increase in scattering intensity of small aggregates and C′c,salt from the break point of anisotropy curve of DPH probe
當前的聚集體轉變機理與通常的都具有核-殼結構的球-棒聚集體轉變略有不同,盡管都是依靠反離子的庫侖效應,但前者通過增加體系的不穩定性來實現聚集體轉化,后者則創造了更有利于分子緊密排列的條件,促使體系能量進一步降低所致.從這個觀點看,當前的鹽效應比引起球-棒轉變應更加敏感,或者說添加少量鹽就可達到目的.例如,NaCl加入150 mmol·L-1仍未使十二烷基硫酸鈉(SDS)的球狀膠束轉變為棒狀膠束,此時的鹽對表面活性劑摩爾比βsalt達2.2.19而對十四烷基三甲基氯化銨(TTAC),引起聚集體球-棒轉變的臨界NaCl濃度甚至高達2700 mmol·L-1,βsalt為38.6.20相比之下,我們體系NaCl的βsalt僅為0.52.
在這些鹽中,Bu4NBr出現了反常,它的C′c,salt跌到一個很小的數值,與NaCl的接近(見圖4和表1).這一定與Bu4NBr增長的烷烴鏈有關,它使這個反離子表現出疏水鹽的性質,即在電性結合的同時,Bu4NBr的烷烴鏈與C12?2C12頭基附近的尾鏈發生了疏水相互作用,呈現出更強的結合力,因此C′c,salt明顯下降.為了驗證這一點,我們改用辛基三甲基溴化銨(C8NBr)作為添加劑,這個化合物季銨頭體積接近Me4NBr,按理靜電效果應同后者,但由于攜帶了C8尾鏈,它也得到很低的C′c,salt(表1),很好地說明了烷烴鏈間疏水相互作用在促進C12?2C12網狀聚集體轉化的作用.

圖4 DPH各向異性參數r突變點對應的臨界鹽濃度C′c,saltFig.4Critical salt concentration C′c,saltinducing rapid increase in anisotropy parameter r of DPH probe

圖5 (a)表觀流體力學半徑Rh,app隨鹽濃度的變化及(b)各鹽對應的聚集體生長速率kh,appFig.5 (a)Variation of apparent hydrodynamic radius Rh,appwith salt concentration and(b)aggregate growth rate kh,app depending on different salts
3.3 兩種分布表觀尺寸的變化
當鹽引起網狀聚集體向核-殼結構膠束轉變后,溶液中共存著大、小兩種尺寸的聚集體,DLS在90°角測得結果可由雙指數模型精確地分解成尺寸雙分布,得到相應的表觀流體力學半徑Rh1,app(小尺寸)和Rh2,app(大尺寸).圖5(a)給出Rh1,app和Rh2,app分別隨鹽濃度的變化情況,Bu4NBr由于很容易引起沉淀,雙分布數據很少,這里沒有顯示.由圖可見增加鹽濃度加大了聚集體的尺寸,相同鹽濃度下增大尺寸的程度與鹽種類有關,這反映在各條直線的不同斜率上.為定量表征,定義直線的斜率為聚集體生長速率kh,app,即單位鹽濃度引起的聚集體尺寸增量.不同鹽產生的kh,app被示于圖5(b),它給出了鹽效應的兩個特征:(1)鹽效應強弱與圖4的走勢一致,越小的C′c,salt對應了越大的kh,app;不同鹽的作用效果(體現為kh,app)相差很大,在所考察范圍內,最大的kh,app(MgCl2)是最小的kh,app(Pr4NBr)的220倍.(2)鹽效應對大尺寸聚集體的影響比對小尺寸聚集體要明顯得多.

圖6 10 mmol·L-1C12?2C12在給定鹽濃度下的穩態流變曲線(a)和粘彈譜(b)Fig.6 Steady-state viscosity curves(a)and vesicoelastic spectra(b)for the aqueous C12?2C12(10 mmol·L-1)solutions with a given concentration of salts

表2 流變行為的特征參數Table 2 Characteristic parameters of rheological behavior
3.4 線狀膠束和溶液流變行為
從3.3節討論可見,鹽濃度增加明顯促進了大尺寸聚集體長大.按照鹽作用機理(見3.2節),高鹽時不應存在網狀聚集體,這時表面活性劑都轉化為核-殼結構膠束,很大的Rh2,app是否對應著線狀膠束?我們測定了各個體系所對應的最高鹽濃度下溶液的穩態流變(圖6(a)),其中 MgCl2(5 mmol·L-1)和NaCl(100 mmol·L-1)溶液出現了剪切稀化行為,表明這兩種溶液中很可能存在較長的線狀膠束,21這吻合DLS測得它們較大的Rh2,app,分別為1235 nm(MgCl2)和970 nm(NaCl).由Carreau模型22可從圖6(a)的穩態平臺得到零剪切粘度η0,表2數據也顯示MgCl2和NaCl兩個體系的η0確實最高.圖6(b)的振蕩剪切實驗同樣表明這兩個溶液有較好的粘彈性,對應的Cole-Cole圖(圖6(b)插圖)顯示在中低頻率時實驗點符合半圓形狀,表明溶液流變呈現Maxwell流體行為,這些都很好地對應了線狀膠束.表2還列出根據彈性模量G′和粘性模量G?交點的頻率ω0,由其倒數得到的對應Maxwell流體的特征弛豫時間τR.23除了這兩個體系之外,其它體系的粘度均很低.
4 結論
C12?2C12分子具有長的剛性聯接鏈,這撐開了它的兩根烷烴尾鏈,使之完全暴露在水中,因此不得不形成網狀聚集體,以盡可能減小烷烴鏈與水的接觸.從體系能量角度看,網狀聚集體可以在很低表面活性劑濃度時形成,這種網狀聚集體是不穩定的,甚至很少的反離子已足以破壞它的親水親油平衡,促使其轉化成核-殼結構的膠束.此外,這種分子又具有似柱狀的幾何形狀,可以不依靠添加劑幫助直接生成線型膠束,給體系帶來高粘彈性.強的自組織特性和自發形成蠕蟲膠束的能力均可望給這類Gemini表面活性劑帶來良好的應用前景.
(1) Zana,R.;Benrraou,M.;Rueff,R.Langmuir1991,7,1072.doi:10.1021/la00054a008
(2) Alami,E.;Beinert,G.;Marie,P.;Zana,R.Langmuir1993,9,1465.
(3) Danino,D.;Talmon,Y.;Zana,R.Langmuir1995,11,1448.doi:10.1021/la00005a008
(4) Zana,R.;In,M.;Lévy,H.;Duportail,G.Langmuir1997,13,5552.doi:10.1021/la970369a
(5) Hirata,H.;Hattori,N.;Ishida,M.;Okabayashi,H.;Frusaka,M.;Zana,R.J.Phys.Chem.1995,99,17778.doi:10.1021/j100050a017
(6) De,S.;Aswal,V.K.;Goyal,P.S.;Bhattacharya,S.J.Phys.Chem.1996,100,11664.doi:10.1021/jp9535598
(7) Zana,R.J.Colloid Interface Sci.2002,248,203.doi:10.1006/jcis.2001.8104
(8) Zana,R.Adv.Colloid Interface Sci.2002,97,205.doi:10.1016/S0001-8686(01)00069-0
(9) Xie,D.H.;Zhao,J.X.Langmuir2013,29,545.doi:10.1021/la304160s
(10) Song,B.L.;Hu,Y.F.;Zhao,J.X.J.Colloid Interface Sci.2009,333,820.doi:10.1016/j.jcis.2009.02.030
(11) Song,B.L.;Hu,Y.F.;Song,Y.M.;Zhao,J.X.J.Colloid Interface Sci.2010,341,94.doi:10.1016/j.jcis.2009.09.023
(12) Xie,D.H.;Zhao,J.X.;You,Y.Soft Matter2013,9,6532.doi:10.1039/c3sm50694k
(13)Xie,D.H.;Zhao,J.X.;Liu,L.;You,Y.;Wei,X.L.Acta Phys.-Chim.Sin.2013,29,1534.[謝丹華,趙劍曦,劉 琳,游 毅,魏西蓮.物理化學學報,2013,29,1534.]doi:10.3866/PKU.WHXB201304252
(14)Brown,W.;Johansson,K.;Almgren,M.J.Phys.Chem.1989,93,5888.
(15)Tanford,C.J.Phys.Chem.1972,76,3020.doi:10.1021/j100665a018
(16) Khatua,D.;Dey,J.J.Phys.Chem.B2007,111,124.doi:10.1021/jp065225w
(17) Berr,S.S.;Coleman,M.J.;Marriott Jones,R.R.;Johnson,J.S.,Jr.J.Phys.Chem.1986,90,6492.doi:10.1021/j100282a017
(18)Almgren,M.;Swarup,S.J.Phys.Chem.1983,87,876.doi:10.1021/j100228a036
(19)Mazer,N.A.;Benedek,G.B.;Carey,M.C.J.Phys.Chem.1976,80,1075.doi:10.1021/j100551a011
(20) Imae,T.;Ikeda,S.J.Phys.Chem.1986,90,5216.doi:10.1021/j100412a065
(21) Shrestha,R.G.;Shrestha,L.K.;Aramaki,K.J.Colloid Interface Sci.2007,311,276.doi:10.1016/j.jcis.2007.02.050
(22)Macosko,C.W.Rheology:Principles,Measurements and Applications;Wiley-VCH:New York,1994.
(23) Oda,R.;Narayanan,J.;Hassan,P.A.;Manohar,C.;Salkar,R.A.;Kern,F.;Candau,S.J.Langmuir1998,14,4364.doi:10.1021/la971369d

