籃子魚內臟粗提液制備長心卡帕藻和細齒麒麟菜原生質體的初步研究
李俊鵬 ,劉建國龐 通李 虎
(1.中國科學院 海洋研究所 生物工程中心,山東 青島 266071;2.中國科學院大學,北京 100049)
卡帕藻屬和麒麟菜屬紅藻,其富含紅藻多糖卡拉膠,一直是生產卡拉膠的主要原料[1-3]。卡拉膠因其具有良好的凝膠性、保水性、增稠性和助懸性,在食品和化工中有著廣泛的應用[4-6],研究表明,麒麟菜類海藻還具有工業生產乙醇的潛質[7-10],此類產卡拉膠紅藻資源具有巨大開發價值。目前我國產卡拉膠紅藻的養殖規模相對較小[2-3,11],這與麒麟菜在20~30℃下生長有關[1,12-14],導致養殖區域受到限制,另外,其長期營養繁殖造成種質退化,產量和質量均下降,敵害、病害頻發[2]。因此,需要篩選和培育生長速率高、膠含量和質量好、抗病力強、耐低溫的麒麟菜,應對日益增長的養殖需要。
盡管麒麟菜理論上具有無性生殖和有性生殖世代,但通常難以獲得孢子和配子[2,15-16],通過有性生殖方式進行種苗繁育效率低,難度很大。運用細胞工程技術,進行麒麟菜的種苗繁育可以拓展拓寬新的途徑。而原生質體的獲得是進行細胞工程繁育,細胞融合等的重要前提,也為定向改良提供技術支撐。20世紀80年代,有關海藻原生質體研究有很多報道[17-22],但因諸多條件的限制,所制備原生質體效率都不高,大多未能用于海藻繁育的實際應用。近年來,Reedy[23]和 Yeong[24]分別制備出紫菜和江蘺的原生質體。Cheney[25]利用孢子制得原生質體,并通過細胞融合的方法獲得了麒麟菜細胞融合體,獲得了生長速率高的融合體植株。這為通過麒麟菜原生質體,進行遺傳選育,獲得目標株系提供借鑒。制備海藻原生質體,采用合適的酶是最關鍵的一環,Zablakis等[26]利用纖維素酶和卡拉膠酶混合酶液,酶解制備長心卡帕藻原生質體,但所用卡拉膠酶在很多國家均難以獲得。Salvador等[27]通過鮑魚內臟提取液獲得長心卡帕藻原生質體,觀察到細胞壁再生,但該方法在不同長心卡帕藻株系原生質體制備中的使用效果不一,差別很大。
本文采用熱帶海域廣泛分布的雜食性籃子魚為材料,從籃子魚內臟提取制備酶液,用于麒麟菜原生質體的分離,為后期的麒麟菜組織培養及細胞工程育種打下基礎。
1 材料與方法
1.1 實驗材料
本實驗采用 2種紅藻,棕黑色長心卡帕藻(Kappaphycus alvarezii),紅褐色細齒麒麟菜(Eucheuma denticulatum),上述海藻材料取自中國科學院海洋研究所海南陵水熱帶產卡拉膠海藻實驗基地(18°27′N,110°5′E);籃子魚(Siganus fuscessens)采于海南省陵水黎族自治縣黎安港灣,置于網箱中暫養,每天用長心卡帕藻和細齒麒麟菜喂養,籃子魚在飼喂 1周后,用于粗酶液的制備。
1.2 原生質體制備
1.2.1 粗酶解液的制備
取長心卡帕藻和細齒麒麟菜喂養籃子魚5~10只,飼喂 1周后取其胃和肝臟放入 4℃預冷的小燒杯中,按每克內臟加50 mmol/L pH為6.0的磷酸鈉鹽緩沖液20 mL,利用組織研磨器,充分研磨成漿。研磨后的勻漿分別用20、8和1 μm孔徑的濾紙分級過濾。向過濾后的濾液中添加0.6 mol/L甘露醇和5 mmol/L氯化鈣,冰浴保存備用。
1.2.2 材料準備
取生長狀態良好的上述紅藻,先用海水沖洗干凈,再用消毒海水反復洗滌多次,再用無菌紙巾吸干并轉入消毒液(100 mg氯霉素 + 200 mL無菌海水)中處理0.5~1.0 h。稱取10 g經過上述消毒的藻段,置于多功能料理機(九陽 JYL-CO20)中并加入 100 mL無菌海水,連續攪拌2次,每次1 min,以打碎藻段,靜止5 min后,棄去上清液(約100 mL),剩余底層的藻泥(約10 g)作為進一步酶解的材料,待用。
1.2.3 酶解與原生質體純化
取制取的上述酶液和藻泥按設定的比例(詳見1.2.4)加入10 mL的離心管中混勻,然后置于搖床(國華 ZD-85)上震蕩酶解,震蕩速度100 r/min,分別開展了不同酶解條件(詳見 1.2.4)下的酶解實驗,以每只上述離心管為一個單位酶反應體系。
酶解結束前,向酶解液中加入3 mL洗脫液,然后放回搖床繼續酶解1 h,選用500 μm的篩絹過濾酶解液,將濾液轉入離心管中,在相對離心力為218 g(湘儀 TGL-16M)的條件下離心5 min;吸取離心管中最上層的清液5 mL,并加入5 mL洗脫液(高壓蒸汽滅菌過的含有0.6 mol/L甘露醇和5 mmol/L氯化鈣PES培養基)混勻,在218 g離心力條件下離心5 min,棄上清,向離心管中加入1 mL洗脫液,然后轉入1.5 mL的離心管中。
1.2.4 酶解條件梯度實驗設計
實驗設置3個酶解濃度組合。酶濃度Ⅰ,0.1 g藻泥加3 mL酶液;酶濃度Ⅱ,0.2 g藻泥加3 mL酶液;酶濃度Ⅲ,0.4 g藻泥加3 mL酶液。酶解溫度25℃,酶解pH 6.0,酶液制備和酶解方法同前文所述,分別研究酶解(12,24,48 h)時,不同酶解濃度組合對其原生質體產量和產率的影響。
酶解溫度實驗設置3個梯度,分別為20,25和30℃,按照0.1 g藻泥加3 mL酶液的比例進行酶解,酶液制備和酶解方法如前文所述,酶解pH 6.0,期間利用搖床連續搖動,分別記錄12,24和48 h時溫度對原生質體產量和產率的作用效果。
酶解pH實驗設置3個梯度,分別為6.0,7.0和8.0,酶濃度選取0.1 g藻泥加3 mL酶液的比例,酶解溫度25℃,分別記錄酶解12,24和48 h時,不同pH對原生質體產量和產率的作用效果。
1.2.5 原生質體制備效果鑒定
1)原生質體去壁程度: 用蒸餾水處理待檢樣品,在顯徽鏡下觀察細胞大小的變化,細胞膨脹均勻,破碎后無細胞壁殘余,表明所制備的原生質體良好;若細胞單方向外漲至破碎,且脹碎后存在一定的細胞壁殘余,表明所制備的原生質體尚有細胞壁存在,原生質體制備不完全;若細胞不發生膨脹,細胞體積沒有變化,表明細胞壁依然完整,原生質體制備不成功。
2)原生質體完整性檢測: 向制備的原生質體中加入 0.5%伊文思藍染液染色,在顯微鏡下觀察原生質體色澤,并利用細胞計數板計數,統計獲得原生質體數目,其中細胞深色的為原生質體已經破損,顏色較淺的為完好的原生質體。
1.2.6 原生質體產量產率統計
原生質體產量監測用顯微鏡計數法,先以血球計數板計算出每毫升酶解液中原生質體數量,然后折算單位酶反應體系所獲得的原生質體的總數目;原生質體產率為每克藻泥獲得原生質體的數目,即原生質體產量除以實驗所用藻泥質量。
2 結果
2.1 兩種海藻原生質體產量和產率對比
對比2種藻原生質體的制備效果(圖1),得出:1)細齒麒麟菜比長心卡帕藻的原生質體制備效果更好,前者制備的原生質體產量和產率都明顯高于后者,統計分析效果顯著(P<0.01)。2)酶解時間延長有利于原生質體制備。其中,在0.1 g藻泥加3 mL酶液處理組,48 h酶解時間內,長心卡帕藻原生質體產量從 1.2 ×103cell上升到 1.45 ×103cell(圖 1.A),原生質體產率從 1.20 ×104cell/g 增加到 1.45×104cell/g(圖1.C);而細齒麒麟菜原生質體產量從 1.35×103cell到1.75×103cell(圖 1.A),其產率從 1.35×104cell/g 增加到1.75 ×104cell/g(圖1)。3)實驗中海藻用量對酶解效果也產生明顯影響,在等量酶濃度下,藻量越多,原生質體產量越高(圖1.A、B),而其產率卻越低(圖1.C、D)。其中,0.1 g的長心卡帕藻和細齒麒麟菜原生質體產量分別只有 1.45 ×103cell和 1.75×103cell(圖1.A)內,而0.4 g的長心卡帕藻和細齒麒麟菜原生質體產量分別達到3.83 ×103cell和4.15 ×103cell(圖1.B);相反,0.1 g的長心卡帕藻和細齒麒麟菜原生質體產率分別在 1.45 ×104cell/g 和 1.75×104cell/g (圖 1.C)范圍內,而0.4 g的長心卡帕藻和細齒麒麟菜原生質體產率只有0.96 ×104cell/g 和 1.04×104cell/g(圖 1.D)。
就獲得最大原生質體產量而言,可選擇的酶解條件: 25℃和pH 6.0,以及0.4 g藻泥加3 mL酶液,其酶解時間為48 h(圖1.B)。在此酶解條件下,細齒麒麟菜原生質體最大產量為4.15×103cell,而長心卡帕藻的原生質體最大產量可達到 3.8×103cell(圖1.B)。為得到最高原生質體產率,可選擇的酶解條件:25℃和pH 6.0,以及0.1 g藻泥加3 mL酶液,其酶解時間為48 h(圖1.C)。在此酶解條件下,細齒麒麟菜原生質體最高產率達到1.75×104cell/g,而長心卡帕藻的原生質體產率最高1.45×104cell/g(圖1.C)。
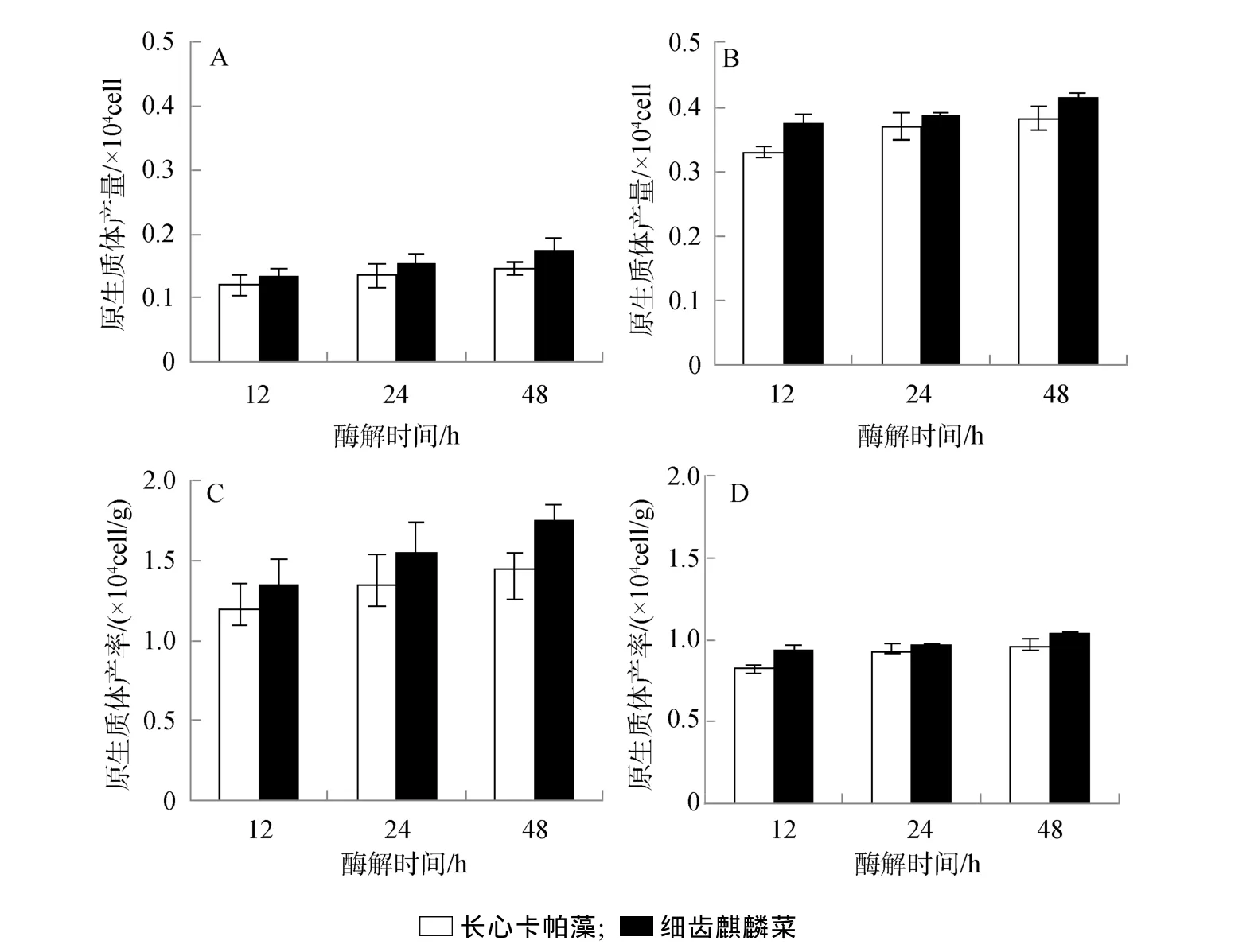
圖1 長心卡帕藻與細齒麒麟菜原生質體產量和產率對比Fig.1 The comparation between total protoplast yields and the relative protoplast yields of E.denticulatum and K.alvarezii
2.2 藻泥與酶濃度配比對原生質體制備的影響
不同藻泥與酶濃度配比對長心卡帕藻和細齒麒麟菜原生質體制備效果如圖2。結果表明: 2種海藻的原生質體制備效果與藻泥和酶濃度配比存在直接關系。在實驗酶濃度恒定和藻泥0.1~0.4 g范圍內,藻泥越多,所制備出的長心卡帕藻和細齒麒麟菜原生質體產量越多(圖 2.A、B),即 0.4 g > 0.2 g > 0.1 g 藻泥酶解處理組;但原生質體產率與藻泥用量呈負相關性,所用的藻泥越高,所制備的長心卡帕藻或細齒麒麟菜原生質體產率越低(圖2.C、D),即0.4 g <0.2 g < 0.1 g藻泥酶解處理組。上述結果與圖1結果一致,也進一步證實在等量酶濃度下,藻量越多,原生質體產量越高。
在實驗酶解時間范圍內,2種海藻原生質體與酶解時間存在一定相關性,隨著酶解時間延長,2種海藻原生質體呈增加趨勢,但其產量和產率增加幅度略有不同(圖2)。
2.3 pH對原生質體制備的影響
2種紅藻原生質體制備與酶解酸堿度變化關系如圖3所示。從中可以看出,pH對2種海藻原生質體制備存在一定程度的影響;總體而言,在弱堿性(pH8.0)條件下,無論長心卡帕藻還是細齒麒麟菜原生質體產量(圖3.A、B),還是其產率(圖3.C、D)均低于中性(pH7.0)和弱酸性(pH6.0)的效果(P<0.01);在中性(pH7.0)和弱酸性(pH6.0)條件下,2種海藻原生質體產量和產率基本一致,其中相對而言以弱酸性條件下酶解制備效果略高一點;隨著酶解時間延長,在3個實驗pH范圍內,原生質體產量和產率均呈明顯上升趨勢。
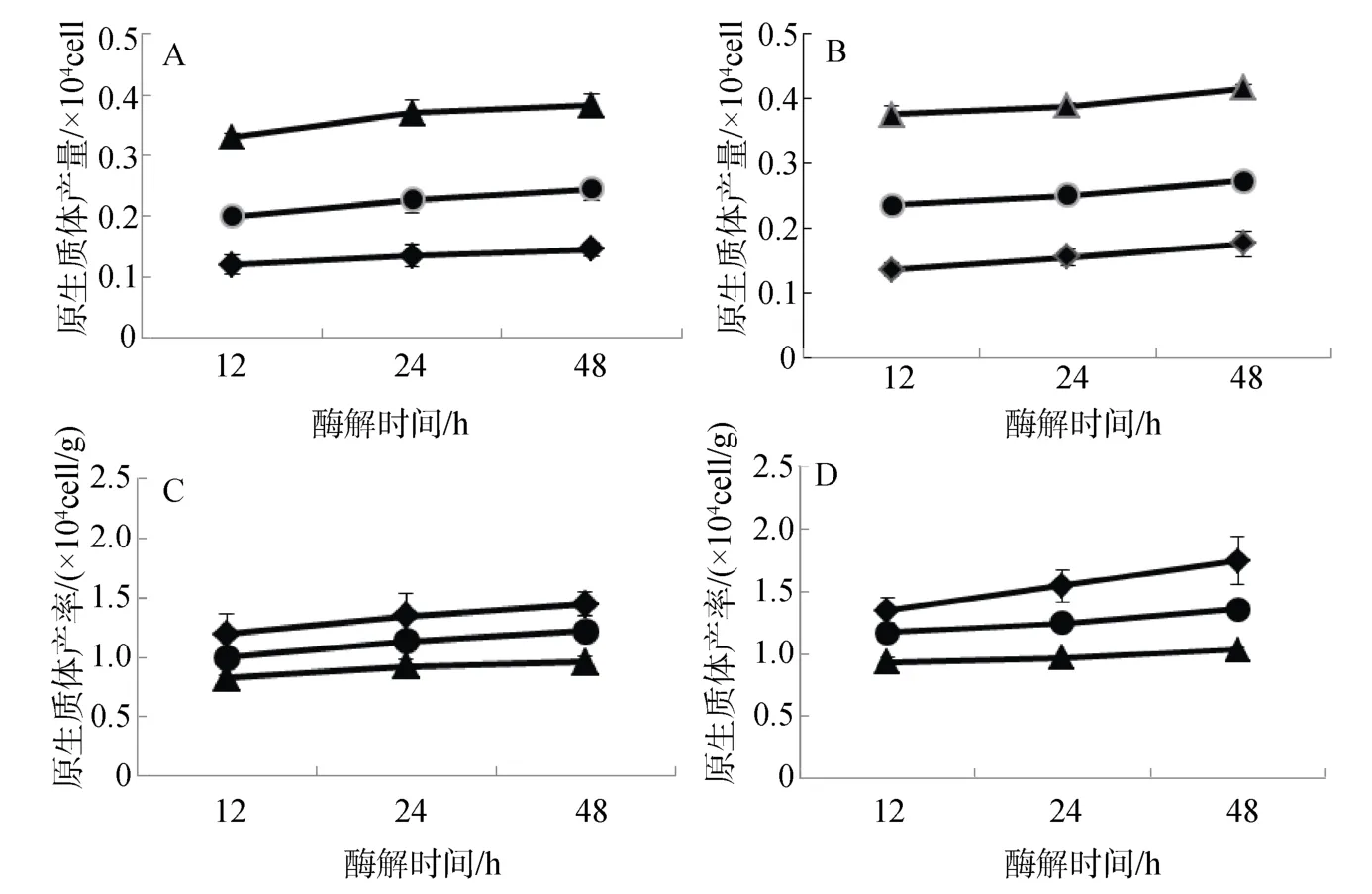
圖2 藻泥和酶濃度配比對長心卡帕藻(A、C)和細齒麒麟菜(B、D)原生質體制備的影響Fig.2 Effect of dosage of enzyme extract and algal pellets on protoplast isolation of K.alvarezii and E.denticulatum
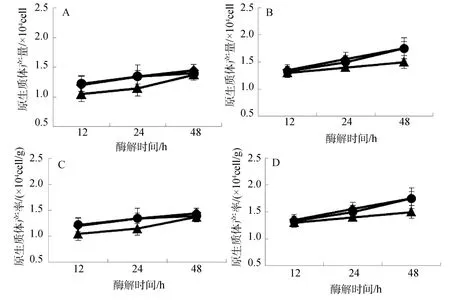
圖3 pH對長心卡帕藻(A、C)和細齒麒麟菜(B、D)原生質體制備的影響Fig.3 Effect of pH on protoplast isolation of K.alvarezii and E.denticulatum
2.4 溫度對原生質體制備的影響
長心卡帕藻和細齒麒麟菜原生質體制備與酶解溫度變化關系如圖4所示。結果表明: 酶解溫度對原生質體制備存在明顯影響,其中在25℃酶解條件下,兩種海藻的原生質體產量一般都顯著高于20℃和 30℃時的產量(圖 4.A、B,P<0.01);兩種海藻原生質體產率也隨酶解溫度變化,呈現與其原生質體產量相類似的結果(圖 4.C、D);同時,在三個酶解溫度梯度下,隨著酶解時間的延長,原生質體產量和產率均呈線性上升趨勢,并且以細齒麒麟菜在25℃酶解條件下原生質體產量和產率增幅最快(圖4.B、D)。
2.5 原生質體制備效果觀察
長心卡帕藻和細齒麒麟菜勻漿后的藻渣,經過籃子魚內臟研磨提取液酶解,2種海藻細胞壁都可被有效酶解,依據酶解程度不同,制備出的原生質體有完全游離的,也有部分原生質體尚殘存細胞壁(圖5.B、D),游離原生質體經依文思藍染色,可檢查其細胞完整性,其中結構完整的原生質體不能吸收依文思藍,不被染色(圖 5.E),而染色后原生質體深色的表明其結構已經受損,為不完整的破損原生質體(圖5.F)。
在不同酶解條件下,所獲得原生質體數目占藻細胞總數目比例依然較低,尚不足細胞總數的1%(圖6)。在實驗酶濃度恒定和0.1~0.4 g藻泥范圍內,藻泥越多,長心卡帕藻和細齒麒麟菜原生質體比例越低(圖6.A);在本實驗pH梯度范圍內,pH 8.0時長心卡帕藻和細齒麒麟菜原生質體比例都顯著低于 pH 6.0~7.0的酶解效果(P<0.01),pH 6.0~7.0的酶解條件下,2種藻的原生質體比例無顯著差異(圖6.B);25℃時2種藻的原生質體比例顯著高于20℃和30℃時(圖6.C);在48 h酶解時間內,長心卡帕藻原生質體隨時間延長逐漸升高(P<0.01),而細齒麒麟菜在48 h時的原生質體制備效率較比24 h略有下降(P>0.05)。
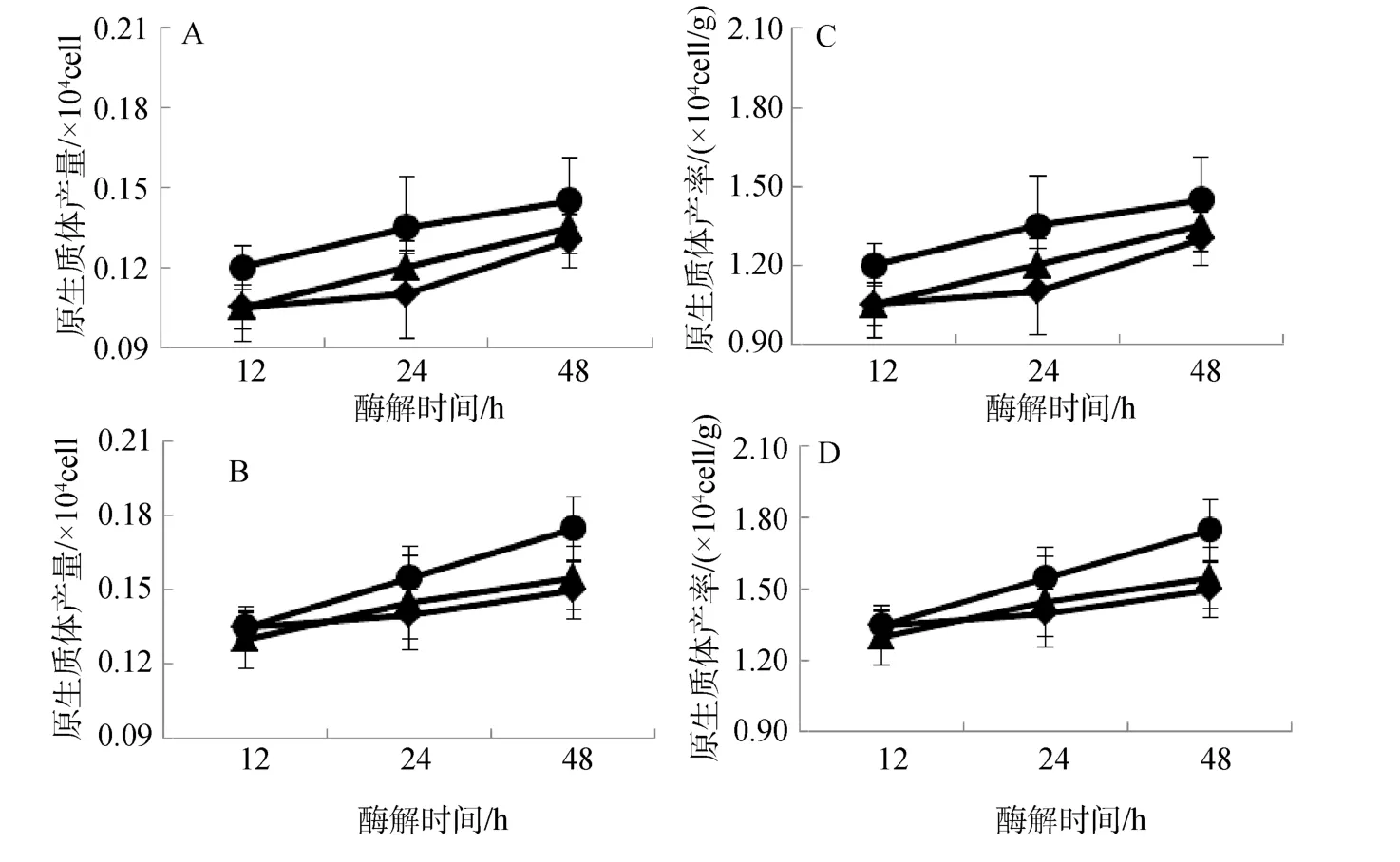
圖4 溫度對長心卡帕藻(A、C)和細齒麒麟菜(B、D)原生質體制備的影響Fig.4 Effect of temperature on protoplast isolation of K.alvarezii(A and C)and E.denticulatum(B and D)
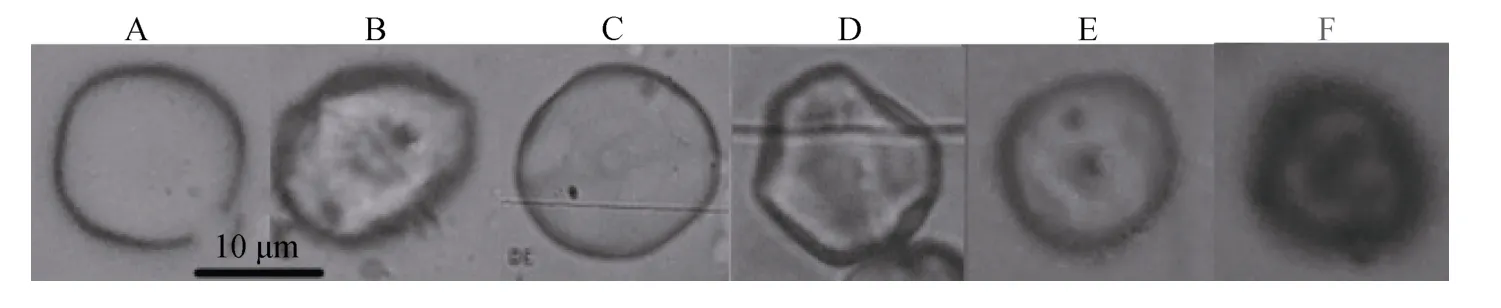
圖5 長心卡帕藻 (A、B)和細齒麒麟菜 (C、D)酶解制備原生質體效果Fig.5 Protoplast of K.alvarezii (A and B)and E.denticulatum (C and D)
圖6 不同酶解條件下原生質體占總細胞數的比例Fig.6 The proportion of protoplast number to total free cell
3 討論
對不同制備溫度(20~30℃)的試驗,25℃酶解所制備的原生質體產量顯著高于20℃和30℃酶解效果(圖3),這可能與籃子魚內臟研磨提取液在25℃時有更高的酶活性有關。基于此,我們在后續實驗中,可在22~28℃范圍內,優化酶解溫度。
在上述各實驗組的48 h酶解條件下,無論長心卡帕藻還是細齒麒麟菜的原生質體,其產量均隨酶解時間的延長而增加,至少在 48 h酶解條件下,籃子魚內臟粗提液仍具有酶的活性,延長酶解時間是否有效,有待后續深入研究。在3個酶解pH梯度實驗(圖4)中,pH 6.0時長心卡帕藻和細齒麒麟菜有更多原生質體的產出,間接證明其在pH 6.0時酶活性更好。
在藻泥與酶濃度配比實驗中,酶解體系中長心卡帕藻或細齒麒麟菜藻泥含量越高,所制備的原生質體產量越高,而其產率卻隨藻泥濃度增加而降低(圖 2);酶液用量較藻泥比率越高,原生質體產率越高(圖2)。基于飼喂籃子魚和從內臟中研磨提取酶沒有制備藻泥方便,因此,可采用適當增大藻泥質量并延長酶解時間,以有效提高原生質體產量。
在藻泥與酶濃度配比實驗中,酶解體系中長心卡帕藻或細齒麒麟菜藻泥含量越高,所制備的原生質體占總細胞數目的比例越低(圖6)。這與原生質體產量隨藻泥與酶濃度配比變化則相反,而與產率變化一致。由此可見,藻泥含量增大導致獲得的游離細胞總數目增多和原生質體數目增多,但其并沒有提高原生質體數目占總細胞數目的比例。在原生質體制備的溫度梯度(20~30℃)中,25℃酶解所制備的原生質體數目占總細胞數目的比例顯著高于 20℃和30℃酶解效果(圖 6,P<0.01),其與原生質體產量隨溫度變化規律相一致。2種藻原生質體占總細胞數目的比例隨pH變化規律與產量變化規律相似,pH為8.0時原生質體產量和原生質體所占的比例都低于pH為6.0和7.0時(圖3;圖6)。其可能是因為籃子魚內臟研磨提取液中的酶組分在弱堿性的環境中酶活力較低。2種藻原生質體產量都隨酶解時間延長而增加,其中長心卡帕藻原生質體占總細胞數目的比例隨時間變化規律與產量結果一致,但細齒麒麟菜在酶解 24 h以后,原生質體占總細胞數目的比例不再增加(圖 6.D),而僅僅是總的游離細胞數目增加導致原生質體產量的提高。
Salvador等[27]以鮑魚內臟提取液獲得長心卡帕藻原生質體,并在25℃和pH 6.1條件下,同樣按0.1 g海藻材料加3 mL酶液的比例酶解48 h時,獲得最高酶解效率,其最大原生質體產率為 8.2×103cell/g,這和我們的結果大致相同,所得提取液的效率(1.45×104Cell/g)的56%。Sahu等[28]將不同長心卡帕藻進行嫁接得到融合體植株,其生長速率更高,并且所產卡拉膠的黏度和強度都有提高。Cheney等[25]曾利用孢子制得紅藻原生質體,并通過細胞融合的方法獲得了江蘺細胞融合體,進而獲得了生長速率更高的融合體植株。
本研究籃子魚內臟粗提液酶解海藻藻泥的方法,成功制得了長心卡帕藻和細齒麒麟菜原生質體。同時,實驗測定的了幾種不同酶解條件對酶解反應的影響,建議按0.4 g藻泥中添加3 mL酶液的濃度配比,在25℃,pH 6.0的酶解條件下酶解48 h以更有效地獲得海藻原生質體。
[1]Ohno M,Largo D B,Ikumoto T.Growth-Rate,carrageenan yield and gel properties of cultured kappa-carrageenan producing red alga Kappaphycusalvarezii (doty)doty in the subtropical waters of shikoku,Japan[J].Journal of Applied Phycology,1994,6(1): 1-5.
[2]Ask E I,Azanza R V.Advances in cultivation technology of commercial eucheumatoid species: a review with suggestions for future research[J].Aquaculture,2002,206(3-4): 257-277.
[3]Bindu M S ,Levine I A.The commercial red seaweed Kappaphycus alvarezii-an overview on farming and environment[J].Journal of Applied Phycology,2011,23(4): 789-796.
[4]Tye R J.Industrial and non-fooduses for carrageenan[J].Carbohydrate Polymers,1989,10(4): 259-280.
[5]Tobacman J K,Wallace R B,Zimmerman M B.Consumption of carrageenan and other water-soluble polymers used as food additives and incidence of mammary carcinoma[J].Medical Hypotheses,2001,56(5): 589-598.
[6]Pedersen J K.Carrageenan - functional properties and application in food[J].Cereal Science Today,1974,19(10): 471-476.
[7]Khambhaty Y,Mody K,Gandhi M R,et al.Kappaphycus alvarezii as a source of bioethanol[J].Bioresource Technology,2012,103(1): 180-185.
[8]Meinita M D N,Hong Y K,Jeong G T.Comparison of sulfuric and hydrochloric acids as catalysts in hydrolysis of Kappaphycus alvarezii (cottonii)[J].Bioprocess and Biosystems Engineering,2012,35(1-2): 123-128.
[9]Kraan S.Mass-cultivation of carbohydrate rich macroalgae,a possible solution for sustainable biofuel productionl[J].Mitigation and Adaptation Strategies for Global Change,2010,18(1): 27-46.
[10]龐通,劉建國,林偉,等.藻類生物燃料乙醇制備的研究進展[J].漁業現代化,2012,39(5): 63-71.
[11]劉建國,龐通,王莉,等.導致熱帶產卡拉膠海藻大規模死亡原因分析與藻株抗病差異性比較[J].海洋與湖沼,2009,40(2): 235-241.
[12]Mairh O P,Soehtun U,Ohno M.Culture of Eucheuma striatum (rhodopyta,solieriaceae)in subtropical waters of shikoku,Japan[J].Botanica Marina,1986,29(2): 185-191.
[13]Glenn E P,Doty M S.Photosynthesis and respiration of the tropical red seaweeds,Eucheuma striatum (tambalang and elkhorn Varieties)and E.denticulatum[J].Aquatic Botany,1981,10(4): 353-364.
[14]AzanzaCorrales R,Aliaza T T,Montano E.Recruitment of Eucheuma and Kappaphycus on a farm in tawi-tawi,Philippines[J].Hydrobiologia,1996,327: 235-244.
[15]Dawes C J.Ecological-studies of floridian Eucheuma(rhodophyta,gigartinales).IV.seasonal biochemical variations and reproduction[J].Bulletin of Marine Science,1982,32(1): 237-242.
[16]Azanzacorrales R,Mamauag S S,Alfiler E,et al.Reproduction in Eucheuma-Denticulatum (burman)collins and hervey and Kappaphycus-alvarezii (doty)doty farmed in danajon reef,Philippines[J].Aquaculture,1992,103(1): 29-34.
[17]Araki T,Hayakawa M,Tamaru Y,et al.Isolation and regeneration of haploid protoplasts from Bangia-atropurpurea (rhodophyta)with marine bacterial enzymes[J].Journal of Phycology,1994,30(6): 1040-1046.
[18]Chen C S,Shyu J F.Regeneration of protoplasts from the brown alga,Endarachne-binghamiae (phaeophyta,punctariales,scytosiphonaceae)[J].Botanical Bulletin of Academia Sinica,1994,35(3): 189-193.
[19]Fujimura T,Kawai T,Kajiwara T,et al.Protoplast Isolation in the marine brown alga Dictyopteris prolifera(dictyotales)[J].Plant Cell Reports,1995,14(9): 571-574.
[20]Gross W.Preparation of protoplasts from the carrageenophyte Gigartina-corymbifera [J].Journal of Microb-iological Methods[J]1990,12(3-4): 217-223.
[21]Linz K W,Kohler K.Isolation of protoplasts from the coccal green-alga Eremosphaera-viridis debary for patch-clamp measurements[J].Botanica Acta,1993,106(6): 469-472.
[22]Mejjad M,Loiseauxdegoer S ,Ducreux G.Protoplast lsolation,development,and regeneration in different strains of Pilayellalittoralis (L)kjellm (Phaeophyceae)[J].Protoplasma,1992,169(1-2): 42-48.
[23]Reddy C R K,Gupta M K,Mantri V A,et al.Seaweed protoplasts: status,biotechnological perspectives and needs[J].Journal of Applied Phycology,2007,20(5): 619-632.
[24]Yeong H-Y,Khalid N,Phang S-M.Protoplast isolation and regeneration from Gracilaria changii (Gracilariales,Rhodophyta)[J].Journal of Applied Phycology,2008,20(5): 641-651.
[25]Cheney D,Rudolph B,Wang L Z,et al.New Developments in Marine Biotechnology [M].New York:Springer-Verlag New York Inc,1998: 101-104.
[26]Zablackis E,Vreeland V,Kloareg B.Isolation of protoplasts from Kappaphycus alvarezii var tambalang(rhodophyta)and secretion of iota-carrageenan fragments by cultured-cells[J].Journal of Experimental Botany,1993.44(266): 1515-1522.
[27]Salvador R C,Serrano A E.Isolation of protoplasts from tissue fragments of Philippine cultivars of Kappaphycus alvarezii (Solieriaceae,Rhodophyta)[J].Journal of Applied Phycology,2005.17(1): 15-22.
[28]Sahu N,Ganesan M,Eswaran K.Inter- and intrageneric grafting in seaweeds in the Indian coasts[J].Current Science,2010.99(2): 235-239.

