丁草胺污染對高產水稻土微生物區系的影響
張仕穎,夏運生,肖煒,崔曉龍,王永霞,史靜,張乃明*
1. 云南農業大學資源與環境學院,云南 昆明 650201;2. 云南大學云南省微生物研究所,云南 昆明 650091
云南永勝濤源鄉是保持我國水稻小面積超高產紀錄的特殊生態區。大量研究表明,這里不斷刷新的水稻高產紀錄得益于當地得天獨厚的自然生態條件(Ying等, 1998a;Ying等, 1998b;Katsura等, 2008;Li等, 2009),尤其是土壤微生物,在其中起到至關重要的作用(段紅平等,2007;李進學等,2007)。土壤微生物與土壤生態系統穩定性存在關聯(Tilman等, 1996;Griffiths等, 2000),并且具有改善土壤質量,提高生態系統生產力的功能(Aboim等, 2008),因此可將土壤微生物作為靈敏的反映指標,表征土壤質量的演變趨勢(張乃明,2013)。丁草胺是亞洲應用最廣泛的苯乙酰胺類除草劑(Kumari等, 2009),與乙草胺和草甘膦并稱我國三大除草劑(Xu等, 2005)。丁草胺主要應用于水稻田,對禾本科雜草有較好的防除效果,但由于使用量大,且直接毒土,不可避免地會在土壤和環境中殘留,破壞土壤微生物群落結構,影響水稻產量(余保文和朱誠,2008;韓玉軍和趙長山,2012)。濤源特殊生態區常年使用丁草胺作為水稻選擇性芽前除草劑,大量施用的除草劑究竟會對土壤微生物群落結構造成多大影響成為研究者關注的焦點。目前關于丁草胺對普通水稻土微生物區系影響的研究較多(Min等, 2001;Suseela, 2001;Chen等,2009),但針對高產水稻土僅見從微生物功能多樣性角度探索的相關報道(張仕穎等,2013)。本研究重點關注土壤微生物3大類群和3類常見有益功能微生物,探討模擬條件下丁草胺對高產水稻土微生物區系的影響,可為系統評價丁草胺的生態毒理效應提供基礎研究資料。
1 材料與方法
1.1 供試藥品
50%丁草胺乳油,上海升聯化工有限公司生產,農藥登記號:D20091403,產品標準號:HG 3292—2001;施用方法:藥土法。
1.2 土壤含水量測定
稱取30~40 g(精確到0.01 g)新鮮土樣置于培養皿中,放入110 ℃烘箱烘烤6 h,取出稱質量;之后重新放回烘箱繼續烘烤,每隔30 min重復稱質量一次,直至恒質量,設置3個重復。土壤含水量計算公式為:

其中:m0表示烘干前樣品質量,g;m1表示烘干后樣品質量,g;wH2O表示土壤含水量(質量分數,%)。
1.3 丁草胺處理
丁草胺的合理施用標準為有效成分濃度747~1278 g·hm-2(國家質量技術監督局,2002),折算合每千克干土 0.216~0.370 mg,本研究取中間質量分數0.30 mg·kg-1作為100%推薦劑量。稱取相當于500 g干質量的新鮮土樣,加入超純水使其含水量為田間最大持水量的 60%,在室內模擬條件下,添加以超純水稀釋的丁草胺乳油,使其在土樣中的有效成分質量分數分別為 50%推薦劑量(0.15 mg·kg-1,簡稱 B15)、100%推薦劑量(0.30 mg·kg-1,簡稱 B30)和 500%推薦劑量(1.5 mg·kg-1,簡稱B150),攪拌均勻,另設不加丁草胺的處理為對照(0 mg·kg-1,簡稱CK),每個處理3個重復。所有處理密封,置于恒溫培養箱(25±1)℃中避光培養,于藥劑處理后7、15、30、45 d取樣測定,每隔2~3 d用差減法補充水分以調節含水量,供試土壤有機質質量分數為17.89 g·kg-1,全氮質量分數為 1.30 g·kg-1,全磷質量分數為 0.67 g·kg-1,堿解氮質量分數為101.65 mg·kg-1,有效磷質量分數為55.80 mg·kg-1,速效鉀質量分數為 142.91 mg·kg-1,pH 7.84。
1.4 樣品測定方法
分離好氧細菌(aerobic bacteria)使用牛肉膏蛋白胨培養基、真菌(fungi)使用馬丁氏培養基、放線菌(actinobacteria)使用高氏一號培養基,分離自生固氮菌(nitrogen fixing bacteria)使用 Ashby無氮培養基、磷酸鹽溶解菌(phosphate solubilizing bacteria)使用無機磷細菌培養基、硅酸鹽細菌(silicate dissolving bacteria)使用硅酸鹽細菌培養基(國家質量技術監督局,2006;鐘傳青,2004),所有培養基均調節至pH 7.5~8.0。
1.5 數據處理
試驗數據使用SPSS 17.0軟件處理,采用單因素(one way ANOVA)方差分析和LSD法進行多重比較(P<0.05)。
2 結果與分析
2.1 丁草胺對好氧細菌數量的影響
從圖1可以看出,不同施藥濃度對好氧細菌生長和增殖產生的影響不完全相同。施藥7 d,100%和 500%推薦劑量表現出明顯的刺激促生長作用,B30和B150的好氧細菌數量均與CK達到顯著差異,比CK分別高出78.6%和153.8%;施藥15 d和30 d,B30和B150的好氧細菌數量迅速下降至CK以下,表現出抑制好氧細菌生長和增殖的態勢;施藥45 d,抑制作用進一步加強,B30和B150的好氧細菌數量已經顯著低于 CK;此外,50%推薦劑量B15的好氧細菌數量則變化不大,4個取樣時間點數據均顯示與CK基本保持在同一水平,沒有出現明顯的波動。縱觀整個丁草胺處理時期,中、高濃度丁草胺對土壤好氧細菌的生長和增殖表現出先促進后抑制的作用,低劑量丁草胺對好氧細菌生長則沒有太大影響。
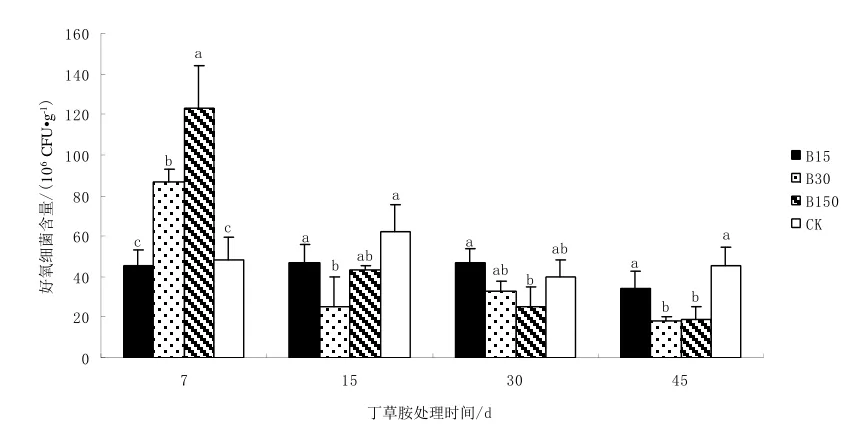
圖1 不同濃度丁草胺對好氧細菌數量的影響Fig. 1 Effect of different concentration of butachlor on bacteria number
2.2 丁草胺對放線菌數量的影響
從圖2可以看出,施藥7 d,B150表現出明顯的刺激促生長作用,其放線菌數量顯著高于 CK,差值達到75.1%,B15和B30則表現出明顯的抑制作用,其放線菌數量顯著低于 CK,差值分別達到74.5%和69.1%;施藥15 d,B150的刺激作用和B15的抑制作用明顯減弱,恢復到與CK相當水平,B30則表現出對放線菌生長明顯的刺激作用,其放線菌數量比CK高出125.0%,達到顯著差異;之后所有丁草胺處理的放線菌數量均保持在顯著低于CK的水平,表現出明顯的抑制作用。縱觀整個丁草胺處理時期,中高濃度丁草胺對放線菌的生長有明顯的刺激作用,丁草胺濃度越高,刺激作用表現得越快越明顯,之后隨著丁草胺的自然降解,刺激作用逐漸轉化為抑制作用,低濃度丁草胺對放線菌生長則主要表現為抑制作用。
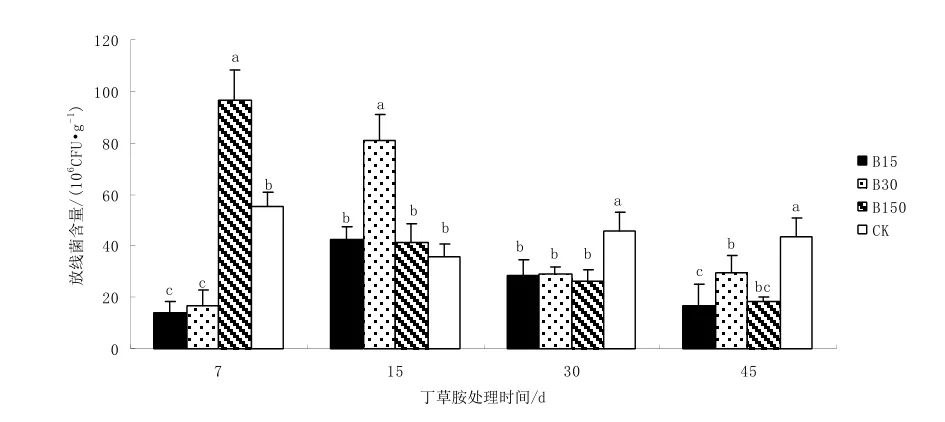
圖2 不同濃度丁草胺對放線菌數量的影響Fig. 2 Effect of different concentration of butachlor on actinomyces number
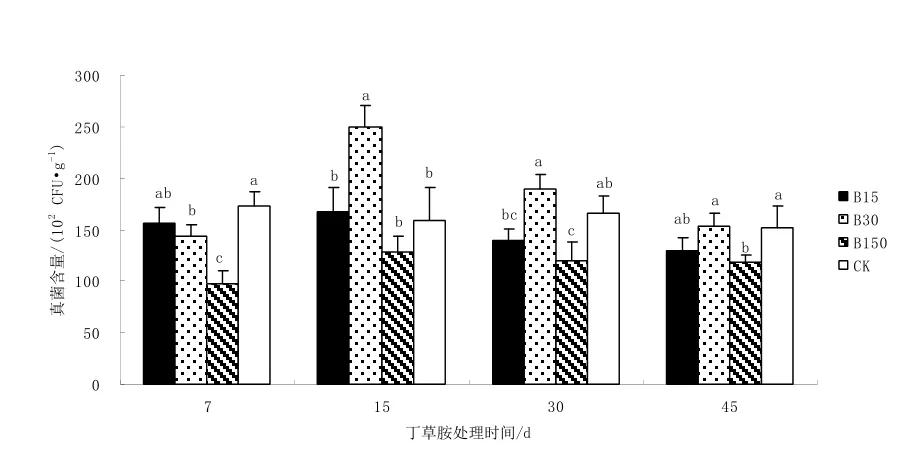
圖3 不同濃度丁草胺對真菌數量的影響Fig. 3 Effect of different concentration of butachlor on fungi number
2.3 丁草胺對真菌數量的影響
從圖3可以看出,不同濃度丁草胺對真菌生長的影響不同。施藥7 d,B30和B150顯著低于CK,表現出明顯的抑制作用,其真菌數量分別比CK低16.8%和43.6%;施藥15 d,B30的真菌數量顯著提高,超過CK56.9%,其余2個處理則與CK沒有顯著差異;施藥30和45 d,B15和B30的真菌數量與CK處在同一水平,沒有明顯差異,B150則顯著低于CK,30 d時比CK低27.8%,45 d時比CK低22.7%。縱觀整個丁草胺處理時期,低濃度丁草胺B15對土壤真菌的生長和增殖基本沒有影響,中等濃度B30則表現為先抑制后刺激的作用,隨著丁草胺的自然降解,抑制和刺激作用都會消失,其真菌數量可恢復到CK水平;高濃度丁草胺B150則始終表現為抑制作用,其真菌數量與CK之間存在明顯差異。
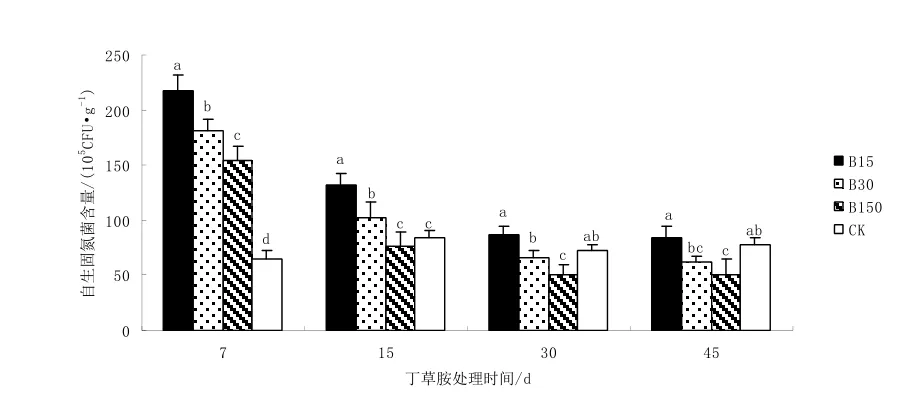
圖4 不同濃度丁草胺對自生固氮菌數量的影響Fig. 4 Effect of different concentration of butachlor on nitrogen-fixingbacteria number
2.4 丁草胺對自生固氮菌數量的影響
從圖 4可以看出,不同劑量丁草胺施入土壤對自生固氮菌均表現為先刺激、后抑制的作用。施藥7 d,所有丁草胺處理自生固氮菌數量均顯著高于對照,B15、B30和 B150比 CK分別高出237.1%,179.9%和138.1%,刺激作用顯著。施藥15 d,中低劑量處理自生固氮菌數量仍顯著高于CK,但刺激作用明顯減弱,B15和 B30分別比CK高出55.9%和20.9%,B150自生固氮菌數量則下降至與CK無顯著差異,高劑量刺激作用消失。施藥30 d,B15和B30自生固氮菌數量繼續下降,與CK無顯著差異,B150則繼續下降至CK以下29.6%,達到差異顯著,此時中低劑量丁草胺對自生固氮菌的促生長作用已消失,高劑量則表現出對自生固氮菌的抑制作用。施藥45 d,基本情況與30 d時相似,中高劑量處理自生固氮菌數量進一步減少,B30和 B150比 CK分別低 20.5%和35.9%,抑制作用進一步加強。
2.5 丁草胺對磷酸鹽溶解菌數量的影響

圖5 不同濃度丁草胺對磷酸鹽溶解菌數量的影響Fig. 5 Effect of different concentration of butachlor on phosphate solubilizing bacteria number

圖6 不同濃度丁草胺對硅酸鹽細菌數量的影響Fig. 6 Effect of different concentration of butachlor on silicate dissolving bacteria number
從圖5可以看出,不同濃度丁草胺施入土壤會對磷酸鹽溶解菌表現出不同程度的抑制作用。縱觀整個丁草胺處理時期,500%推薦劑量B150的磷酸鹽溶解菌數量始終處于一個較低的水平,磷酸鹽溶解菌的生長和增殖受到強烈抑制;100%推薦劑量B30的磷酸鹽溶解菌數量也始終顯著低于 CK,但其抑制強度遠不及 B150處理明顯;50%推薦劑量B15對磷酸鹽溶解菌則表現出微弱的抑制作用,雖然其磷酸鹽溶解菌數量在整個丁草胺處理時期均低于 CK,但都未達到顯著差異。可見施用丁草胺會對高產水稻土磷酸鹽溶解菌群落產生不利影響,能夠抑制磷酸鹽溶解菌的生長和增殖,且丁草胺濃度越高,抑制作用越明顯。
2.6 丁草胺對硅酸鹽細菌數量的影響
從圖6可以看出,丁草胺濃度不同,對硅酸鹽細菌數量的影響也不同。縱觀整個丁草胺處理時期,50%推薦劑量B15的硅酸鹽細菌數量在施藥7 d時有一小幅增加,之后基本保持穩定,但4次取樣均未與CK達到顯著差異;100%推薦劑量B30和500%推薦劑量 B150的硅酸鹽細菌數量則始終與CK保持顯著差異,B30的硅酸鹽細菌數量在4個取樣時間點基本保持恒定,B150則在施藥7和15 d時較低,分別比CK低60.7%和58.1%,到施藥30 d后達到一個相對穩定的狀況。可見高產水稻土的硅酸鹽細菌數量與丁草胺的施用濃度密切相關,低濃度對硅酸鹽細菌影響不明顯,中高濃度對硅酸鹽細菌有抑制作用,且在丁草胺達到半衰期之前,濃度越高,抑制作用越明顯。
3 討論
由于丁草胺應用范圍廣、使用量大,對土壤環境的影響較為直接,目前國內外也有一些關于施用丁草胺后對土壤微生物區系影響的相關報道。在三大微生物數量方面,Min發現施用不同濃度丁草胺后,土壤放線菌數量顯著下降,細菌和真菌數量上升,22 mg·kg-1高質量分數丁草胺可導致真菌生長遲滯(Min等, 2001);單敏發現10 mg·kg-1高質量分數下細菌、真菌和放線菌均受到抑制,2~4 mg·kg-1丁草胺對放線菌生長有刺激作用(單敏等,2005);趙蘭則發現低濃度對細菌有刺激作用,20 mg·kg-1高質量分數對放線菌有抑制作用,各濃度處理對真菌均表現為先抑制后刺激(趙蘭和黎華壽,2008)。在功能微生物數量方面,施用丁草胺可影響解磷微生物的生長和活性(Dennath等, 2002),刺激水解發酵性細菌(Min等, 2001)、硫酸鹽還原細菌(Min等, 2001;陳中云等,2004)和反硝化細菌(Min等, 2001;陳中云等,2003a)生長,抑制產氫產乙酸細菌(Min等, 2001)生長,對甲烷產生菌的影響則與濃度相關,低濃度加速生長,高濃度抑制生長,施藥7 d時抑制作用最大(Min等, 2001;陳中云等,2003b)。此外,研究者還通過乙炔還原法和液體培養最大或然計數法測定了水稻土中厭氧固氮菌和反硝化細菌的數量,發現施用丁草胺后可加強微生物群落的固氮作用(Min等, 2001;Suseela, 2001;Chen等, 2009)和反硝化作用(Min等, 2001)。雖然研究者采用不同濃度組合進行模擬試驗,但結果仍有共性,綜合前人和本研究結果可以發現,施用丁草胺會對土壤微生物區系造成影響,影響方向和影響程度與微生物種類和丁草胺濃度密切相關。
平板培養法是微生物研究中最經典也最行之有效的方法之一,其優勢在于可獲得微生物純菌株,并可計算自然樣品中可培養的活的微生物數目,在研究微生物種群結構、生理生化特性、遺傳育種以及開發利用微生物資源方面具有不可取代的重要地位。因此,即使在分子生物學手段日新月異的今天,對自然界微生物的研究依舊離不開傳統的平板培養手段。但同時必須指出,平板培養法的培養條件系人為限定,常會因為營養條件的原因造成某些微生物的富集生長和另一些微生物的缺失,在一定程度上影響著對微生物群落結構評價的準確性,且自然界能夠被培養的微生物一般只占微生物總量的1%~10%(Daniel, 2005;Torsvik和Ovreas,2002),絕大數微生物可以在自然環境中存在,卻無法在人工條件下生長(張洪勛等,2003),因此還需結合其它生物技術方能客觀而全面地反映微生物群落的真實信息(孔維棟等,2004)。
4 結論
本研究通過分析模擬條件下丁草胺污染對高產水稻土微生物區系的影響,得到以下結論。
1)中高濃度丁草胺對好氧細菌具有先刺激生長、后抑制活性的作用,低濃度丁草胺對好氧細菌的生長和增殖影響不明顯。
2)中高濃度丁草胺對放線菌有刺激作用,且濃度越高,刺激作用表現得越快越明顯,低濃度丁草胺對放線菌則主要表現為抑制作用。
3)低濃度丁草胺對真菌的生長和增殖基本沒有影響,中等濃度有先抑制后刺激的作用,高濃度丁草胺則始終表現為對真菌的抑制作用。
4)不同濃度處理丁草胺均能刺激自生固氮菌的數量顯著增加,但隨著培養時間延長,高濃度開始表現出抑制作用。
5)不同濃度丁草胺均能抑制磷酸鹽溶解菌的生長和增殖,且丁草胺濃度越高,抑制作用越明顯。
6)低濃度丁草胺對硅酸鹽細菌的數量影響不明顯,中高濃度則對其有抑制作用,且濃度越高抑制作用越明顯。
ABOIM M C R, COUTINHO H L C, PEIXOTO R S, et al. 2008. Soil bacterial community structure and soil quality in a slash-and-burn cultivation system in Southeastern Brazil[J]. Applied Soil Ecology, 38(2): 100-108.
CHEN W C, YEN J H, CHANG C S, et al. 2009. Effects of herbicide butachlor on soil microorganisms and on nitrogen-fixing abilities in paddy soil[J]. Ecotoxicology and environmental safety, 72(1): 120-127.
DANIEL R. 2005. The meta genomics of soil[J]. Nature Reviews Microbiology, 3: 470-478.
DENNATH A, DAS A C, MUKHERJEE D. 2002. Persistence and effect of butachlor and basalin on the activities of phosphate solubilizing microorganisms in wetland rice soil[J]. Bulletin of environmental contamination and toxicology, 68(5): 766-770.
GRIFFITHS B S, RITZ K, BARDGETT R D, et al. 2000. Ecosystem response of pasture soil communities to fumigation-induced microbial diversity reductions: an examination of the biodiversity ecosystem function relationship[J]. Oikos, 90(2): 279-294.
KATSURA K, MAEDA S, LUBIS I, et al. 2008. The high yield of irrigated rice in Yunnan China: a cross-location analysis[J]. Field Crops Research, 107: 1-11.
KUMARI N, NARAYAN O P, RAI L C. 2009. Understanding butachlor toxicity inAulosira fertilissimausing physiological,biochemical and proteomic approaches[J]. Chemosphere, 77(11): 1501-1507.
LI G, XUE L, GU W, et al. 2009. Comparison of yield components and plant type characteristics of high-yield rice between Taoyuan, a‘special eco-site’ and Nanjing, China[J]. Field Crops Research, 112:214–221.
MIN H, YE Y F, CHEN Z Y, et al. 2001. Effects of butachlor on microbial populations and enzyme activities in paddy soil[J]. Journal of environmental science and health Part B, 36: 581-595.
SUSEELA M. 2001. Effect of but achlor on growth and nitrogen xation by Anabaena sphaerical[J]. Journal of environmental biology, 22(3):201-203.
TILMAN D, WEDIN D, KNOPS J. 1996. Productivity and sustainability influenced by biodiversity in grassland ecosystems[J]. Nature, 379:718-720.
TORSVIK V, OVREAS L. 2002. Microbial diversity and function in soil:from genes to ecosystems[J]. Current Opinion Microbiology, 5:240-245.
XU D P, XU Z H, ZHU S Q, et al. 2005. Adsorption behavior of herbicide butachlor on typical soils in China and humic acids from the soil samples[J]. Journal of Colloid and Interface Science, 285: 27-32.
YING J, PENG S, YANG G, et al. 1998b. Comparison of high-yield rice in tropical and subtropical environments.II. nitrogen accumulation and utilization efficiency[J]. Field Crops Research, 57: 85-93.
YING J, PENG S, YANG G, et al.1998a. Comparison of high-yield rice in tropical and subtropical environments.I.Determinations of grain and dry matter yields[J]. Field Crops Research, 57: 71-84.
陳中云, 閔航, 吳偉祥, 等. 2003a. 農藥污染對水稻田土壤反硝化細菌種群數量及其活性的影響[J]. 應用生態學報, 14(10): 1765-1769.
陳中云, 閔航, 吳偉祥. 2003b. 農藥污染對黃松稻田土壤產甲烷菌數量和甲烷排放通量影響的研究[J]. 中國沼氣, 21(1): 18-21.
陳中云, 閔航, 張夫道, 等. 2004. 農藥污染對水稻田土壤硫酸鹽還原菌種群數量及其活性影響的研究[J]. 土壤學報, 41(1): 97-102.
單敏, 虞云龍, 方華, 等. 2005. 丁草胺對土壤微生物數量和酶活性的影響[J]. 農藥學學報, 7(4): 383-386.
段紅平, 張乃明, 李進學, 等. 2007. 超高產水稻根際微生物類群數量初探[J]. 中國農學通報, 23(2): 285-289.
國家質量技術監督局. 2002. GB/T 8321.1—2000 農藥合理使用準則(一)[S]. 北京: 中國標準出版社.
國家質量技術監督局. 2006. NY/T 1114—2006, 微生物肥料實驗用培養基技術條件[S]. 北京: 中國標準出版社.
韓玉軍, 趙長山. 2012. 淹水脅迫下水稻幼苗對丁草胺的生理響應[J].作物雜志, (5): 86-90.
孔維棟, 朱永官, 傅伯杰, 等. 2004. 農業土壤微生物基因與群落多樣性研究進展[J]. 生態學報, 24(12): 2894-2900.
李進學, 段紅平, 張乃明, 等. 2007. 不同生態區水稻根際微生物數量分析[J]. 耕作與栽培, 1: 3-5, 26.
余保文, 朱誠. 2008. 丁草胺對鎘脅迫條件下水稻生長、鎘積累及活性氧代謝的影響[J]. 環境科學學報, 28(9):1878-1886.
張洪勛, 王曉誼, 齊鴻雁. 2003. 微生物生態學研究方法進展[J]. 生態學報, 23(5): 988-955.
張乃明. 2013. 環境土壤學[M]. 北京: 中國農業大學出版社: 56-62.
張仕穎, 夏運生, 肖煒, 等. 2013. 除草劑丁草胺對高產水稻土微生物群落功能多樣性的影響[J]. 生態環境學報, 22(5):815-819.
趙蘭, 黎華壽. 2008. 四種除草劑對稻田土壤微生物類群的影響[J]. 農業環境科學學報, 27(2): 508-514.
鐘傳青. 2004. 解磷微生物溶解磷礦粉和土壤難溶磷的特性及其溶磷方式研究[D]. 南京: 南京農業大學.

