大花蕙蘭原球莖快速繁殖條件的優化
曾楨迦,李芳,賈黃,肖小君,2,傅慧
(1.內江師范學院生命科學學院,四川內江641100;2.四川省高等學校特色農業資源研究與利用重點實驗室,四川內江641100)
大花蕙蘭原球莖快速繁殖條件的優化
曾楨迦1,李芳1,賈黃1,肖小君1,2,傅慧1
(1.內江師范學院生命科學學院,四川內江641100;2.四川省高等學校特色農業資源研究與利用重點實驗室,四川內江641100)
以大花蕙蘭原球莖(PLB)為試驗材料,比較不同濃度植物激素6-BA(6-芐氨基腺嘌呤)、NAA(萘乙酸),AC(活性炭),有機添加物(香蕉汁)及不同培養方式(固體培養、液體培養)等因子對大花蕙蘭原球莖增殖效果的影響.結果表明:大花蕙蘭PLB增殖以MS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1mg/L結合液體振蕩的培養方式效果較好,培養基中添加100 g/L香蕉汁對大花蕙蘭PLB的增殖具有顯著的促進作用.
大花蕙蘭;原球莖;增殖;優化
大花蕙蘭(Cymbidium hybridum),又稱虎頭蘭、西姆比蘭,是蘭科蘭屬植物中大花型附生種類的雜交種.其花大,花多,花型規整豐滿,色澤艷麗,花莖直立,花期長,生長健壯,栽培容易,近年來種植極為流行,進口品種在中國的蘭花市場上獨領風騷[1].大花蕙蘭多為雜交品種,其種子繁殖一般無法保持品種特性,結實率相當低,分株能力弱[2],繁殖系數低,繁殖速度也比較慢[3],還容易引起退化,遠不能滿足大花蕙蘭商品化生產的要求[4].與其他蘭花組織培養一樣,大花蕙蘭主要也是通過誘導形成原球莖(PLB)再擴繁建立繁殖體系[5],因此,快速增殖原球莖并誘導分化成苗是實現大花蕙蘭工廠化生產的關鍵[6].本試驗探討了不同濃度的植物激素(6-BA、NAA)、活性炭、有機添加物(香蕉汁)及不同培養方式(固體培養、液體培養)等因子對大花蕙蘭原球莖增殖的影響,為大花蕙蘭商品開發與利用提供科學依據和參考,以達到降低成本、提高經濟效益的目的.
1 材料與方法
1.1 材料
選用長勢一致、品名為“火炬”的大花蕙蘭原球莖(由內江師范學院生命科學學院植物組織培養室提供).
1.2 方法
1.2.1 大花蕙蘭原球莖增殖培養的激素濃度篩選
以MS作為基礎培養基,采用3因素3水平正交試驗設計方案(見表1),選取生長健壯、大小一致的原球莖切成直徑5mm左右接入9種培養基中,每種培養基中均加入蔗糖30 g/L,瓊脂條7 g/L,pH為5.8左右,其中每個配方接種6瓶,每瓶接種5個原球莖.
培養條件:白天24℃、夜間20℃左右,光照時間為13.5 h/d,光照強度為2 000 lx,室內的通氣條件良好,每周觀察原球莖的生長情況,40 d后統計增殖后總芽數、增殖倍數及生長狀態.
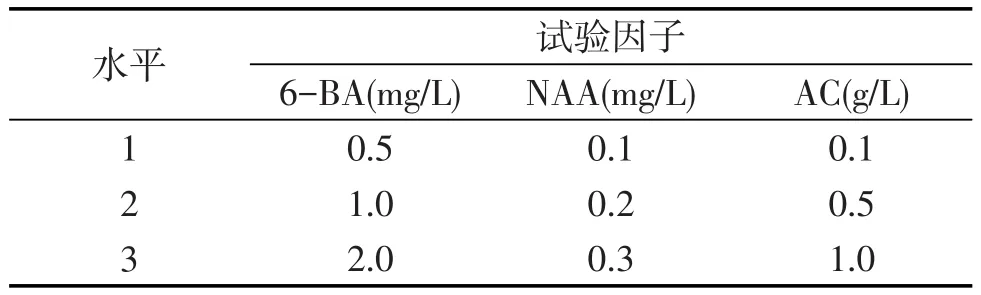
表1 大花蕙蘭原球莖增殖正交試驗設計
1.2.2 有機添加物對大花蕙蘭原球莖增殖效果的影響
選取方法1.2.1中最佳的大花蕙蘭原球莖增殖培養基作為對照,在培養基中添加不同濃度梯度香蕉汁(50 g/L、100 g/L、150 g/L),接種方法和培養條件與1.2.1相同.40 d后觀察增殖的情況,統計大花蕙蘭原球莖增殖總數、增殖倍數及長勢情況.
1.2.3 不同培養方式對原球莖增殖生長的影響
選取方法1.2.1中最佳的大花蕙蘭原球莖增殖配方作為基本培養基,在固體培養方式中接入質量為6.47 g的原球莖,在液體培養方式中接入質量為8.71 g原球莖,每個培養瓶中加入培養基50mL.每處理接種6瓶作為重復,培養40 d后統計原球莖增殖和生長情況.液體振蕩培養的轉數為100 r/min,培養條件為溫度22℃,相對濕度70%~80%,光照強度2 000 lx,每天光照16 h.
2 試驗結果與分析
2.1 不同激素濃度配比對大花蕙蘭原球莖增殖的影響
經過觀察,原球莖在接種2周后,1號、6號和8號培養基相繼出現小的瘤狀愈傷組織,原球莖顏色較淺,呈橢圓瘤狀,3周之后,原球莖的顏色漸漸從黃綠變為淡綠色,40 d后新生的原球莖充分成熟,顏色轉為深綠色.其中2號、3號和5號培養基中原球莖出現少量的黃化現象,3號有幾顆原球莖出現芽化情況.表2為不同激素配比對大花蕙蘭原球莖增殖的影響.
由表2可知,隨著6-BA濃度的增大,原球莖增殖總數和增殖倍數也隨著增高,在6-BA為2.0mg/L時達到最大,以MS+6-BA 2.0mg/L+NAA 0.2mg/L+ AC 0.1 g/L的組合生長狀況最好,增殖總數為116個,增值倍數為3.87,原球莖生長健壯,顏色濃綠,長勢強.適量的NAA有利于原球莖增殖,以0.2mg/L最佳,當NAA的濃度繼續增加時,會抑制原球莖的增殖,且長勢不好,說明較高濃度的6-BA與低濃度NAA配比,適合大花蕙蘭的原球莖增殖.同時發現,添加適量的活性炭可有效抑制原球莖增殖過程中產生褐化.
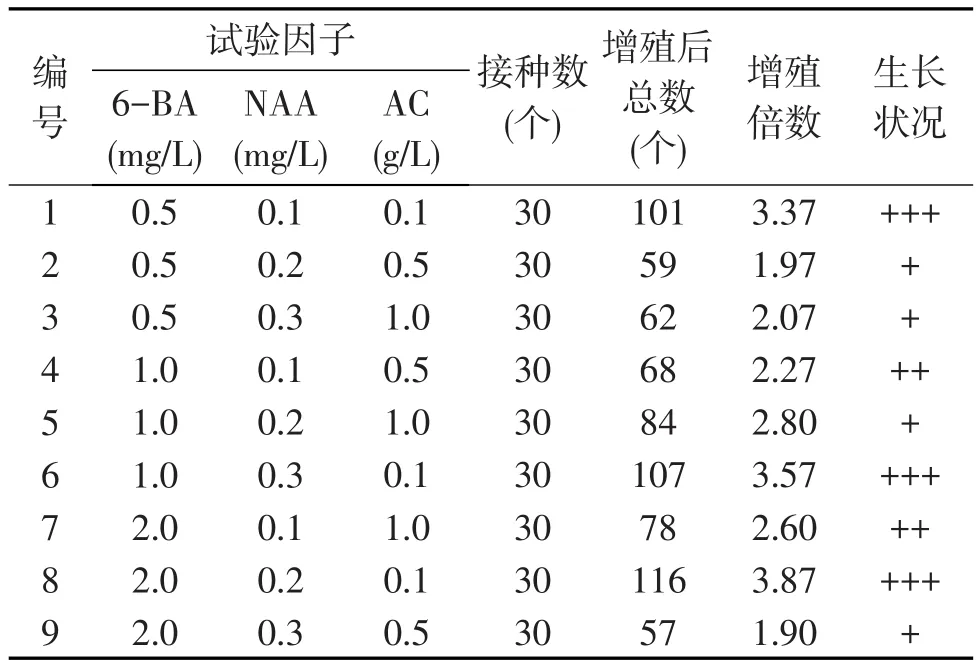
表2 不同激素配比對大花蕙蘭原球莖增殖的影響
2.2 有機添加物對大花蕙蘭原球莖增殖的影響
由表3可以看出,在MS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1 g/L培養基中,添加香蕉汁均有利于大花蕙蘭原球莖的增殖,其中添加100 g/L的香蕉汁增殖效果最為明顯,主要表現為原球莖顏色濃綠,生長健壯,長勢強,當香蕉汁的濃度為150 g/L時,生長一段時間后就會長出大量的根,對生根有明顯的促進作用.
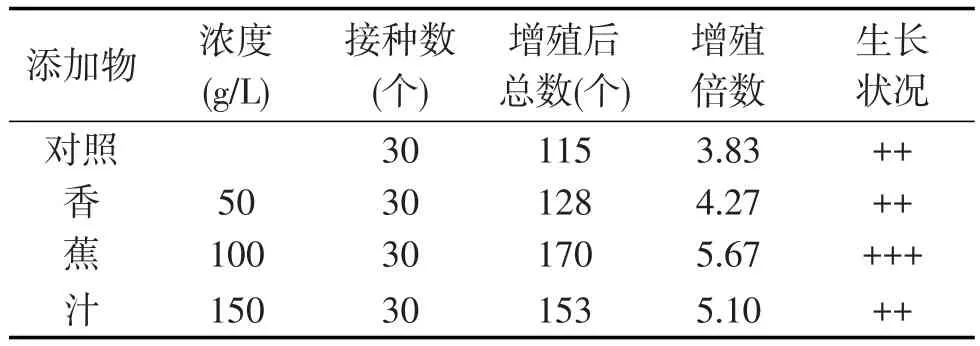
表3 有機添加物對大花蕙蘭原球莖增殖的影響
2.3 不同培養方式對原球莖增殖生長的影響
由表4可知,液體振蕩培養的原球莖總重為36.28 g,而固體培養基培養的原球莖總重僅為16.91 g,振蕩培養的原球莖的增殖倍數(4.2倍)明顯高于固體培養(2.6倍).在液體培養基中進行振蕩培養的原球莖生長速度快,在短時間內即可誘導出大量的原球莖,且生長狀況良好;而固體培養中的原球莖生長速度比較緩慢,前期原球莖生長現象不明顯,到第2~3周生長速度較快,切口邊緣膨大,外層細胞開始誘導分裂,生成綠色的珠狀愈傷組織.這是因為液態培養時培養體可以與培養基充分接觸,營養物質快速移動到培養體表面,從而使吸收養分的速度快于固體培養[7].
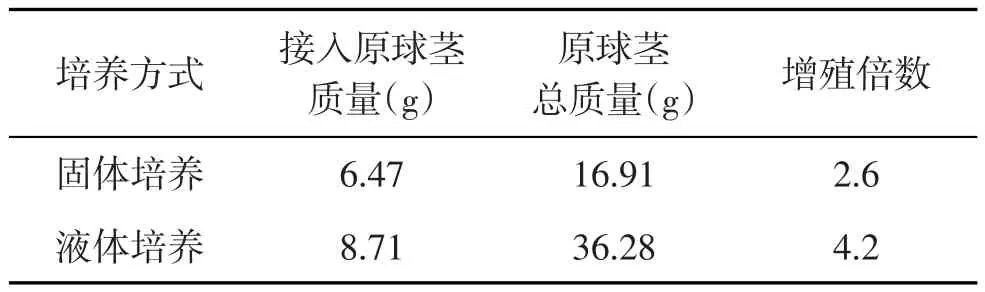
表4 培養方式對大花蕙蘭原球莖增殖的影響
3 結論與討論
試驗結果表明:適宜濃度配比的6-BA、NAA和AC,能有效促進大花蕙蘭原球莖的增殖,其中MS+ 6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1 g/L效果較好,在其基礎上添加100 g/L的香蕉汁增殖效果顯著,當香蕉汁濃度為150 g/L時,可明顯促進大花蕙蘭的生根,在液體培養基中振蕩培養原球莖生長狀態顯著好于在固體培養基中培養,液體培養基培養的原球莖增殖倍數是固體培養的1.5倍.
在大花蕙蘭組培快繁培養過程中,細胞分裂素6-BA與細胞生長素NAA都可促進原球莖的增殖以及誘導,兩者以一定濃度組配再添加一定濃度的蔗糖作碳源,可選出最適大花蕙蘭原球莖增殖的培養基,在本試驗研究中最適合的濃度為6-BA 2.0 mg/L、NAA 0.2mg/L.韓勁峰等[8]在“大花蕙蘭組織培養及快速繁殖研究”試驗中,得出細胞分裂素6-BA濃度在0.5~1.0mg/L范圍內,原球莖的誘導和增殖效果最佳,當6-BA濃度超過1.0mg/L時,對原球莖的誘導和增殖反而起抑制作用.但付志惠[9]在“大花蕙蘭快速繁殖技術的研究”中提到隨著6-BA濃度的升高,原球莖的增殖率上升,當6-BA濃度為8.0mg/L時,叢生芽生長健壯,顏色濃綠,說明其激素濃度越高,增殖率就越高.田英翠等[10]研究結果表明,當NAA的濃度為0.1~0.5mg/L、6-BA為5mg/L左右時,外植體上原球莖數最多,原球莖的誘導率達到最高.本研究表明低濃度生長素與較高濃度的細胞分裂素對大花蕙蘭原球莖增殖有利;低濃度NAA與較高濃度細胞分裂素6-BA會促進原球莖的增殖,抑制分化.
一般認為,一定濃度的活性炭可吸附培養過程中產生的有害物質如酚、醌等,從而有利于原球莖的生長[11-12].高濃度的活性炭能夠吸收繼代培養中產生的某種物質,從而削弱這種物質對原球莖增殖的阻礙作用,而李方認為活性炭對原球莖增殖有抑制作用[13],與本試驗結論不同,這可能是由于接種的原球莖已經多次繼代培養,其體內已含大量細胞分裂素,活性炭的濃度對其影響較小的緣故.
前人研究認為香蕉汁是一類含有氨基酸、激素和酶等有機成分較為復雜的天然復合物,對植物細胞和組織的生長和增殖具有明顯的促進作用,還能有效地吸收由外植體分泌的多酚類氧化物,抑制外植體的褐變,降低外植體的死亡率[14].付志惠[9]研究認為添加香蕉汁也有利于提高增長率和生長勢,降低其褐化.田英翠等[10]、張超等[15]研究結果表明復合添加物如香蕉汁、活性炭、蛋白胨等增殖效果比較明顯,原球莖的生長更加健壯,這與本文的試驗結果一致.究其原因可能是適宜濃度的香蕉汁等天然有機物能提供一些必要的微量營養成分、生理活性物質和生長激素等,具有較大的pH緩沖作用,對原球莖的生長有促進作用.
[1]張助云,汪希強.大花蕙蘭組培快繁技術[J].北方園藝,2007(3): 175-176.
[2]梁新安,楊錄軍,王慧瑜,等.大花蕙蘭高頻再生體系的建立[J].河南農業科學,2006(10):85-87.
[3]譚文澄,戴策剛.觀賞植物組織培養技術[M].北京:中國林業出版社,1997:237-239.
[4]常美花,金亞征,王興月,等.大花蕙蘭快繁技術體系[J].北方園藝,2009(12):120-122.
[5]姚麗娟,徐曉薇,陳義增,等.大花蕙蘭原球莖增殖分化影響因素研究[J].農業科技通訊,2008(5):57-59.
[6]李旭樸,炫春,楊金鳳,等.大花蕙蘭原球莖增殖影響因素的研究[J].安徽農業科學,2010,38(1):54-55.
[7]齊云,袁月祥,陳飛,等.一組纖維素分解菌的分離、篩選及其產酶條件的研究[J].天然產物研究與開發,2003,15(6):50-51.
[8]韓勁峰,韓曉華.大花蕙蘭組織培養及快速繁殖研究[J].廣西農業科學,2008,39(3):284-286.
[9]付志惠.大花蕙蘭快速繁殖技術的研究[J].廣東農業科學,2010 (3):125-127.
[10]田英翠,楊柳.植物激素和復合添加物對大花蕙蘭組織培養的影響[J].安徽農業科學,2006,34(18):4566-4567.
[11]卜學賢,陳維倫.活性炭對培養基中調節物質的吸附作用[J].植物生理學報,1988,14(4):401-405.
[12]劉用生,李友勇.植物組織培養中活性炭的作用[J].植物生理學通訊,1994,3(3):214-217.
[13]李方.中國蘭快繁技術與推廣應用研究[D].杭州:浙江大學, 2004.
[14]譚甜,季勤,張云峰,等.不同培養基對大花蕙蘭原球莖誘導與增殖影響的研究[J].安徽農業科學,2009,37(21):9867-9868.
[15]張超,張茜茜,樓楠男,等.有機添加物對大花蕙蘭原球莖及幼苗生長發育的影響[J].安徽農業科學,2009,37(19):8866-8868.
【編校:王露】
Optim ization of Conditions for Rapid Propagation of Cymbidium Hybridum Protocorm
ZENGZhenjia1,LIFang1,JIA Huang1,XIAOXiaojun1,2,FUHui1
(1.School ofLife Science,Neijiang Normal University,Neijiang,Sichuan 641100,China;.2.Key Laboratory ofCollegesand Universities in Sichuan for Research and Utilization ofDistinctive Agricultural Undertakings,Neijiang,Sichuan 641100, China)
The effects of different concentrations of plant hormones(6-BA、NAA),AC(activated carbon),organic compounds(banana juice)and different culturemethods(solid culture and liquid culture)on themultiplication of PLB were studied by using Cymbidium hybridium PLB.The results indicated that the bestmethod for PLB propagation wasMS+6-BA 2.0mg/L+NAA 0.2mg/L+AC 0.1mg/L associatingwith liquid shaking culture,adding banana juice 100 g/L in the medium could have significant role on the promotion of themultiplication of Cymbidium hybridium PLB.
Cymbidium hybridum;protocorm;propagation;optimization
S682.313
A
1671-5365(2014)12-0118-03
2014-07-05修回:2014-09-10
內江師范學院大學生科研項目(13NSB-75)
曾楨迦(1993-),女,本科生,研究方向為植物組織培養
肖小君(1982-),女,碩士,助理研究員,研究方向為花卉組織培養
時間:2014-09-12 13:00
http://www.cnki.net/kcms/detail/51.1630.Z.20140912.1300.002.htm l

