白芷愈傷組織中總香豆素的提取與測定
梁玉玲,鮮于梁艷,陳子龍
(1.河北大學 生命科學學院,河北 保定 071002;2.河北省生物工程技術研究中心,河北 保定 071002)
白芷為傘形科植物白芷Angelica dahurica(Fisch.Ex Hoffm.)Benth.et H-ook.f.的干燥根[1].白芷的有效成分主要是揮發油和多種香豆素類成分.香豆素類化合物是一類具有苯駢-α-吡喃酮結構骨架的化合物,其中線性香豆素類化合物為光敏活性物質[2],香豆素類化合物含量的高低是中藥白芷品質評價的重要指標之一[3].香豆素類化合物還具有抗菌消炎、鎮痛、抗腫瘤[4-6]等功效.目前,白芷藥材中有效成分的提取測定工藝已較為完善,但是基本沒有以白芷愈傷組織為材料提取香豆素類有效成分的研究.本實驗室通過組織培養的方法誘導出大量白芷愈傷組織,而且對白芷愈傷組織中總香豆素的提取及質量分數的測定進行了相關研究,為藥用植物白芷的植物生物技術開發和利用奠定了基礎.
1 材料與方法
1.1 材料
白芷(A.dahurica)愈傷組織,由本實驗室誘導.市售白芷藥材購自河北安國藥材市場.
1.2 儀器與試劑
KH2200DB型數控超聲波清洗器(昆山市禾創超聲儀器有限公司);UV/2802SH 型紫外可見分光光度計(尤尼柯(上海)儀器有限公司);Eppendorf 5804R 型離心機(Eppendorf 公司);歐前胡素標準品(批號MUST-12062105)購自成都曼思特生物科技有限公司,其他試劑均為分析純.
1.3 方法
1.3.1 標準曲線的繪制
精密稱取歐前胡素標準品3.000mg,甲醇溶解定容至100mL即為標準品母液,精密吸取歐前胡素標準品母液1,2,3,4,5,6,7,8,9,10mL,分別用甲醇定容至10mL.以甲醇為空白,于300nm 處測定吸光值,以質量濃度為橫坐標,吸光度為縱坐標繪制歐前胡素標準曲線.
1.3.2 白芷愈傷組織中總香豆素的提取
精密稱取白芷愈傷組織粉末0.200g,放入50 mL 離心管中,以乙醇為溶劑,按照4 因素3 水平進行L9(34)正交實驗,因素水平見表1.提取液10 000r/min離心10min,取上清液,40℃水浴揮干至無醇味,加甲醇定容至100mL,即得樣品溶液,于300nm 處測定吸光值,并根據回歸直線方程計算總香豆素的質量分數,計算公式如下:
總香豆素的質量分數=100ρ×10-3/m,
其中:ρ為由回歸直線方程求得的香豆素質量濃度(μg/mL);m 為待測樣品的質量(g).
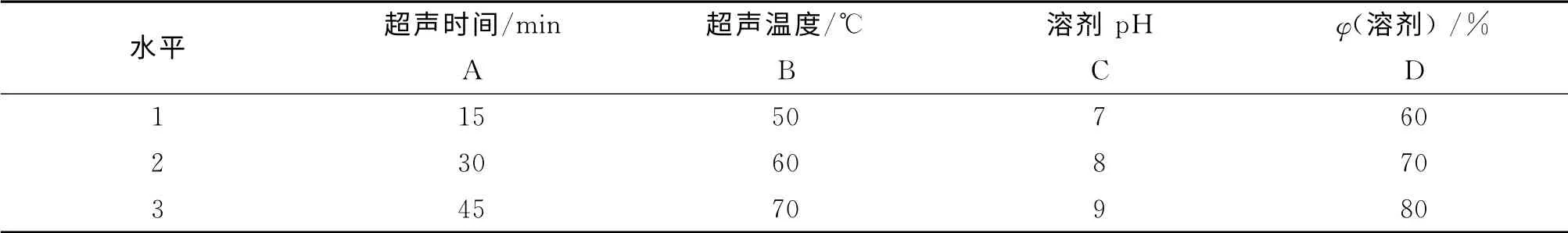
表1 正交實驗因素水平Tab.1 Factor levels of orthogonal experiment
1.3.3 數據統計
實驗中的正交優化結果分析采用Orthogonality Experiment Assistant II軟件進行數據分析,并采用其分析結果.
2 結果與分析
2.1 總香豆素質量分數的測定
2.1.1 測定波長的選擇
在200~400nm 內分別掃描歐前胡素標準品及樣品溶液,兩者在300nm 處均有1個吸收峰,峰形變化平緩,便于定量測定,因此,將300nm 作為本實驗中歐前胡素的測定波長.
2.1.2 線性關系
精密吸取歐前胡素標準品母液1,2,3,4,5,6,7,8,9,10mL,分別用甲醇定容至10mL.以甲醇為空白,于300nm 處測定吸光度,以質量濃度為橫坐標,吸光度為縱坐標繪制標準曲線,得到回歸方程為A=0.049 4ρ-0.001 7(R=0.999,n=10).結果表明,歐前胡素標準品溶液質量濃度在3.0~30.0μg/mL 內線性關系良好.
2.1.3 重復性實驗
精密稱取白芷愈傷組織粉末各0.200g,按1.3.2方法制備7份樣品溶液,平行測定,平均質量分數分別為6.940,6.944,7.028,7.090,7.136,7.139,6.920mg/g,RSD=1.600%(n=7),表明此測定方法重復性良好.
2.1.4 精密度實驗
取2.1.3項7號樣品溶液,于300nm 處連續測定7 次,平均質量分數分別為6.991,6.991,6.991,6.988,6.988,6.988,6.991mg/g,RSD=0.025%(n=7),結果表明精密度良好.
2.1.5 穩定性實驗
取2.1.3項下7號樣品溶液,于300nm 處測定吸光度,每隔30min 測定1 次,連續測定7 次,平均質量分數分別為6.920,7.035,7.126,7.173,7.203,7.193,7.134mg/g,RSD=1.900%(n=7),結果表明樣品在3h 內穩定性良好.
2.1.6 加樣回收實驗
取已知香豆素質量分數的白芷愈份組織樣品約0.100g,精密稱定,分別加入相當于樣品中香豆素質量的80%,100%,120% 的歐前胡素標準品,按樣品溶液制備方法操作.測定結果,其回收率為98.47%,96.86%和98.76%,RSD=2.400%(n=3).
2.2 樣品中總香豆素質量分數的測定
利用紫外分光光度法分別測定不同提取條件下白芷愈傷組織中香豆素類有效成分的質量分數,其結果見表2.
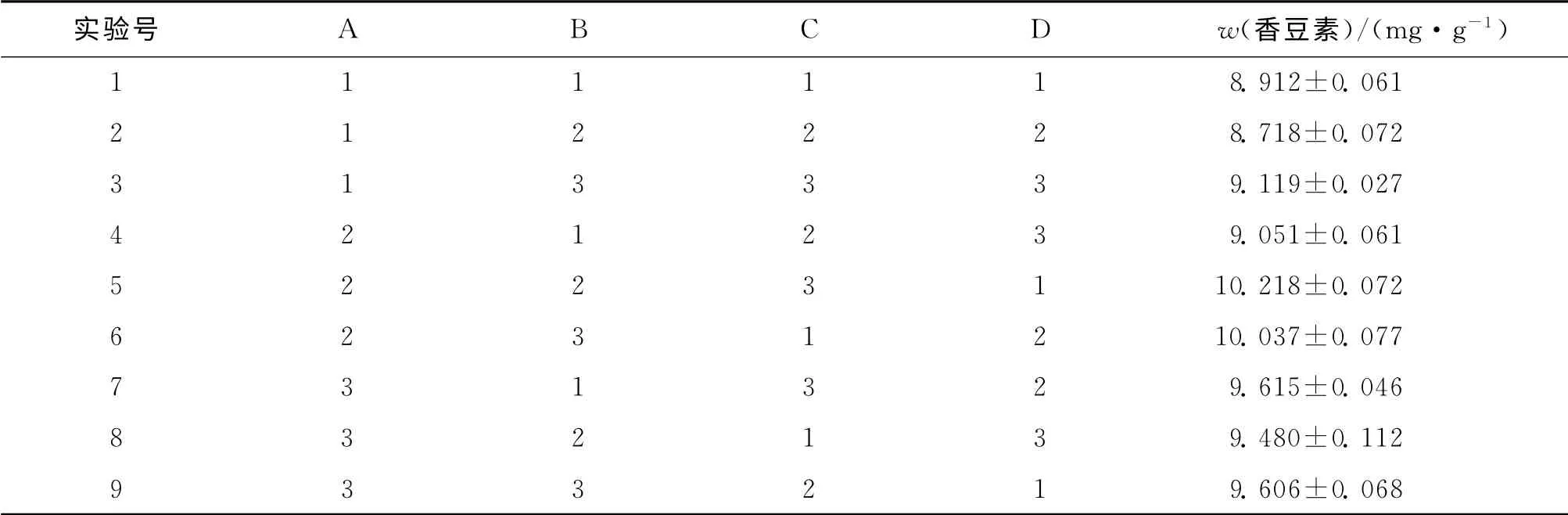
表2 L9(34)正交實驗結果Tab.2 Results from orthogonal experiments arranged on L9(34)
2.2.1 極差分析
由正交實驗直觀分析表(表3)可以看出,4種因素對白芷愈傷組織中總香豆素提取的影響為超聲時間(A)>溶劑pH(C)>超聲溫度(B)>溶劑體積分數(D).對于每種單因素,分析出其較優水平,分別為A2,B3,C3,D1.
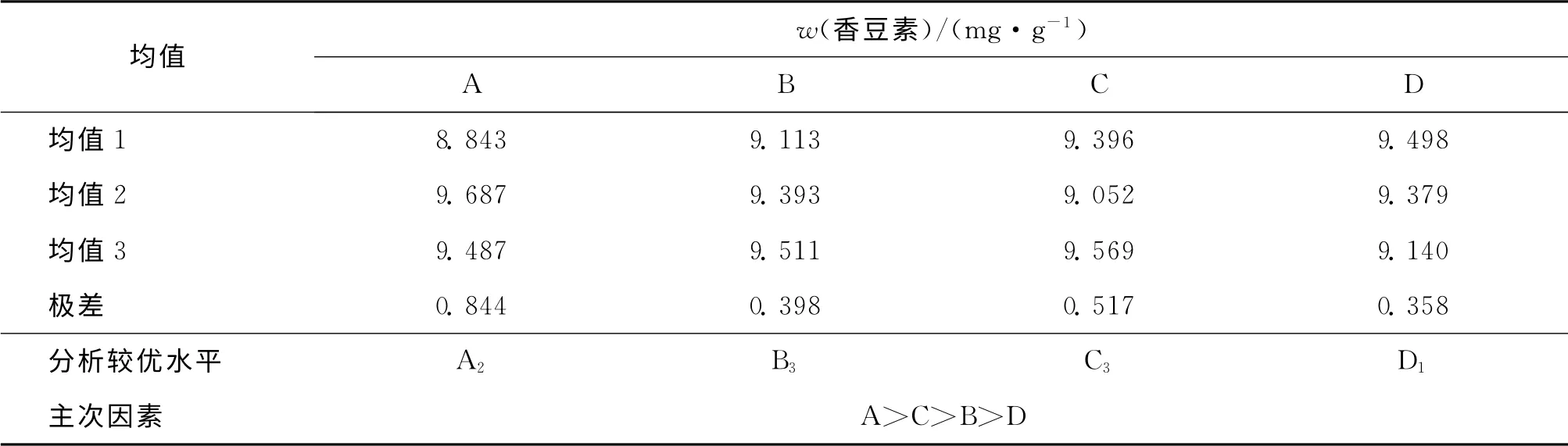
表3 L9(34)正交實驗直觀分析Tab.3 Intiutive analysis of L9(34)orthogonal test
2.2.2 方差分析
由方差分析結果(表4)可知,各因素對香豆素的質量分數的影響無顯著性差異(P>0.05).可能是由于本實驗誤差大,或者自由度小,使檢驗的靈敏度低,從而掩蓋了考察因素的顯著性.由于實驗結果的顯著性不高,所以對本實驗進行了進一步的驗證性實驗,以證明該實驗條件是否為最優方案.

表4 L9(34)正交實驗方差分析Tab.4 Variance analysis of L9(34)orthogonal test
2.3 最優組合驗證實驗
取0.200g白芷愈傷組織粉末,按照最優組合進行超聲提取,即料液比(粉末g:溶劑mL)為1:15,乙醇的體積分數為60%,溶劑pH 為9,超聲時間為30min,超聲溫度為70℃,超聲功率為100W.通過紫外分光光度法測定其總香豆素的質量分數.重復進行3 次實驗,平均質量分數為12.328,12.371,12.291 mg/g,RSD=1.500%(n=3),顯示結果穩定,證明了本實驗所確定的白芷愈傷組織中總香豆素提取的最優組合的可行性.綜上所述,確定白芷愈傷組織中總香豆素提取的最佳組合條件為A2B3C3D1,即超聲時間為30min,超聲溫度為70 ℃,溶劑pH 為9,溶劑乙醇的體積分數為60%.
2.4 白芷藥材中總香豆素的質量分數測定
將作為平行對照的白芷藥材搗碎研磨成粉末,按照愈傷組織總香豆素的提取方法進行提取測定.作為平行對照的白芷藥材中總香豆素的質量分數(表5),3次獨立重復實驗結果顯示白芷藥材中總香豆素的質量分數僅為1.269mg/g,而白芷愈傷組織中總香豆素的質量分數為12.330mg/g,是白芷藥材中總香豆素質量分數的9.7倍.
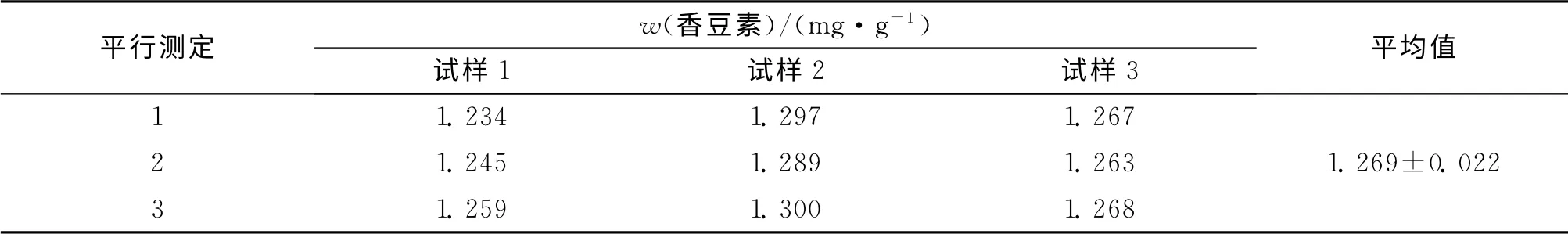
表5 白芷藥材中總香豆素的質量分數Tab.5 Mass fraction of the total coumarin in Angelica dahurica medicinal materials
3 討論
目前,市場上所用的白芷都是白芷的干燥根部分,但是無論是野生資源,還是人工種植資源都在一定程度上耗時較長,而且在種植過程中,受到外界條件的影響相當大.而白芷愈傷組織的生長量巨大,有培養時間短、條件易控制、不受季節影響、不占用農田、質量穩定等優點.同時,通過本實驗證實,本實驗室誘導培養的白芷愈傷組織中總香豆素的質量分數是白芷藥材中總香豆素質量分數的9.7倍,而且完全能夠達到《中國藥典》中不得少于0.080%的要求[1].所以通過組織培養得到大量白芷愈傷組織,并從中提取白芷有效成分,將會為白芷的藥理作用的研究提供相應的實驗基礎.
已報道的白芷總香豆素的提取方法主要有CO2超臨界萃取法[7]、回流法[8]、滲漉法[9]和高速逆流色譜方法[10].CO2超臨界萃取法和高速逆流色譜方法一樣,由于兩者成本都相當高,在實際應用中并不是很廣泛.滲漉提取耗時較長,而回流提取時提取液長時間加熱,易造成有效成分的分解.研究表明超聲提取法可加速藥物有效成分進入溶劑,可以縮短提取時間,提高提取率,節約溶劑,并且免去了高溫對提取成分的影響[11],是適用于中藥材有效成分提取的新工藝.用超聲提取技術來進行白芷愈傷組織有效成分的提取是本實驗所選用的方法,但在使用超聲波進行成分提取時,應注意選擇合適的超聲條件,并根據提取物質的特性進行選擇,以免破壞所需提取物的結構及穩定性.
馬逾英[12]和何珊珊[13]等的研究表明,白芷的提取物的最大吸收波長均在300nm 左右.本實驗在200~400nm 分別掃描歐前胡素標準品及樣品溶液,兩者在300nm 處均有1個吸收峰,因此,將300nm 作為測定波長.本實驗利用了歐前胡素為指示性成分,測定了白芷中總香豆素類有效成分的質量分數,但是對于白芷中總香豆素類成分的具體種類和質量分數還有待進一步研究.
[1] 國家藥典委員會.中華人民共和國藥典:一部[M].北京:中國醫藥科技出版社,2010:97-98.
[2] OKUYAMA T.Studies on the antitumor-promoting activity of naturally occurring substances Ⅱinhibition of tumor promtoter-enhanced phospholipid metabolism by umbelliferous materials[J].Chem Pharmacology Bulletin,1990,38(4):1084.
[3] 魏玉平,劉俊,顏小林,等.白芷治療頭痛的提取工藝評判指標的研究[J].中草藥,2001,32(4):318.WEI Yuping,LIU Jun,YAN Xiaolin,et al.Studies on judging index of extracting technology of root of Angelica dahurica in treating headache[J].Chinese Traditional and Herbal Drugs,2001,32(4):318.
[4] MELAGRAKI G,AFANTITIS A,IGGLESSI-MARKOPOULOU O,et al.Synthesis and evaluation of the antioxidant and anti-inflammatory activity of novel coumarin-3-aminoamides and their alpha-lipoic acid adducts[J].Eur J Med Chem,2009,44(7):3020-3026.
[5] 莊俊嶸,徐德生,劉力,等.白芷的功效與臨床應用[J].上海中醫藥雜志,2013,6(47):82-83.
[6] 楊倩,彭妍.天然香豆素類藥物抗腫瘤作用研究進展[J].池州學院學報,2013,27(3):49-51.
[7] 劉文,韓笑,王學勇.超臨界CO2萃取白芷中歐前胡素的研究[J].中國藥學雜志,2003,38(2):99-100.LIU Wen,HAN Xiao,WANG Xueyong.Study on extraction of imperatorin in Angelica dahuricaby supercritical fluid[J].Journal of Chinese Pharmaceutical Sciences,2003,38(2):99-100.
[8] 梁明金,楊廣德,賀浪沖.白芷中歐前胡素的提取方法研究[J].中成藥,2000,22(12):829-831.
[9] 陳賢春,王玉蓉,路世鵬.白芷提取工藝的研究[J].中成藥,2005,27(2):145-147.
[10] LIU Renmin,LI Aifeng,SUN Ailing.Preparative isolation and purification of coumarins from Angelica dahurica(Fisch.ex Hoffm)Benth,et Hook.f(Chinese traditional medicinal herb)by high-speed counter-current chromatography[J].Journal of Chromatography A.2004,1052:223–227.
[11] 牛波,邱海霞,田景振,等.超聲強化提取技術[J].山東中醫雜志,2000,19(10):629-630.
[12] 馬逾英,鐘世紅,賈敏如,等.紫外分光光度法測定川白芷中總香豆素類成分的含量[J].華西藥學雜志,2005,20(2):159-160.
[13] 何珊珊,武尉杰,譚睿,等.白芷提取物的穩定性研究[J].川北醫學院學報,2013,28(1):6-9.

