產β-甘露聚糖酶菌株的物理和化學誘變育種研究
李慧玲,劉祖艷,趙 敏*
(1.東北林業大學生命科學學院,黑龍江哈爾濱 150040;2.黑龍江中醫藥大學藥學院,黑龍江哈爾濱 150040)
β-甘露聚糖酶(β-mannanase,EC 3.2.l.78)是一種內切水解酶,可以斷裂β-1,4-D-甘露糖苷鍵,其屬于半纖維素酶類[1-2]。人們研究β-甘露聚糖酶始于20世紀50年代末60年代初,1958年Courtios[3]等首次發現產β-甘露聚糖酶的真菌;1960 年 Williams和 Doetsch[4]從細菌中得到 β-甘露聚糖酶;1965年Shibata和Reese[5]第1次提出β-甘露聚糖酶的概念。目前β-甘露聚糖酶已經在醫藥衛生、紙漿漂白、功能低聚糖的研發和石油開采等方面得到廣泛應用。
目前對β-甘露聚糖酶產生菌選育的主要手段是通過誘變育種方式進行菌種改良,從而篩選到適應環境能力強、繁殖力高的高產菌株。誘變育種具有操作簡便、速度快、效果顯著等優點。該研究采用紫外線和甲基磺酸乙酯相結合的誘變方法,提高了β-甘露聚糖酶的活力。
1 材料與方法
1.1 材料
1.1.1 出發菌株。東北林業大學微生物及免疫學實驗室保存菌株Bacillus subtilis WD23。
1.1.2 主要培養基。產酶培養基:魔芋膠30 g/L,酵母膏5 g/L,NaCl 4 g/L,KNO36 g/L,K2HPO45 g/L,MgSO4·7H2O 0.2 g/L,pH 為 8.0。初篩培養基:魔芋膠 3 g/L,CaCl20.5 g/L,KH2PO40.05 g/L,NaCl 0.8 g/L,MgSO4·7H2O 0.025 g/L,KNO30.7 g/L,酵母膏2 g/L,蛋白胨5 g/L,瓊脂18 g/L,pH 7.0。
1.2 方法
1.2.1 出發菌株生長曲線的測定。取適量菌體接入LB培養基培養約12 h。取種子液1 ml移入到50 ml LB液體培養基培養,間隔2 h取樣測菌液的OD600值,繪制生長曲線。每次測量取3組平行。
1.2.2 出發菌株產酶歷程的測定。取適量菌體接入LB培養基培養12 h左右。將600 μl種子液移入魔芋膠產酶培養基培養。間隔2 h取樣,用DNS方法測定發酵液中酶的活性。每次測量取3組平行。
1.2.3 酶活測定。采用改進的3,5-二硝基水楊酸法(DNS方法)測定酶活力[6]。
1.2.4 菌株的紫外誘變。將菌體培養至對數生長期的后期,用生理鹽水調整菌懸液濃度為108cfu/ml。紫外燈下照射劑量分別為0、10、15、20、25、30、35、40、45、50 s。用無菌生理鹽水稀釋誘變菌液和未誘變菌液,涂布于LB固體平板培養基上,37℃倒置培養過夜,計算致死率,致死率=(對照菌液的活菌數-處理菌液的活菌數)/對照菌液的活菌數×100%。隨機選取120個誘變后的菌株點種在魔芋膠初篩培養基上,首先測量單菌落直徑,再加入剛果紅染液染色,測量透明水解圈直徑,計算H/C比值。選擇H/C比值較高的菌株采用DNS方法進行復篩。
1.2.5 菌株的甲基磺酸乙酯誘變。選擇紫外誘變活性最高的菌株進行甲基磺酸乙酯(EMS)誘變。用磷酸緩沖液洗滌菌體,制備菌懸液濃度為108cfu/ml。EMS的使用濃度是1%(V/V)。誘變5、10、15、20、25、30 min。用無菌生理鹽水稀釋誘變菌液和未誘變菌液,涂布于LB固體平板培養基上,37℃倒置培養過夜,計算致死率,初篩和復篩的方法同紫外誘變。
2 結果與分析
2.1 出發菌株的生長曲線 由圖1可看出,在培養初期菌體數量較少,隨著培養時間增加菌體數量呈上升趨勢,當培養約13 h時菌體數量達到最大值,隨后菌體數量開始下降,所以紫外誘變時液體培養時間確定為13 h。
2.2 出發菌株的產酶歷程 出發菌株產酶歷程如圖2所示,發酵初期菌株誘導產酶水平較低,在發酵培養11 h時OD值最高,由于OD值與酶活性成正相關,所以這時酶活力最高。以此確定發酵產酶培養時間為11 h。
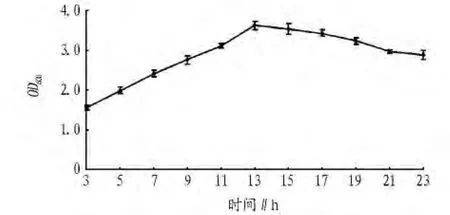
圖1 B.subtilis WD23生長曲線
2.3 紫外誘變結果
2.3.1 紫外誘變的致死率。根據誘變劑量選擇原則,紫外誘變致死率在70% ~80%時,正突變率最高。所以,紫外照射時間選為20~30 s。
2.3.2 初篩和復篩結果。經剛果紅染色后,測量水解圈直徑和菌落直徑,并計算H/C比值,H/C比值大說明降解底物的能力強;菌落直徑大說明菌落適宜在該環境中生長。與對照組相比,分別選擇20株正突變菌株,進行復篩。DNS方法測定初篩所得的20株突變株,最終獲得的酶活最高的正突變菌株為B.subtilis W12(酶活力為3 532.01 U/ml),出發菌株酶活力為3 248.82 U/ml,紫外誘變使酶活力提高8.72%。
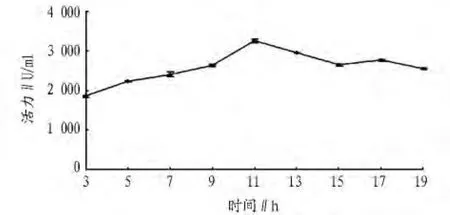
圖2 B.subtilis WD23的產酶歷程
2.4 甲基磺酸乙酯誘變結果
2.4.1 甲基磺酸乙酯誘變致死率。甲基磺酸乙酯屬于化學誘變劑,該研究中誘變劑濃度選為1%。甲基磺酸乙酯對菌體的致死率在70% ~80%之間,正突變率最高,所以菌株B.subtilis W12的甲基磺酸乙酯誘變時間選為10 min。
2.4.2 初篩和復篩結果。在初篩平板選擇20株正突變菌株,進行復篩。測定初篩所得的20株突變株,最終得到的酶活最高的突變菌株 B.subtilis WL-12,酶活力為3 577.57 U/ml,甲基磺酸乙酯使酶活力提高了1.29%。
3 討論
微生物的誘變育種包括物理誘變、化學誘變和生物誘變,其中經常應用的紫外線誘變和甲基磺酸乙酯誘變。紫外線照射可以使DNA形成胸腺嘧啶二聚體,影響DNA正常復制和堿基的正常配對,最終引起基因突變[7]。甲基磺酸乙酯屬于烷化劑,堿基烷基化后影響mRNA正常轉錄,從而使蛋白質表達紊亂而改變性狀。該研究中采用了紫外線、甲基磺酸乙酯分別誘變菌株,結果表明紫外線誘變效果好于甲基磺酸乙酯,也就是物理誘變效果好于化學誘變。
[1]MCCLEARY B V.β - mannanase[J].Methods in Enzymology,1988,160:596-610.
[2]SCHOMBUG D,SALZMANN M.Enzyme Handbook[M].Berlin:Springer-Verlay Berlin Heideberg,1991:1 -5.
[3]COURTIOS J E,PETEK F,KADA T.Research on galactomannans.II.Action of takadiastase on the galactomannan of lueeren[J].Bull Soc Chem Biol,1958,40:2031 -2037.
[4]WILLIAMS P P,DOETSCH R N.Microbial dissimilation of galactomannan[J].Gen Microbiol,1960,22:635 -644.
[5]REESE T,SHIBATA Y.β-Mannanase of fungi[J].Can J Microbiol,1965,11:167-183.
[6]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959(31):426 -428.
[7]龐曉坤,曹德菊,花日茂.物理因子誘變技術在廢水生物處理中的應用研究[J].四川環境,2005,24(5):68 -71.

