碘化鈉注射液細菌內毒素檢查方法的研究
趙 昕,賀康洪,趙文軍,高 錦
0 引言
碘化鈉注射液為軍隊醫院常用制劑,用于腎臟、尿道、膀胱及膽道造影,收載于《中國人民解放軍醫療機構制劑規范》[1]。該制劑按細菌內毒素檢查法指導原則[2],屬于應建立家兔熱原法或細菌內毒素檢查法的品種,但原質量標準未做規定。家兔法檢查熱原,成本高、操作復雜,結果易受操作人員、試驗動物等因素影響,而鱟試劑法檢查注射劑的內毒素具有靈敏度高、操作簡便、快速等特點。為保證藥品質量,降低使用風險,提高用藥安全性。本文參照2010年版中國藥典附錄細菌內毒素檢查法[3]及文獻[4-6],建立了鱟試劑方法檢查碘化鈉注射液中的細菌內毒素。
1 藥品與試劑
碘化鈉注射液(規格:20 mL∶碘化鈉2.5 g、硫代硫酸鈉0.002 g、碳酸氫鈉0.1 g,批號:130724-1、130724-2、130724-3,來源:廣州軍區某醫院);鱟試劑(以下簡稱TAL。規格:0.1 mL,靈敏度:0.25 EU/mL。批號:1309110,生產廠家:湛江博康海洋生物有限公司;批號:1307232,生產廠家:湛江安度斯生物有限公司);細菌內毒素工作標準品(以下簡稱WSE,中國食品藥品檢定研究院,效價:100 EU/支,批號:150601-201176);細菌內毒素檢查用水(以下簡稱BET水,湛江安度斯生物有限公司,規格:50 mL,批號:1212260)。
2 方法與結果
2.1 細菌內毒素限值(L)的確定 細菌內毒素限值L=K/M,式中K為人最大可接受的細菌內毒素劑量,注射劑為5 EU/(kg·h);M為人用的最大供試品劑量,根據《中國人民解放軍醫療機構制劑規范》和本品說明書,得知碘化鈉注射液一次最大用量為50 mL,即 M=50 mL/(60 kg·h),K為按給藥途徑,人用每公斤體重每小時可接受的內毒素最大劑量,注射劑為5 EU/(kg·h),按公式計算得碘化鈉注射液的內毒素限值L=6 EU/mL,為嚴格標準、便于計算,最終確定限值為5 EU/mL。
2.2 鱟試劑靈敏度復核實驗 按照2010年版中國藥典細菌內毒素檢查法規定,進行鱟試劑的標示靈敏度復核,結果見表1。

表1 鱟試劑靈敏度復核(EU/mL)
2個廠家的鱟試劑經細菌內毒素工作標準品檢查λC在0.5~2.0 λ之間,符合標準規定,可用于試驗。
2.3 干擾試驗預試驗
2.3.1 供試品最大有效稀釋倍數(MVD)的計算 計算公式為MVD=cL/λ,其中L為碘化鈉注射液的細菌內毒素限值5 EU/mL,λ為鱟試劑靈敏度,c為供試品溶液的濃度,當L以EU/mL表示時,則c=1.0 mL/mL。目前市售鱟試劑靈敏度λ通常在0.5~0.03 EU/mL,則碘化鈉注射液的對應最大有效稀釋倍數分別為:MVDλ0.5=10倍;MVDλ 0.25=20倍;MVDλ0.125=40倍;MVDλ0.06=80倍;MVDλ 0.03=160倍。
2.3.2 實驗操作 將碘化鈉注射液用BET水分別稀釋為10、20、40、80、160倍稀釋液,將此系列濃度溶液記為NPC (Negative product control)。另平行制備系列濃度的供試液,并使10、20、40、80、160倍稀釋液的供試液中均含有2 λ濃度的細菌內毒素,將此系列溶液記為PPC(Positive product control)。用來自2個廠家靈敏度均為0.25 EU/mL的鱟試劑,分別與上述PPC和NPC兩種溶液進行反應,每一濃度重復兩管,并設陽性對照(Positive control)和陰性對照(Negative control),分別記為PC和NC,混勻后封口,置37 ℃恒溫容器中反應60 min,結果見表2。
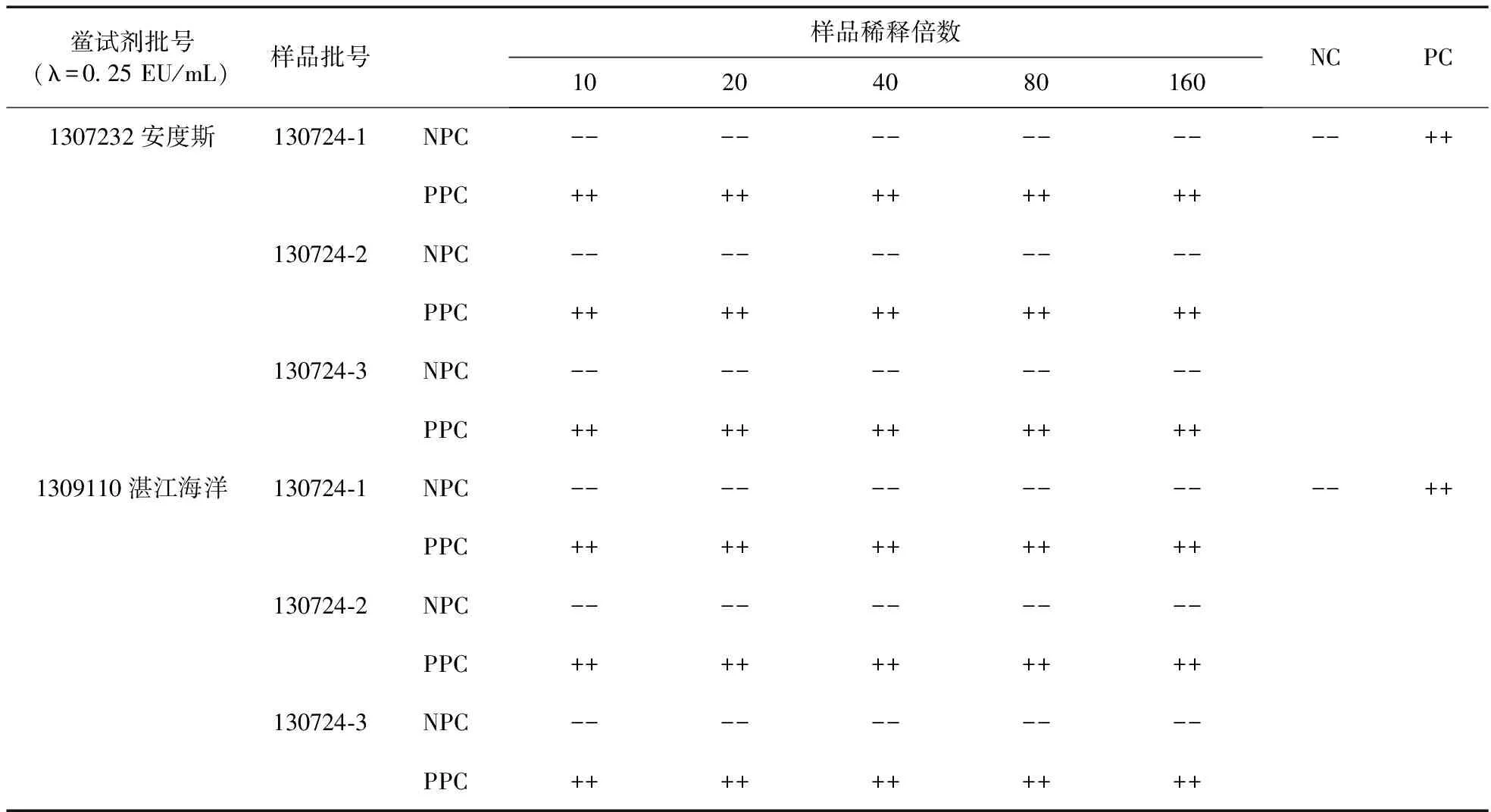
表2 碘化鈉注射液干擾預試驗
干擾試驗預試驗結果表明,用2個廠家靈敏度均為0.25 EU/mL的鱟試劑分別對3批碘化鈉注射液行細菌內毒素試驗,結果碘化鈉注射液的10、20、40、80、160倍稀釋液均無干擾。
2.4 正式干擾試驗 為了最終確認是否存在抑制因素的影響,進行正式干擾試驗。取3批碘化鈉注射液用BET水分別稀釋為20倍稀釋液,用該20倍稀釋液和BET水分別將WSE稀釋為含內毒素0.5(2 λ)、0.25(λ)、0.125(0.5 λ)、0.06 (0.25 λ) EU/mL的溶液,與2個廠家靈敏度為0.25 EU/mL的鱟試劑反應,每一濃度重復4管,并設陰性對照,按2010年版中國藥典細菌內毒素檢查供試品干擾試驗項進行實驗,結果見表3。
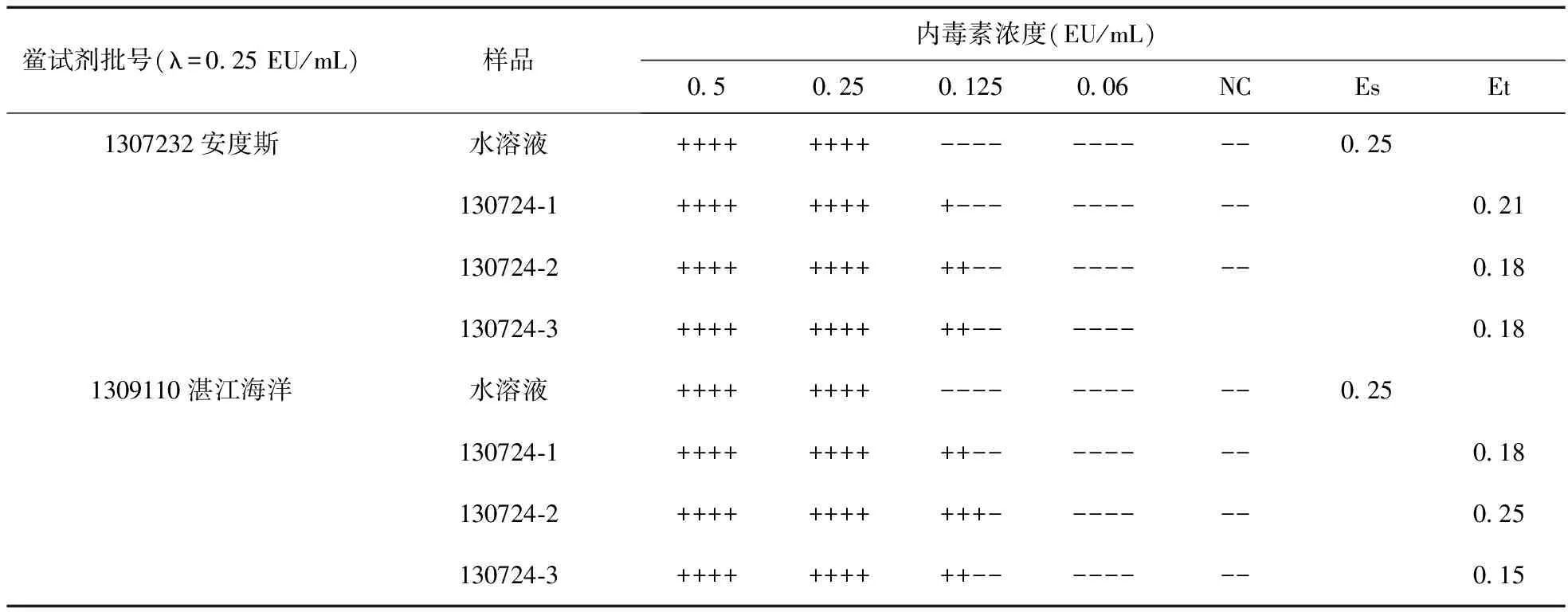
表3 碘化鈉注射液的干擾試驗(EU/mL)
正式干擾試驗結果表明,將3批次碘化鈉注射液稀釋20倍,用2個廠家靈敏度均為0.25 EU/mL的鱟試劑進行試驗,結果ES均在0.5~2.0 λ,Et均在0.5~2.0 ES范圍內,符合藥典規定,確認供試液對檢查無干擾影響。
2.5 樣品細菌內毒素檢查 按2010年版中國藥典細菌內毒素檢查法,將3批次碘化鈉注射液(用BET水配成20倍稀釋液),用2個廠家靈敏度λ均為0.25 EU/mL的鱟試劑,按《中國藥典》(二部)附錄細菌內毒素檢查法檢查,結果見表4。
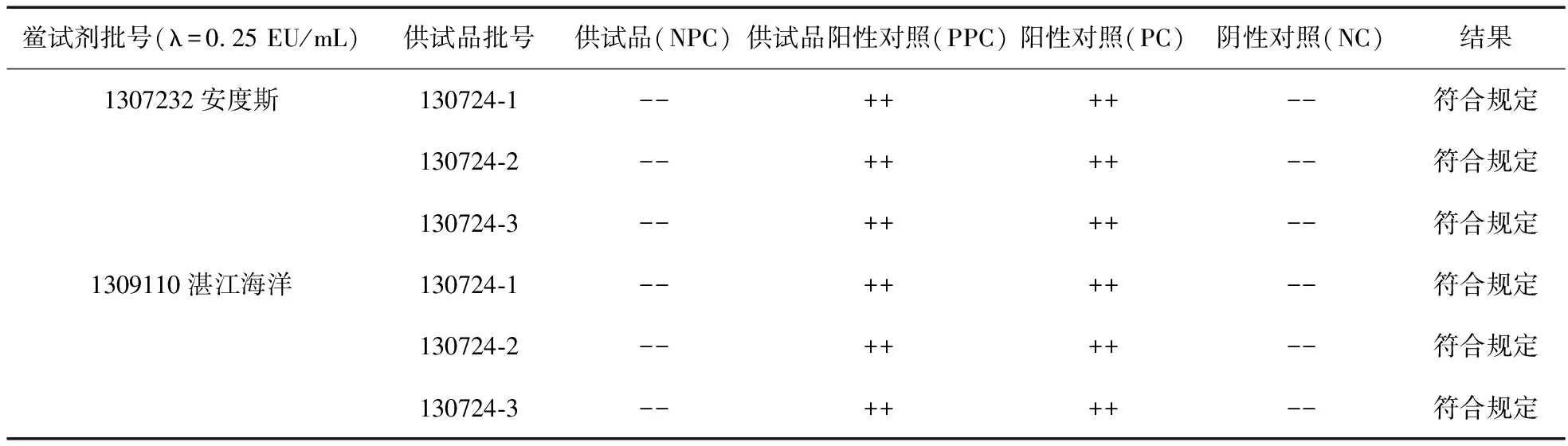
表4 碘化鈉注射液細菌內毒素檢查結果
3 討論
3.1 碘化鈉注射液pH值范圍為7.0~9.0,符合細菌內毒素檢查供試液pH值要求標準,不干擾凝膠反應,無需調節可直接取供試品用BET水稀釋后檢查。
3.2 將碘化鈉注射液配制成10、20、40、80、160倍稀釋液,與2個廠家靈敏度為0.25 EU/mL的鱟試劑反應均無干擾。正式干擾試驗,將樣品稀釋20倍,用2個廠家靈敏度為0.25 EU/mL的鱟試劑進行試驗,結果ES均在0.5~2.0 λ,Et均在0.5~2.0 ES范圍內,確認無干擾影響。對3批次碘化鈉注射液分別依法檢查,結果均符合規定。
3.3 取本品,依法檢查(《中國藥典》2010年版附錄細菌內毒素檢查法),每1 mL碘化鈉注射液中含內毒素應<5 EU/mL。
參考文獻:
[1] 中國人民解放軍總后勤部衛生部.中國人民解放軍醫療機構制劑規范[S].北京:人民軍醫出版社,2002:313-314.
[2] 中國藥品生物制品檢定所.中國藥品檢驗標準操作規程[S].中國醫藥科技出版社,2010:310-325.
[3] 國家藥典委員會.中國藥典2010年版(二部)[S].北京:中國醫藥科技出版社,2010:附錄99-102.
[4] 付聰,高錦,嵇揚,等.復方乳酸鈉注射液3號細菌內毒素檢查方法的研究[J].藥學實踐雜志,2011,29(2):120-121,148.
[5] 付聰,高錦,嵇揚,等.甲硫酸新斯的明注射液細菌內毒素檢查方法的研究[J].藥物分析雜志,2008,28(7):1141-1143.
[6] 羅麗萍,王宗春,郭咸希.鱟試劑方法檢測丙泊酚注射液中細菌內毒素的可行性研究[J].湖北中醫藥大學學報,2011,13(3):235-236.

