缺氧活化AMPK/mTOR通路對腦血管內皮細胞增殖及代謝的影響
尉 娜 王建平 路 坦
(鄭州大學第五附屬醫院神經內科,河南 鄭州 450000)
AMP激活的蛋白質激酶(AMPK)是一種保守的異源三聚體蛋白激酶,其活力能夠被AMP上調。AMPK通常被認為是一種應激反應酶,在體內葡萄糖缺乏、缺氧、缺血及熱休克等引起AMP/ATP比例升高的情況下,細胞內的AMPK即可被激活,進而促進細胞內轉錄調節,影響細胞的生物學行為〔1〕。哺乳動物雷帕霉素靶蛋白(mTOR)是與AMPK相反的能量感應器〔2〕,在能量缺乏時被抑制,能量充足時被激活。mTOR可接受并整合細胞內外的各種刺激,調節細胞生長增殖、存活、自噬、凋亡等生理過程〔3〕。本研究中觀察到缺氧可抑制腦血管內皮細胞的增殖和代謝,并促進腦血管內皮細胞的凋亡。進一步的機制研究發現缺氧可通過激活AMPK通路,進而抑制mTOR通路的活化,從而抑制腦血管內皮細胞的增殖和代謝。
1 材料與方法
1.1細胞系 小鼠腦微血管內皮細胞系bEnd.3細胞(復旦大學上海醫學院生理與病理生理學系惠贈)。
1.2試劑與抗體 高糖DMEM培養基購自Hyclone 公司;CCK8試劑盒購自同仁化學研究所;兔抗人p-AMPK抗體、兔抗人p-mTOR抗體購自Cell Signaling Technology 公司;mTOR抑制劑雷帕霉素(RAPA)、DCFH-DA購自Sigma-Aldrich 公司;辣根過氧化物酶標記羊抗兔IgG、羊抗鼠IgG購自北京中杉金橋生物技術有限公司;轉染試劑購自Lonza 公司;AMPKα siRNA 序列、Annexin V/PI染色試劑盒購自Invitrogen公司;CytoBuster 蛋白提取試劑購自Novagen公司;硝酸纖維素膜購自GE公司。
1.3細胞培養 bEnd.3細胞培養在含10%胎牛血清的DMEM高糖培養基中,常氧組細胞置于37℃、5% CO2孵箱中培養。低氧處理組置于三氣數字培養箱內,用混合氣(80% N2、5%CO2、15%O2)、(85% N2、5%CO2、10%O2)、(90% N2、5%CO2、5%O2)、 (94% N2、5%CO2、1%O2)置換法進行低氧培養。細胞融合達80%時,用胰酶消化傳代,并根據細胞生長狀況進行換液。
1.4細胞增殖檢測 bEnd.3細胞接種于96孔板上。待16~18 h后貼壁生長至對數生長期時,棄去原培養基,按上述缺氧條件繼續培養24 h后,分別向每孔中加入10 μl CCK8,繼續孵育1 h。450 nm波長測定吸光度。
1.5ROS含量測定 bEnd.3細胞經0.25%胰酶消化后,重懸于PBS中。加入1 μl DCFH-DA,避光,37℃放置30 min,流式細胞儀檢測熒光強度。
1.6細胞凋亡檢測 收集細胞,1 000 r/min離心5 min,1% BSA PBS洗滌1次。用100 μl Binding緩沖液將細胞重懸,加入2 μl Annexin V染料和0.1 μl PI染料,避光15 min,流式細胞儀檢測。
1.7細胞處理 干擾AMPK時分別采用AMPKα1特異的siRNA和siRNA干擾過夜。處理細胞的RAPA濃度為10 nmol/L。
1.8細胞總蛋白提取 上述細胞用冰PBS洗滌2次,離心400 r/min 5 min;將離心后的上清棄去,細胞沉淀輕輕彈勻,加入蛋白酶磷酸酶抑制劑和100 μl CytoBuster 蛋白提取試劑,高速渦旋細胞裂解混合物25 s,室溫放置15 min;將細胞裂解混合物低溫高速離心,4℃,12 000 r/min離心15 min;所得上清部分即細胞總蛋白,除留部分樣品檢測蛋白濃度外,其余分裝15 μl/管,-80℃凍存。
1.9BCA法測定蛋白濃度 按說明書倍比稀釋標準品BSA;按體積比50∶1 混合BCA試劑A和試劑B,混合液為備用工作液;在96孔板中進行測定,每孔加入200 μl/孔工作液,隨后加入25 μl倍比稀釋的標準品或待測樣品,每種樣品設置3復孔。振蕩器短暫振蕩混勻30 s;37℃孵育30 min;振蕩器短暫混勻后在波長562 nm 處測定OD值;根據標準品的光密度值和濃度梯度繪制標準曲線,根據標準曲線及待測樣品的OD 值推算各蛋白樣品濃度。
1.10Western印跡 等量提取的蛋白經10% SDS-PAGE 分離膠和5%濃縮膠分離后,半干轉印至硝酸纖維素膜上,以含5% BSA 的TBST室溫封閉1 h,加入一抗4℃過夜孵育。第二天用0.1% TBST 洗膜3次,每次5 min,加入相應的HRP標記的二抗,室溫孵育1 h。0.1% TBST 洗膜后,硝酸纖維素膜以Supersignal West Femto HRP 敏感化學發光底物對條帶進行顯色。Actin作為內參對照。所有實驗至少重復3次。
1.11統計學分析 采用SPSS15.0軟件行t檢驗。
2 結 果
2.1缺氧對腦血管內皮細胞增殖和代謝的影響 缺氧可顯著抑制腦血管內皮細胞的增殖能力和腦血管內皮細胞中的ROS代謝;且隨著氧濃度降低,缺氧對腦血管內皮細胞的增殖能力和腦血管內皮細胞中ROS代謝的抑制也逐漸增強。見表1。
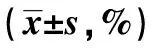
表1 不同氧濃度對腦血管內皮細胞增殖和代謝的影響
2.2缺氧促進腦血管內皮細胞凋亡 缺氧處理后,腦血管內皮細胞的凋亡率相比正常氧對照組明顯升高(圖1)。

圖1 缺氧對腦血管內皮細胞凋亡率的影響
2.3缺氧對腦血管內皮細胞中AMPK蛋白磷酸化的影響 缺氧處理腦血管內皮細胞后,隨著氧濃度的降低,AMPK蛋白磷酸化水平逐漸升高。見表2,圖2。
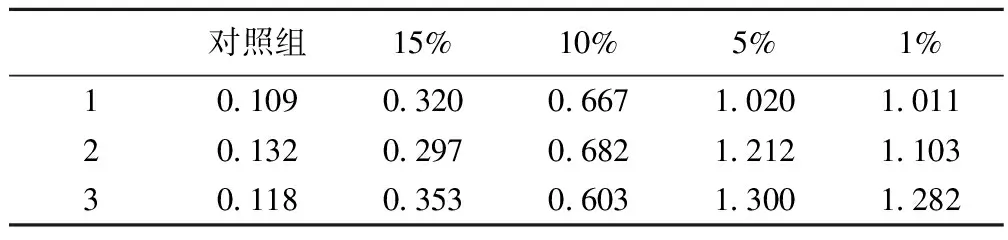
表2 腦血管內皮細胞中AMPK蛋白磷酸化水平定量
2.4缺氧對腦血管內皮細胞中mTOR蛋白磷酸化的影響 缺氧處理腦血管內皮細胞后,隨著氧濃度的降低,mTOR蛋白磷酸化水平逐漸降低。見表3,圖3。
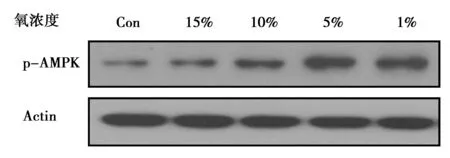
圖2 Western印跡檢測缺氧處理腦血管內皮細胞中AMPK蛋白磷酸化水平
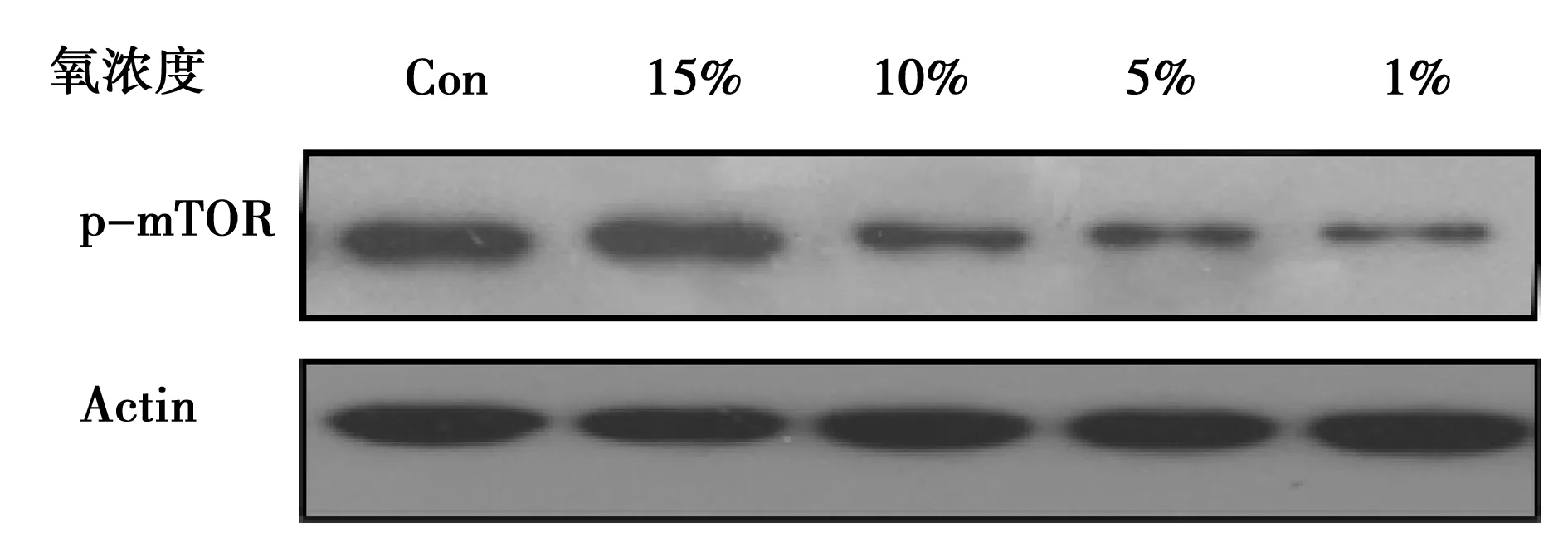
圖3 Western印跡檢測缺氧處理腦血管內皮細胞中mTOR蛋白磷酸化水平
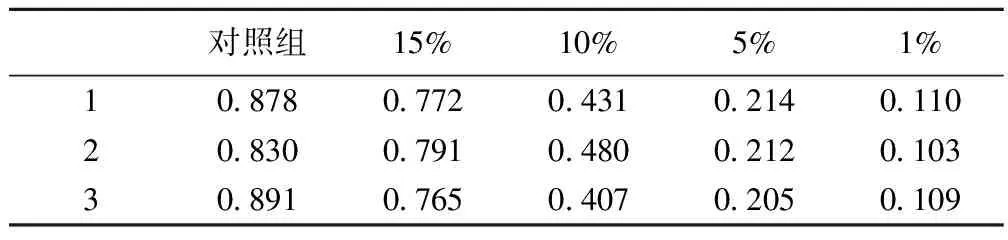
表3 腦血管內皮細胞中mTOR蛋白磷酸化水平定量
2.5AMPK蛋白位于mTOR蛋白上游 以AMPKα1 siRNA敲低腦血管內皮細胞中AMPK蛋白后,mTOR蛋白磷酸化水平顯著升高(圖4A)。以mTOR信號通路抑制劑RAPA處理腦血管內皮細胞后,AMPK蛋白磷酸化水平未受到顯著影響(圖4B)。
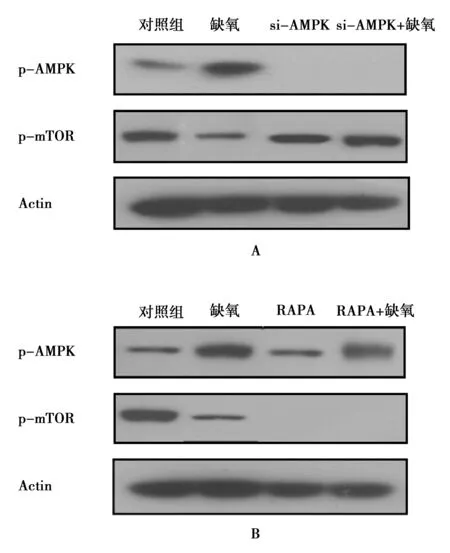
圖4 Western印跡檢測腦血管內皮細胞中AMPK蛋白和mTOR蛋白磷酸化水平
3 討 論
國內外研究結果表明,腦血管疾病多伴發缺血缺氧。腦的耗氧量約占機體總耗氧量的20%,而且腦組織對缺氧的耐受性差,短時間缺氧即可造成神經元死亡〔4〕。缺氧應激可激活AMPK途徑,激活的AMPK除在能量代謝方面起重要作用外,還參與細胞內的轉錄調節,影響細胞的分裂周期,從而抑制細胞的增殖〔5〕。mTOR是一種保守的絲/蘇氨酸蛋白質激酶,在細胞生長、增殖及分化中具有重要的調節作用〔6〕,可在多種因素的活化下參與密碼子翻譯起始、基因轉錄、細胞凋亡等多種生物學功能〔7〕。有研究認為激活的AMPK可以抑制由生長因子和氨基酸刺激激活的mTOR信號途徑,從而影響細胞的生物學行為〔8〕。
本研究結果發現隨著氧濃度的逐漸降低,缺氧對腦血管內皮細胞的增殖和代謝抑制逐漸增強。缺氧條件下腦血管內皮細胞出現明顯的凋亡,隨著氧濃度的降低,細胞凋亡率逐漸增加;且隨著氧濃度的逐漸降低,AMPK的磷酸化水平顯著增加,而mTOR的磷酸化水平顯著降低。提示缺氧可能通過激活AMPK途徑,進而抑制mTOR途徑,從而對腦血管內皮細胞的增殖、代謝以及凋亡產生影響。敲低AMPK后,腦血管內皮細胞中mTOR的磷酸化水平較未敲低組明顯增加,表明AMPK確實對mTOR存在抑制作用,且mTOR為AMPK通路下游的靶蛋白。以mTOR通路抑制劑處理腦血管內皮細胞后,AMPK的磷酸化水平較對照組未出現顯著的變化,進一步證實了mTOR為AMPK通路下游的靶蛋白。
綜上,缺氧可通過激活腦血管內皮細胞中的AMPK通路,進而抑制mTOR的磷酸化水平,從而抑制腦血管內皮細胞的增殖和代謝,并促進腦血管內皮細胞的凋亡,AMPK和mTOR之間的相互拮抗作用對它們調控腦血管內皮細胞的增殖和代謝起到了一定的作用。
4 參考文獻
1Kemp BE,Stapleton D,Campbell DJ,etal.AMP-activated protein kinase,super metabolic regulator〔J〕.Biochem Soc Trans,2003;31(Pt 1):162-8.
2Inoki K,Kim J,Guan KL.AMPK and mTOR in cellular energy homeostasis and drug targets〔J〕.Annu Rev Pharmaeol Toxicol,2012;52:381-400.
3Dazert E,Hall MN.mTOR signaling in disease〔J〕.Curt Opin Cell Biol,2011;23(6):744-55.
4劉 堅,黃 亮.AMPK和mTOR信號傳導的相互拮抗在缺血性腦損傷中的作用〔J〕.中華急診醫學雜志,2012;21(12):1398-400.
5Son BK,Akishita M,Iijima K,etal.Adiponectin antagonizes stimulatory effect of tumor necrosis factor-alpha on vascular smooth muscle cell calcification:regulation of growth arrest-specific gene 6-mediated survival pathway by adenosine 5′-monophosphate-activated protein kinase〔J〕.Endocrinology,2008;149(4):1646-53.
6Carrera AC.TOR signaling in mammals〔J〕.J Cell Sci,2004;117(20):4615-6.
7Pang T,Zhang ZS,Gu M,etal.Small molecule antagonizes autoinhibition and activates AMP activated protein kinase in cells〔J〕.J Biol Chem,2008;283:16051-60.
8Kimura N,Tokunaga C,Dalal S,etal.A possible linkage between AMP-activated protein kinase (AMPK)and mammalian target of rapamycin (mTOR)signaling pathway〔J〕.Genes Cells,2003;8(1):65-79.

