消癥活絡方藥對TGF-β1誘導HK-2細胞轉分化的影響
葉豆丹 郭淑婷 潘 志 劉慶彬 王穎航
(長春中醫(yī)藥大學研發(fā)中心,吉林 長春 130117)
慢性腎病(CKD)的發(fā)病率逐漸增加,由于其病程長、治療費用昂貴,給社會及家庭帶來經濟和精神上的負擔。腎纖維化是大多數CKD發(fā)展至終末期腎衰竭的共同通路,而且纖維化進程與腎衰竭等級相關〔1,2〕。逆轉或延緩腎纖維化進程成為治療CKD的突破口。腎纖維化過程中有多種細胞因子參與,如轉化生長因子(TGF-β1)、結締組織生長因子(CTGF)、信號傳導分子(Smad2)、Smad7等〔3~6〕。其中TGF-β1被廣泛認為是腎纖維化過程中的關鍵因子,任何一種CKD都能發(fā)現TGF-β1表達上調〔7〕。CTGF為TGF-β1下游調節(jié)因子,能夠增強TGF-β1的致纖維化效應〔8〕。本實驗以TGF-β1為刺激因子誘導腎小管上皮細胞(HK-2)細胞轉分化,通過細胞增殖試驗和免疫細胞化學等方法研究消癥活絡方藥對TGF-β1誘導HK-2轉分化的拮抗作用。
1 對象與方法
1.1試劑及儀器 CO2恒溫培養(yǎng)箱:SANYO公司;超凈工作臺:蘇州凈化公司;倒置顯微鏡:上海蔡康光學儀器有限公司;酶標儀:美國Thermo公司;DMEM高糖培養(yǎng)基:美國GIBCO公司;胎牛血清(BSA):HyClone公司;噻唑蘭(MTT):美國SIGMA公司;TGF-β1:PEPROTECH公司;鹽酸貝那普利:北京諾華制藥有限公司;α-平滑肌肌動蛋白(α-SMA)、CTGF及免疫組化試劑盒:武漢博士德公司,Wistar大鼠購自吉林大學動物部。
1.2方法
1.2.1細胞培養(yǎng) 人近端HK-2常規(guī)培養(yǎng),培養(yǎng)條件為:DMEM高糖培養(yǎng)基+10%BAS作為培養(yǎng)液,培養(yǎng)箱溫度為37℃,CO2濃度為5%,0.25%胰蛋白酶+1%乙二胺四乙酸(EDTA)作為消化液用于細胞傳代。
1.2.2含藥血清制備 健康雄性Wistar大鼠30只,體重為230~280 g,隨機分為空白組、陽性組及中藥組,每組10只,每天清晨灌胃(其中空白組灌胃蒸餾水,陽性組灌胃鹽酸貝那普利溶液,中藥組灌胃消癥活絡方藥水煎劑),給藥劑量按動物實驗等效劑量的折算方法換算,以最大劑量灌胃,連續(xù)給藥7 d,1次/d。最后一次給藥2 h后,腹腔注射戊巴比妥鈉麻醉,腹主動脈取血,靜置2 h左右 ,1 000 r/min離心,取上層血清,合并同組血清,56℃滅活30 min,0.22 u濾器過濾,-20℃保存?zhèn)溆谩?/p>
1.2.3MTT法檢測HK-2增殖 HK-2細胞生長至對數期消化后,收集細胞制成細胞懸液,鏡下計數并調整細胞濃度為1×105后,接種于96孔板,同時接種3塊板,即24、48、72 h板。根據實驗預試每板分為空白對照組、TGF-β1組、消癥活絡方藥5%含藥血清組(方藥1組)、消癥活絡方藥10%含藥血清組(方藥2組)、陽性對照鹽酸貝那普利含藥血清組(陽性對照組);每組6個復孔,100 μl/孔。細胞長滿孔底后換無血清DMEM培養(yǎng)基同步24 h。細胞同步后棄掉上清液,按以上分組加入受試物,分別于給藥后4、24、48、72 h用MTT法檢測細胞增殖,實驗重復3次。
1.2.4免疫細胞化學法檢測α-SMA及CTGF表達 取對數生長期細胞,制成細胞懸液,鏡下計數并調整細胞濃度至1×105,將高壓滅菌的細胞爬片置于6孔板內,將細胞懸液鋪于細胞爬片上,100 μl/片,面積盡量大但不能超出爬片,置于CO2培養(yǎng)箱內培養(yǎng)4~5 h使細胞貼壁,每孔補加2 ml培養(yǎng)基,換無血清培養(yǎng)基同步24 h,棄掉上清液。根據實驗預試每板分為空白對照組、TGF-β1組、消癥活絡方藥含藥血清組、陽性對照含藥血清組。收集細胞爬片,免疫組化法檢測α-SMA及CTGF表達率。按免疫組化試劑盒說明操作,10%甲醛固定30 min,空氣干燥5 min,磷酸鹽緩沖液(PBS)(pH7.2~7.6)洗2 min 3次。30%H2O2加純甲醇50份混合,室溫浸泡30 min,蒸餾水洗2 min 3次。滴加5%BSA封閉液,室溫20 min,甩去多余液體,不洗。滴加α-SMA(1∶50稀釋)或CTGF(1∶50稀釋),4℃過夜,PBS洗2 min 3次。滴加生物素化山羊抗小鼠IgG,20℃~37℃ 20 min,PBS洗2 min 3次。滴加鏈霉素和素-生物素復合物(SABC)試劑,20℃~37℃ 20 min,PBS洗5 min 4次。二氨基聯苯胺(DAB)顯色,蒸餾水洗滌。蘇木素輕度復染。脫水、透明、封片。每組隨機選取5個視野計算陽性表達率。
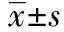
2 結 果
2.1MTT比色法檢測清癥活絡方藥對TGF-β1誘導HK-2增殖的影響 各組OD值均比TGF-β1組小(P<0.05),消癥活絡方藥血清組和陽性對照含藥血清組OD值均較TGF-β1組小(P<0.05)。見表1。
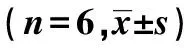
表1 MTT比色法檢測消癥活絡方藥對TGF-β1誘導的HK-2增殖的影響
2.2免疫細胞化學法檢測α-SMA和CTGF表達結果 空白組基本未見α-SMA表達,細胞形態(tài)呈鋪路石樣,TGF-β1處理組細胞在48 h開始出現明顯的形態(tài)改變,大量細胞由立方鋪路石樣轉變?yōu)樗笮烷L條狀,細胞肥大,72 h更加明顯,72 h進行免疫細胞化學染色見大量細胞胞漿內強烈表達α-SMA。TGF-β1組的α-SMA和CTGF陽性細胞很明顯多于空白對照組(P<0.05),消癥活絡方藥組和陽性對照含藥血清組明顯少于TGF-β1組和空白組(P<0.05)。見表2。
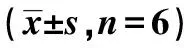
表2 消癥活絡方藥對TGF-β1誘導的HK-2細胞α-SMA和CTGF表達的影響
3 討 論
TGF-β1是公認的促纖維化因子〔9〕,5 ng/ml的TGF-β1刺激HK-2細胞,可誘導其增殖〔10〕。本實驗結果也證明了這一點,可見消癥活絡方藥可抑制TGF-β1誘導的HK-2細胞增殖。肌成纖維細胞被稱為腎纖維化的關鍵媒介,其被TGF-β1等細胞因子活化后分泌細胞外基質,如膠原蛋白和纖維連接蛋白〔11〕。α-SMA被認為是肌成纖維細胞的標志蛋白〔12〕,可以作為診斷腎纖維化程度的標準。正常HK-2細胞基本不表達α-SMA,當TGF-β1刺激后,發(fā)生小管上皮細胞向間充質細胞轉化(EMT)作用,轉化為肌成纖維細胞,隨著纖維化程度加重肌成纖維細胞增多,進而α-SMA表達增加。 EMT 主要包括下列4 個關鍵步驟〔13〕:(1)上皮細胞失去細胞間連接的特性;(2)新合成并表達α- SMA,以及細胞骨架蛋白肌動蛋白質actin的重新構建;(3)組織基底膜完整性破壞;(4)細胞遷移和浸潤能力增強等。EMT已經被證實是腎臟纖維形成的最初機制〔14〕。CTGF是TGF-β1的下游作用因子,TGF-β1活化可以增加CTGF表達,而CTGF可以刺激肌成纖維細胞增殖并能增加ECM合成,推動TGF-β1誘導的纖維化進程,被稱為成纖維細胞的引誘物。CTGF還可以從其他途徑產生,直接并獨立地誘導EMT〔15〕。本實驗結果證實TGF-β1可以刺激HK-2細胞表達α-SMA和CTGF,發(fā)生小管上皮細胞向間充質細胞轉化的作用,另外消癥活絡方藥可在一定程度上拮抗EMT作用。消癥活絡方藥含藥血清顯著減少了表達CTGF的陽性細胞數,空白血清卻無此作用,所以推斷CTGF是消癥活絡方藥拮抗EMT的一個作用點,可能通過TGF-β1/Smads途徑,減少CTGF的產生進而抑制肌成纖維細胞增殖并減少細胞外基質(ECM)合成,從而減輕腎纖維化的程度。
4 參考文獻
1遲雁青,林海英,張 濤,等.腎炎四味片可減輕5/6腎切除大鼠的腎臟纖維化〔J〕.第三軍醫(yī)大學學報,2013;35(2):127-31.
2Eddy AA.Progression in chronic kidney disease〔J〕.Adv Chronic Kidney Dis,2005;12(4):353-65.
3王 東,張 江,吳同茹,等.淫羊藿有效單體對活化的腎成纖維細胞株和系膜細胞株的影響〔J〕.中國中西醫(yī)結合腎病雜志,2012;13(11):956-9.
4Burns WC,Kantharidis P,Thomas MC,etal.The role of tubular epithelial-mesenchymal transition in progressive kidney disease〔J〕.Cells Tissues Organs,2007;185(1-3):222-31.
5宋純東,薛黎明.雷公藤多苷對早期糖尿病腎病大鼠腎小管上皮細胞Smad2的影響〔J〕.中國中西醫(yī)結合腎病雜志,2012;13(3):233-4.
6任韞卓,段惠軍,史永紅,等.p -Smad2/3、Smad7在大鼠實驗性腎間質纖維化模型中的表達〔J〕.基礎醫(yī)學與臨床,2006;26(8):871-6.
7Catania JM,Chen G,Parrish AR,etal.Role of matrix metalloproteinases in renal pathophysiologies.Am.Physiol〔J〕.Renal Physiol,2006;292:F905-11.
8Prudhomme GJ.Pathobiology of transforming growth factor (beta) in cancer,fibrosis and immunologic disease,and therapeutic considerations〔J〕.Lab Invest,2007;87:1077-91.
9王 東,何立群.健脾清化方有效單體對活化的腎成纖維細胞株和系膜細胞株增殖的影響〔J〕.細胞與分子免疫學雜志,2012;28(9):948-51.
10劉明龍,曾永祥,盧守燕,等.復腎顆粒對人腎小管上皮細胞TAK1表達的影響〔J〕.中成藥,2011;33(2):222-5.
11Shin DH,Park HM,Jung KA,etal.The NRF2-heme oxygenase-1 system modulates cyclosporin A-induced epithelial-mesenchymal transition and renal fibrosis〔J〕.Free Radi Biol Med,2010;48(8):1051-63.
12崔 瑾,王耀獻,孫衛(wèi)衛(wèi),等.和解聚散方對單側輸尿管梗阻大鼠腎組織α-SMA表達的影響〔J〕.中醫(yī)藥信息,2012;29(1):28-30.
13劉進穩(wěn),辛冰牧,慕 容,等.TRB3 在腎纖維化中的表達及其與上皮-間葉轉化的關系〔J〕.中國藥理學通報,2012;28(3):407-11.
14Radisky DC,Kenny PA,Bissell MJ.Fibrosis and cancer:do myo fibroblasts come also from epithelial cells via EMT cell〔J〕.Biochem,2007;101(4):830-9.
15Takakuta K,Fujimori A.Renoprotective properties of pirfenidone in subtotally nephrectomized rats〔J〕.Eur J Pharmacol,2010;629(1-3):118-24.

