解聚復腎寧對糖尿病大鼠腎組織基質金屬蛋白酶-9、金屬蛋白酶組織抑制劑-1表達的影響
邢 磊 焦穎華 田發明
(河北聯合大學附屬醫院老年病科,河北 唐山 063000)
糖尿病腎病(DN)是終末期腎病的主要病因,并且是糖尿病(DM)患者死亡的主要原因之一〔1,2〕。細胞外基質(ECM)合成及降解失衡在DN腎小球硬化中發揮重要作用〔3,4〕。基質金屬蛋白酶(MMP)及基質金屬蛋白酶組織抑制因子(TIMPs)系統是參與ECM降解的主要酶系,本研究旨在探討解聚復腎寧(JJFSN)對DM大鼠腎組織MMP-9及TIMP-1表達的影響,以探討其作用機制。
1 材料與方法
1.1藥物及試劑 鏈脲佐菌素(STZ)為ALEXIS公司產品;JJFSN由黃芪、生地黃、黃連、黃芩、丹參、葛根等12味中藥組成,制備成濃縮口服液,含生藥2 g/ml;厄貝沙坦為杭州賽諾菲安萬特民生制藥有限公司產品。MMP-9、TIMP-1兔多克隆抗體、山羊抗兔IgG抗體-HRP多聚體免疫組化檢測試劑、DAB顯色劑均為北京中杉金橋有限公司產品。
1.2實驗方法
1.2.1動物分組、模型的建立及給藥 選擇8 w齡體重200~220 g的健康雄性SD大鼠70只。用隨機數字表法將大鼠分為正常對照組10只和造模組60只。造模組用0.1 mmol/L無菌枸櫞酸鈉緩沖液(pH4.2,4℃)將STZ配成2%的溶液,大鼠禁食12 h后,按STZ 60 mg/kg劑量,左下腹腔單次注射。注藥后72 h尾尖取血測空腹血糖(FPG),血糖≥16.65 mmol/L者確定為DM成模大鼠,共成模51只。將成模DM大鼠隨機分成4組:模型組13只、JJFSN組13只、厄貝沙坦組12只、JJFSN+厄貝沙坦組13只。正常對照組大鼠腹腔注射等量無菌枸櫞酸鈉緩沖液,尾尖取血測血糖,血糖4.7~8.3 mmol/L者為正常,共10只。造模7 d后,JJFSN組用JJFSN按14.9 ml·kg-1·d-1灌胃;厄貝沙坦組用厄貝沙坦按50 mg·kg-1·d-1灌胃;解聚復腎寧+厄貝沙坦組用解聚復腎寧按14.9 ml·kg-1·d-1和厄貝沙坦按50 mg·kg-1·d-1灌胃。每日上午1次,正常對照組和模型組大鼠每日上午用等量蒸餾水灌胃。室溫18~20℃,相對濕度69%,12 h交替照明,大鼠自由飲水、進食。共喂養12 w。
1.2.2標本采集 實驗結束前1 d,用代謝籠留取24 h尿液,記錄總量,離心,-80℃冰箱保存。實驗結束,所有動物于空腹狀態稱體重(BW),10%水合氯醛腹腔麻醉,心臟取血,分離血清,-80℃冰箱保存;剖腹分離雙側腎臟,右腎用冰生理鹽水清洗,吸干水分,稱腎重(KW),左腎取少部分皮質制備1 mm3數塊,用4%戊二醛固定,待做透射電鏡觀察,取1/2腎組織放入4%多聚甲醛溶液中固定,待行病理和免疫組化。
1.2.3生化指標檢測方法 血糖、血肌酐(Scr)、尿素氮(BUN)、24 h尿白蛋白排泄率(UAER)用ROCHE MODULAR全自動生化分析儀測定。
1.2.4免疫組織化學方法 將石蠟包埋的腎組織制成厚4 μm切片,按照免疫組化二步法檢測腎組織MMP-9、TIMP-1的表達。以PBS代替一抗作為陰性對照。每個標本在400倍光鏡下隨機選取8個視野,采用Olympus公司圖像采集系統及北航醫學圖像分析管理系統進行半定量分析,染色陽性部位的深淺以平均光密度值表示。
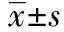
2 結 果
2.1各組大鼠一般狀態、BW、KW/BW和FPG比較 見表1。成模大鼠均出現多飲、多食、多尿、消瘦、毛發枯黃無光澤等DM表現,部分出現肢體感染、潰瘍和白內障等并發癥。模型組大鼠上述癥狀明顯,死亡3只,考慮死因為血糖過高引起酮癥酸中毒或感染,JJFSN組、厄貝沙坦組、JJFSN+厄貝沙坦組大鼠上述癥狀較輕,JJFSN組、厄貝沙坦組、JJFSN+厄貝沙坦組因灌胃各死亡2只。
2.2各組大鼠BUN、Scr和UAER比較 見表2。模型組與正常對照組比較,BUN、Scr、UAER均顯著增高,JJFSN組、厄貝沙坦組、JJFSN+厄貝沙坦組與模型組比較,BUN、Scr、UAER均明顯降低,JJFSN+厄貝沙坦組降低最顯著(P<0.01),JJFSN組與厄貝沙坦組之間差異無統計學意義(P>0.05)。
2.3各組大鼠腎臟形態學觀察 電鏡下,正常對照組大鼠足突細長整齊,基底膜厚度適中;模型組大鼠腎臟系膜區可見高電子密度沉積物,基底膜明顯增厚,足突融合;JJFSN組、厄貝沙坦組、JJFSN+厄貝沙坦組上述改變明顯輕于模型組。
2.4各組大鼠MMP-9、TIMP-1表達 見表2。正常對照組大鼠腎組織中均有明顯MMP-9表達,在腎小球、腎小管及間質可見明顯的棕黃色強陽性染色區;模型組MMP-9僅為弱陽性表達;JJFSN組MMP-9的表達較DM模型組強,為陽性表達,但較正常對照組弱,JJFSN組與厄貝沙坦組之間差異無統計學意義(P>0.05),JJFSN+厄貝沙坦組較JJFSN組、厄貝沙坦組表達上調更為顯著(P<0.01)。TIMP-1在正常對照組大鼠腎組織中可見少量棕黃色染色,為弱陽性表達;在模型組,腎小球、腎小管及間質均可見大量棕黃色染色,TIMP-1表達強陽性:JJFSN組TIMP-1的表達較正常對照組強,但較DM模型組弱,為陽性表達,JJFSN組與厄貝沙坦組之間差異無統計學意義,JJFSN+厄貝沙坦組較其他治療組表達下調更為顯著(P<0.01)。

表1 12 w后各組大鼠FPG、BW、KW、KW/BW變化情況

表2 12 w后各組大鼠BUN、 Scr、 UAER及腎組織MMP-9、TIMP-1平均光密度值
3 討 論
DM是以高血糖為特征的內分泌代謝性疾病,DM及其慢性并發癥的發生發展,與眾多細胞因子和酶活性的改變有關,DM導致的代謝異常可引起基底膜結構和功能發生改變,這些改變可使組織血管基底膜的降解與重構機制發生異常,而ECM作為血管壁的主要成分在這些生理病理過程中發揮重要作用。正常情況下,ECM處于不斷產生和不斷降解的動態平衡中,涉及ECM代謝最主要的酶系是MMPs/ TIM Ps。MMPs是一組具有類似結構和共同生物化學性質的金屬依賴性蛋白水解酶超基因家族,是ECM的主要降解酶系統,能降解除多糖以外的所有ECM成分,如膠原和彈性蛋白,其活性受TIMPs的調節。TIMPs為MMPs特異性組織抑制因子,能特異性與MMPs催化中心的Zn2+結合,封閉其催化活性。MMPs調節紊亂與DM的發生密切相關。生理狀態下MMPs/TIMPs處于一種動態平衡,共同維持ECM的正常代謝,而在DN時,由于高血糖、血脂代謝紊亂及蛋白非酶促糖基化作用等,這種平衡被打破,導致TIMPs表達上調和或MMPs表達下調,均可致ECM的合成增加,降解減少,而堆積〔5〕。其他細胞因子如TGF-β1不但可刺激基質成分合成增加,也可通過上調TIMPs表達、抑制MMPs表達,或使其活性降低,影響細胞外基質的正常代謝,導致ECM的積聚〔6〕。
而在眾多MMPS家族成員中,MMP-9能夠降解腎臟組織明膠和基底膜膠原,TIMP -1是MMP-9特異性的抑制因子,因此MMP-9及TIMP-1可能與DN的發生、發展最相關。研究認為,MMP-9可能通過兩種機制導致腎小球損傷:①誘導系膜細胞由靜止表型轉變為炎癥表型,出現快速增殖,表達新型蛋白,合成ECM增多,導致系膜基質堆積〔7〕;②可降解基底膜,破壞細胞與基質的正常連接,致腎小球正常結構破壞,影響腎小球ECM的重塑,促進蛋白尿的發生〔8〕。TIMP-1與MMP-9以1:l比例非共價鍵結合形成MMP-9-TIMP-1復合體,阻斷MMP-9與底物的結合和活化,兩者共同參與細胞外基質的降解過程〔9〕。Karamessinis等〔10〕研究發現高糖環境下人類近端腎小管上皮細胞中MMP-2 mRNA和MMP-9 mRNA表達下降,TIMP-1 mRNA表達升高,且2型糖尿病(T2DM)伴蛋白尿患者MMP-9和MMP-2釋放減少,表明局部MMP/TIMP失衡參與DM腎組織的重建過程。研究證實,重組人結締組織生長因子(rhCTGF)可增加組織金屬蛋白酶抑制劑TIMP-1、TIMP-3(尤其是TIMP-1)的表達,然而TIMP-1的增多則會抑制MMP-9的作用,從而阻止細胞外基質的降解〔11〕。
本實驗結果顯示,DM大鼠MMP-9在腎組織中表達明顯下調, TIMP-1表達上調,與Mc Lennan等〔7〕研究結果一致。機制可能是腎組織中MMP-9的表達在模型組明顯下調,而TIMP-1的表達在DM模型組明顯上調,形成病理狀態下新的平衡,這種新的平衡狀態導致MMP-9對ECM的降解減少,促使ECM在DM大鼠腎小球內的積聚,從而導致腎小球硬化,促使DN的發生和發展。解聚復腎寧可能是通過下調TIMP-1表達及上調MMP-9表達,促進腎小球細胞外基質的降解,從而達到延緩腎小球硬化的作用,其治療作用機制有待進一步研究。
4 參考文獻
1Schemthaner G.Kidney disease in diabetilogy:lessons from 2009〔J〕.Nephrol Dial Transplant,2010;25(2):360-3.
2Biesenbach G.Highest mortality during the last year before and the first year after start of dialysis treatment in type 2 diabetic patients with nephropathy〔J〕.Curr Diabetes Rev,2007;3(2):123-6.
3Guo B,Koya D,Isono M,etal.Peroxisome proliferator-activated receptor gamma ligands inhibit TGF-βl induced fibronectin expression in glomerular mesangial cells〔J〕.Diabetes,2004;53(1):200-8.
4Sang YH,Jee YH,Han KH,etal.An imbalance between matrix metalloproteinase-2 and tissue inhibitor of matrix metalloproteinase-2 contributes to the development of early diabetic nephropathy〔J〕.Nephrol Dial Thransplant,2006;21(9):2406-16.
5Banach M,Drozdz J,Okonski P,etal.Immunological aspects of the statins′function in patients with heart failure:a report from the Annual Conference of ESC-Heart Failure〔J〕.Cell Mol Immunol,2005;2(6):433-7.
6Bachorzewska-Gajewska H,Malyszko J,Sitniewska E,etal.Prevention of contrast-induced nephropathy in patients undergoing percutaneous coronary interventions in everyday clinical practice〔J〕.Arch Med Sci,2006;2:256-61.
7Mc Lennan SV,Kelly DJ,Cox AJ,etal.Decreased matrix degradation in diabetic nephropathy:effects of ACE inhibition on the expression and activities of matrix metalloproteinases〔J〕.Diabetologia,2002;45(2):268-75.
8Van Huyen JP,Vihard M,Nehiri T,etal.Expression of matrix metalloproteinases MMP-2 and MMP-9 is altered during nephrogenesis infetuses from diabetic rats〔J〕.Lab Invest,2007;87(7):680-9.
9Li YJ,Yang JW,Dai CS,etal.Role for integrin-linked kinase in mediating tubular epithelial to mesenchymal transition and renal interstitial fibrogenesis〔J〕.J Clin Invest,2003;(ll2):503-16.
10Karamessinis PM,Tzinia AK,Kitsiou PV,etal.Proximal tubular epithelial cell integrins respond to high glucose by altered cell matrix interactions and differentially regulate matrixin expression〔J〕.Lab Invest,2002;82(8):1081-93.
11Mclennan SV,Wang XY,Moreno V,etal.Connective tissue growth factor mediates high glucose effects on matrix degradation through tissue inhibitor of matrix metalloproteinase type 1:implications for diabetic nephropathy〔J〕.Endocrinology,2004;145(12):5646-55.

