PI3Kp110α在早期營養不良仔鼠海馬中的表達及其意義
陳 霞 王永紅 陳國俊 康卓君 王小林
(重慶醫科大學附屬第一醫院神經內科 重慶市神經病學重點實驗室,重慶 400016)
早期營養不良是成年后發生外周胰島素抵抗(IR)的重要危險因素〔1~5〕。而腦內胰島素信號系統與認知功能密切相關,腦內IR可致認知功能障礙〔6,7〕。有研究表明,早期營養不良可導致成年后子代認知功能下降〔8~10〕,但具體機制尚不明確。本實驗觀察仔鼠海馬胰島素信號通路中關鍵信號蛋白磷脂酰肌醇-3激酶(PI3K)的催化亞基p110α及其可能相關的信號下游分子β-淀粉樣蛋白(Aβ)1~42的表達量變化,探究生命早期營養不良對老年期認知功能的影響和可能機制。
1 材料與方法
1.1實驗動物 健康成年SD大鼠8只,雌性,清潔級,體重200~220 g,由重慶醫科大學實驗動物中心提供。
1.2主要試劑 兔抗PI3Kp110α單克隆抗體(美國Cell Signaling公司)、兔抗Aβ1~42多克隆抗體(英國Abcam公司)、抗β-actin小鼠單克隆抗體、BCA蛋白濃度測定試劑盒和超敏ECL化學發光試劑盒(江蘇碧云天生物技術研究所)、磷酸化蛋白提取試劑盒(南京凱基生物科技發展有限公司)、過氧化物酶標記羊抗小鼠IgG(武漢博士德生物工程有限公司)、羊抗兔IgG/HRP、免疫組化染色試劑盒和DAB顯色試劑盒(北京中杉金橋生物技術有限公司)、短效胰島素諾和靈R(丹麥諾和諾德公司)。
1.3方法
1.3.1早期營養不良模型的制備 將8只雌鼠按雌雄比例2∶1與雄鼠合籠后,以次日晨發現陰栓記為懷孕0 d,正常飼養14 d后,將孕鼠隨機分為正常對照組(NC組)和早期營養不良組(EM組),每組4只,單籠喂養于恒溫(20±2)℃、12 h∶12 h明暗交替的動物房內。采用Coupé等〔11〕造模方法:NC組不限量飲食。EM組僅給予50%NC組的食量,即E14-E21為12 g/d,E21-P6逐漸加量至22 g/d,P7-P13為27~31 g/d,P14~P21為 35~40 g/d。NC組和EM組每只母鼠均哺乳相同數量的仔鼠(8只)以保證每只仔鼠哺乳均衡。斷乳后留取其中的雄性仔鼠(NC組和EM組各16只)予正常飲食飼養至15月齡(動物飼料由重慶醫科大學實驗動物中心提供,含有16%蛋白質、3%脂肪、60%碳水化合物,維生素適量)。
1.3.2胰島素耐量試驗(ITT) 仔鼠9月齡、15月齡時,采用胰島素耐量試驗評估仔鼠外周胰島素敏感性〔12〕,若血糖下降幅度越小說明對胰島素越不敏感。仔鼠禁食過夜后,首先檢測尾靜脈空腹血糖(FPG)。然后腹腔注射胰島素(11 U/Kg,用生理鹽水稀釋),分別于15、30、60 min后檢測尾靜脈血糖。
1.3.3Morris水迷宮實驗 仔鼠15月齡時,應用Morris水迷宮實驗測定其空間學習記憶能力〔13〕。將水池壁的4個等距離點定義為東(E)、南(S)、西(W)、北(N),并貼上不同形狀的標記物。將平臺放于SW象限,低于水面1~2 cm。①定位航行實驗:訓練5 d,4次/d,每只仔鼠分別從4個不同點入水。用60 s內找到平臺的時間(逃避潛伏期)表示。②空間探索實驗:訓練1 d,撤去平臺,入水點為NE象限。記錄大鼠在30 s內游泳軌跡,分別計算其跨越平臺次數、平臺象限活動時間百分比。
1.3.4Western 印跡檢測海馬PI3Kp110α表達水平 分別取9月齡、15月齡仔鼠大腦海馬組織100 mg放入勻漿器,按照磷酸化蛋白提取說明書加入現配制好的裂解液0.5 ml,冰上低溫研磨充分后,離心取上清液,BCA法測定蛋白濃度,加入1/4蛋白體積的5×上樣緩沖液配制成終濃度為5 μg/μl的上樣蛋白,煮變性后備用。配8%的分離膠和5%的上層膠,每孔上樣15 μl,SDS-PAGE垂直電泳,PVDF膜轉膜140 min,5%牛血清白蛋白封閉60 min;分別加一抗PI3Kp110α單克隆抗體(1∶1 000)和抗β-actin小鼠單克隆抗體(1∶1 000),4℃孵育過夜后37℃復溫60 min,TBST洗膜;分別加HRP標記的羊抗兔IgG(1∶4 000)和羊抗小鼠IgG(1∶6 000)37℃孵育60 min,TBST洗膜;ECL試劑盒顯色。使用Quantity One軟件測定各條帶的平均光密度值,分別將PI3Kp110α與對應的β-actin顯色條帶的光密度值的比值作為PI3Kp110α蛋白的相對表達量。
1.3.5免疫組化(IHC)法檢測大腦PI3Kp110α、Aβ1~42表達水平 用10%水合氯醛(按0.35 ml/100 g腹腔注射)分別將9月齡、15月齡仔鼠麻醉,采用心臟灌注固定法,先生理鹽水后4%多聚甲醛溶液灌注,取腦、固定、石蠟包埋、制作切片。免疫組織化學采用SP法:石蠟切片常規脫蠟至水,3%H2O2孵育15 min,放入檸檬酸鈉(pH6.0)溶液中行熱修復,冷卻至室溫后用山羊血清液封閉30 min,再分別加一抗PI3Kp110α(1∶50)和Aβ1~42(1∶50),4℃過夜。PBS沖洗,滴加二抗后37℃孵育30 min,PBS沖洗,滴加HRP標記的鏈霉卵白素工作液并37℃孵育30 min,PBS沖洗,DAB顯色,蘇木素復染,1%鹽酸酒精分化,碳酸鋰返藍,脫水、透明、中性樹膠封片。以PBS代替一抗做陰性對照。每只仔鼠選取3張切片,每張切片隨機攝取3個視野,圖像采集后用Image-Pro Plus6.0軟件測定陽性物質的平均光密度值。
1.4統計學方法 采用SPSS19.0統計軟件進行t檢驗和方差分析。
2 結 果
2.1仔鼠出生時體質量 NC組仔鼠平均出生體質量為(7.99±1.03)g,明顯高于EM組〔(5.45±0.47)g,P<0.01〕。
2.2ITT 9月齡時,NC組與EM組的FPG無差異〔(4.83±0.33)mmol/L vs (5.06±0.32) mmol/L,P>0.05〕;腹腔注射胰島素后,EM組在15 min和30 min時平均血糖分別為FPG的86.94%和71.15%,下降幅度均小于NC組(P<0.05)。15月齡時,EM組的FPG于NC組〔(5.09±0.41) mmol/L比(4.55±0.46) mmol/L),P<0.05〕;EM組在30 min時平均血糖較FPG下降了25.39%,低于NC組的38.68%(P<0.01)。可見,EM組在不同時期外周胰島素敏感性均低于NC組。
2.3Morris 水迷宮實驗 定位航行實驗中,EM組逃避潛伏期較NC組明顯延長(P<0.05),見表2。空間探索實驗中,與NC組相比,EM組穿越平臺次數減少(1.13±0.64 vs 2.50±1.20,P<0.05),平臺象限活動時間百分比顯著減小〔(26.00±4.42)% vs (35.07±4.13)%,P<0.01〕。
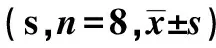
表2 兩組仔鼠逃避潛伏期的比較
2.4Western 印跡法檢測海馬PI3Kp110α的表達 9月齡時,EM組海馬PI3Kp110α的相對表達量明顯低于NC組〔(0.45±0.26)比(1.12±0.18),P<0.01〕。15月齡時,EM組也低于NC組〔(0.44±0.30)比(1.01±0.35),P<0.05〕。 見圖1。
2.5IHC檢測PI3Kp110α、Aβ1~42的表達。
2.5.1IHC檢測海馬PI3Kp110α的表達 PI3Kp110α的免疫組化結果與免疫印跡一致(圖2)。在不同月齡時,NC組海馬CA1區神經細胞內棕黃色陽性表達顆粒均多于EM組。
2.5.2IHC檢測 Aβ1~42的表達 15月齡時,EM組Aβ1~42在皮質和海馬表達的平均光密度值1.15±0.24、0.76±0.06,均高于NC組0.82±0.18、0.88±0.13,但差異沒有統計學意義(P>0.05)。見圖3。
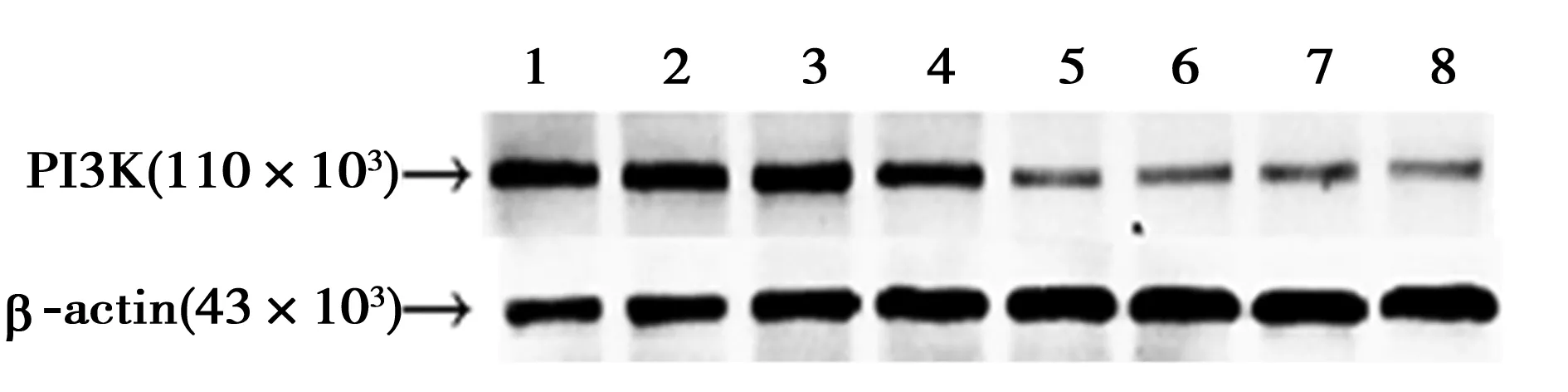
1,2:9月齡NC組;3,4:15月齡NC組;5,6:9月齡EM組;7,8:15月齡EM組
↑:示右下角放大400倍區域
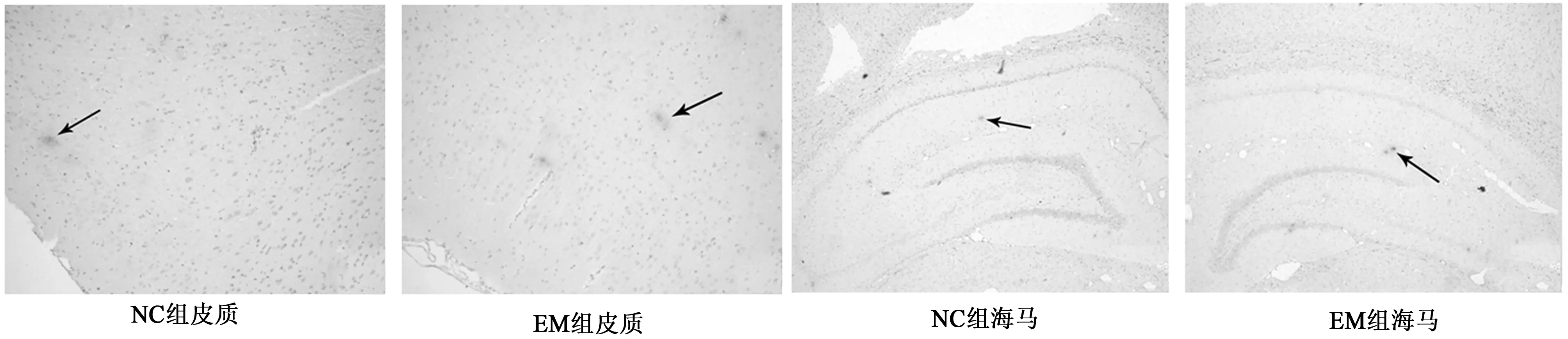
圖3 15月齡皮質大鼠及海馬Aβ1~42的表達(SP,×40)
3 討 論
生命早期遭受限量飲食可導致子代出生時體質量偏低,體質量是反映個體近期營養狀態的重要指標。本實驗采用圍生期母鼠限量飲食造模,實驗組出生時的平均體質量比對照組低約32%,說明實驗組仔鼠營養不良。早期營養不良可致胰島素信號傳導通路分子異常,胰島素信號傳遞受阻或減弱,最終導致IR的發生〔14〕。本實驗中ITT結果顯示,與對照組相比早期營養不良模型組仔鼠在9月齡和15月齡時,胰島素敏感性均降低,說明實驗組已存在外周IR。
腦內胰島素信號途徑可能與外周信號途徑相近,其中PI3K信號途徑是腦內胰島素受體后主要信號通路,該通路通過參與調節血糖平衡而影響大腦的新陳代謝、神經遞質的釋放和高級認知功能〔15,16〕,還可調節阿爾茨海默病(AD)病理學特征之一老年斑中Aβ的代謝〔17~19〕。PI3K是這一路徑中的關鍵信號蛋白,該蛋白由p85 調節亞基和p110 催化亞基形成異二聚體,其中發現p110α是PI3K家族中響應胰島素信號的最重要的分子。Sopasakis等〔18〕在肝臟中敲除p110α后導致胰島素敏感性和葡萄糖耐受降低。本研究結果顯示,早期營養不良組海馬中PI3Kp110α的表達量明顯低于正常組,這可能是產生中樞IR的分子機制之一。有研究表明,中樞IR源于外周IR〔19,20〕,這可能解釋了本實驗中早期營養不良發生中樞IR的原因。
早期營養影響成年后健康〔21〕,而神經系統的發育最易受早期營養狀況的影響。早期營養不良可導致成年后學習記憶下降等認知功能障礙〔8~10〕。本實驗研究表明,圍生期母鼠限量飲食可造成子代早期營養不良,成年后出現外周IR,并通過下調海馬PI3Kp110α的表達量誘導腦內IR,從而使學習記憶能力下降。由此可推斷,海馬PI3Kp110α表達量的異常可能是早期營養不良致老年期認知功能障礙的分子基礎,這為生命早期遭受食物短缺老年期發生認知功能障礙的人群提供了新的治療靶點。腦胰島素信號系統紊亂可能參與Aβ的聚集以及AD的形成〔20,22,23〕,但早期營養不良是否可通過腦IR而致AD的發生還需要進一步的研究。
4 參考文獻
1Li Y,Jaddoe VW,Qi L ,etal. Exposure to the Chinese famine in early life and the risk of metabolic syndrome in adulthood 〔J〕. Diabetes Care,2011;34(4) : 1014-8.
2Hales CN,Ozanne SE. For debate:fetal and early postnatal growth restriction lead to diabetes,the metabolic syndrome and renal failure 〔J〕. Diabetologia,2003;46(7):1013-9.
3Thorn SR,Rozance PJ,Brown LD,etal. The intrauterine growth restriction phenotype: fetal adaptations and potential implications for later life insulin resistance and diabetes〔J〕. Semin Reprod Med,2011;29(3):225-36.
4Barker DJ. The origins of the developmental origins theory 〔J〕. J Intern Med,2007;261(5):412-7.
5Yajnik CS ,Deshmukh US. Maternal nutrition,intrauterine programming and consequential risks in the offspring 〔J〕.Rev Endocr Metab Disord,2008;9(3): 203-11.
6Van der Heide LP,Ramakers GM,Smidt MP. Insulin signaling in the central nervous system: learning to survive〔J〕. Prog Neurobiol,2006;79(4):205-21.
7Schi?th HB,Craft S,Brooks SJ,etal. Brain insulin signaling and Alzheimer's disease: current evidence and future directions 〔J〕. Mol Neurobiol,2012;46(1):4-10.
8Zhang Y,Li N,Yang Z.Perinatal food restriction impaired spatial learning and memory behavior and decreased the density of nitric oxide synthase neurons in the hippocampus of adult male rat offspring〔J〕. Toxicol Lett,2010;193(2):167-72.
9De Rooij SR,Wouters H,Yonker JE,etal. Prenatal undernutrition and cognitive function in late adulthood〔J〕. Proc Natl Acad Sci U S A,2010;107(39):16881-6.
10Ranade SC,Rose A,Rao M,etal. Different types of nutritional deficiencies affect different domains of spatial memory function checked in a radial arm maze〔J〕. Neuroscience,2008;152(4):859-66.
11Coupé B,Dutriez-Casteloot I,Breton C,etal. Perinatal undernutrition modifies cell proliferation and brain-derived neurotrophic factor levels during critical time-windows for hypothalamic and hippocampal development in the male rat〔J〕. J Neuroendocrinol,2009;21(1):40-8.
12李 赟,裴麗娜,都 健,等.高脂喂養大鼠胰島素敏感性測定方法的評估〔J〕.實驗動物與比較醫學,2011;31(1):48-51.
13Vorhees CV,Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory〔J〕. Nat Protoc,2006;1(2):848-58.
14Jensen CB,Martin-Gronert MS,Storgaard H,etal. Altered PI3-kinase/Akt signalling in skeletal muscle of young men with low birth weight〔J〕.PLoS One,2008;3(11):e3738.
15Craft S.Insulin resistance and Alzheimer's disease pathogenesis: potential mechanisms and implications for treatment〔J〕. Curr Alzheimer Res,2007;4(2):147-52 .
16O′Neill C.PI3-kinase/Akt/mTOR signaling:impaired on/off switches in aging,cognitive decline and Alzheimer's disease〔J〕. Exp Gerontol,2013;48(7):647-53.
17De la Monte SM . Brain insulin resistance and deficiency as therapeutic targets in Alzheimer's disease〔J〕. Curr Alzheimer Res,2012;9(1):35-66.
18Sopasakis VR,Liu P,Suzuki R,etal. Specific roles of the p110α isoform of phosphatidylinsositol 3-kinase in hepatic insulin signaling and metabolic regulation〔J〕. Cell Metab,2010;11(3):220-30.
19Yamamoto N,Matsubara T,Sobue K,etal. Brain insulin resistance accelerates Aβ fibrillogenesis by inducing GM1 ganglioside clustering in the presynaptic membranes〔J〕. J Neurochem,2012;121(4):619-28.
20De la Monte SM. Insulin resistance and Alzheimer's disease〔J〕. BMB Rep,2009;42(8):475-81.
21Wells JC.The thrifty phenotype as an adaptive maternal effect〔J〕. Biol Rev Camb Philos Soc,2007;82(1):143-72.
22顧 萍,王 堅. 中樞神經系統胰島素代謝/信號轉導異常與阿爾茨海默病研究進展〔J〕.中國老年學雜志,2010;30(7):1006-9.
23Chua LM,Lim ML,Chong PR,etal. Impaired neuronal insulin signaling precedes Aβ42 accumulation in female AβPPsw/PS1ΔE9 mice〔J〕.J Alzheimers Dis,2012;29(4):783-91.

