老年女性原發乳腺浸潤性導管癌中FoxP3表達與淋巴結轉移的相關性
任偉民 張友元 董軍明 羅金芳 賀國慶 顧立新
(復旦大學附屬金山醫院病理科,上海 201508)
乳腺癌尤其是浸潤性導管癌是老年女性常見的惡性腫瘤之一〔1〕,發生轉移的乳腺癌預后相對較差,治療效果不夠滿意。叉頭狀轉錄因子3(FoxP3)是調節性T淋巴細胞(Treg)的特異性標記之一〔2〕,后者與乳腺癌密切相關,同時FoxP3作為轉錄因子本身亦發揮重要作用。本實驗通過檢測FoxP3蛋白在老年乳腺浸潤性導管癌及淋巴結轉移灶中的表達來探討其意義。
1 材料與方法
1.1標本 選取復旦大學附屬金山醫院病理科2009年1月至2011年12月外科手術切除的老年乳腺癌標本存檔蠟塊75例,所有病例均經病理切片證實為乳腺浸潤性導管癌非特殊類型,診斷標準嚴格按照WHO2003乳腺癌的分類且腋下淋巴結檢出數≥15枚〔3〕,所有病例均為女性,其中老年組(年齡>60歲)28例,平均年齡〔68.92±7.02(60~85)〕歲,11例伴腋下淋巴結轉移;老年前期組(>45歲,≤60歲)32例,平均年齡〔53.15±3.84(45~58)〕歲,9例伴腋下淋巴結轉移;青年期組(≤45歲)15例,平均年齡〔39.69±4.10(29~44)〕歲,5例伴腋下淋巴結轉移。
1.2試劑 鼠抗人FoxP3單克隆抗體(Santa Cruz公司,1∶50稀釋),HRP標記二抗、(DAB)顯色液、檸檬酸緩沖修復液(pH6.0)(均購自福州邁新生物技術公司)。
1.3方法 采用免疫組化EnVision兩步法,按照試劑盒規定步驟進行操作:常規石蠟切片脫蠟至水,3%過氧化氫3 min,檸檬酸緩沖液熱修復30 min,滴加一抗后4℃過夜,滴加二抗30 min,(DAB)顯色,所有步驟間均PBS沖洗,蘇木素襯染,中性樹膠封片。以PBS代替一抗作為陰性對照,以試劑盒的陽性圖片為陽性對照。
1.4結果判斷 FoxP3定位于Treg細胞的細胞核和癌細胞的細胞質或細胞核,以出現棕黃色顆粒為陽性。采用免疫組化分數進行半定量分析〔4〕。每張切片觀察10個高倍視野,分別給予陽性評分。 癌細胞:按染色強度分為0分(無染色)、1分(淡黃色)、2分(棕黃色)和3分(棕褐色);按染色比例分為0分(<5%)、1分(5%~25%)、2分(26%~50%)、3分(51%~75%)、4分(>75%)。兩者分數相加計算總分,≤6為低表達,>6為高表達。 FoxP3+淋巴細胞(Treg)評分:0分,無陽性細胞;1分,≤3個視野,每視野1~3個陽性細胞;2分,>3個視野,每視野1~3個陽性細胞;3分,>3個視野,每視野>3個陽性細胞。0分和1分為低表達,2分和3分為高表達。
1.5統計學方法 采用Stata8.0統計學軟件進行統計分析,數據采取χ2檢驗及Fisher精確概率法,相關性采用Spearman相關分析。
2 結 果
2.1不同年齡組乳腺浸潤性導管癌癌組織中FoxP3的表達 三個年齡組相比較,癌組織FoxP3和癌周FoxP3+淋巴細胞總體表達有差異(P<0.05),與青年組相比,老年組顯示癌組織FoxP3表達升高,同時癌周FoxP3+淋巴細胞數也高表達(P<0.05),但相較老年前期病例組,老年組癌組織FoxP3及癌周FoxP3+淋巴細胞均與其未顯示統計學差異(P>0.05)。見表1。
2.2不同年齡組乳腺浸潤性導管癌原發灶及淋巴結轉移灶中FoxP3蛋白的差異表達 三個年齡組中,淋巴結轉移灶癌細胞FoxP3表達及FoxP3+淋巴細胞數量高于相應原發灶,但老年前期及青年期組未顯示統計學差異,而老年組差異有統計學意義(P<0.05)。見表2,圖1。
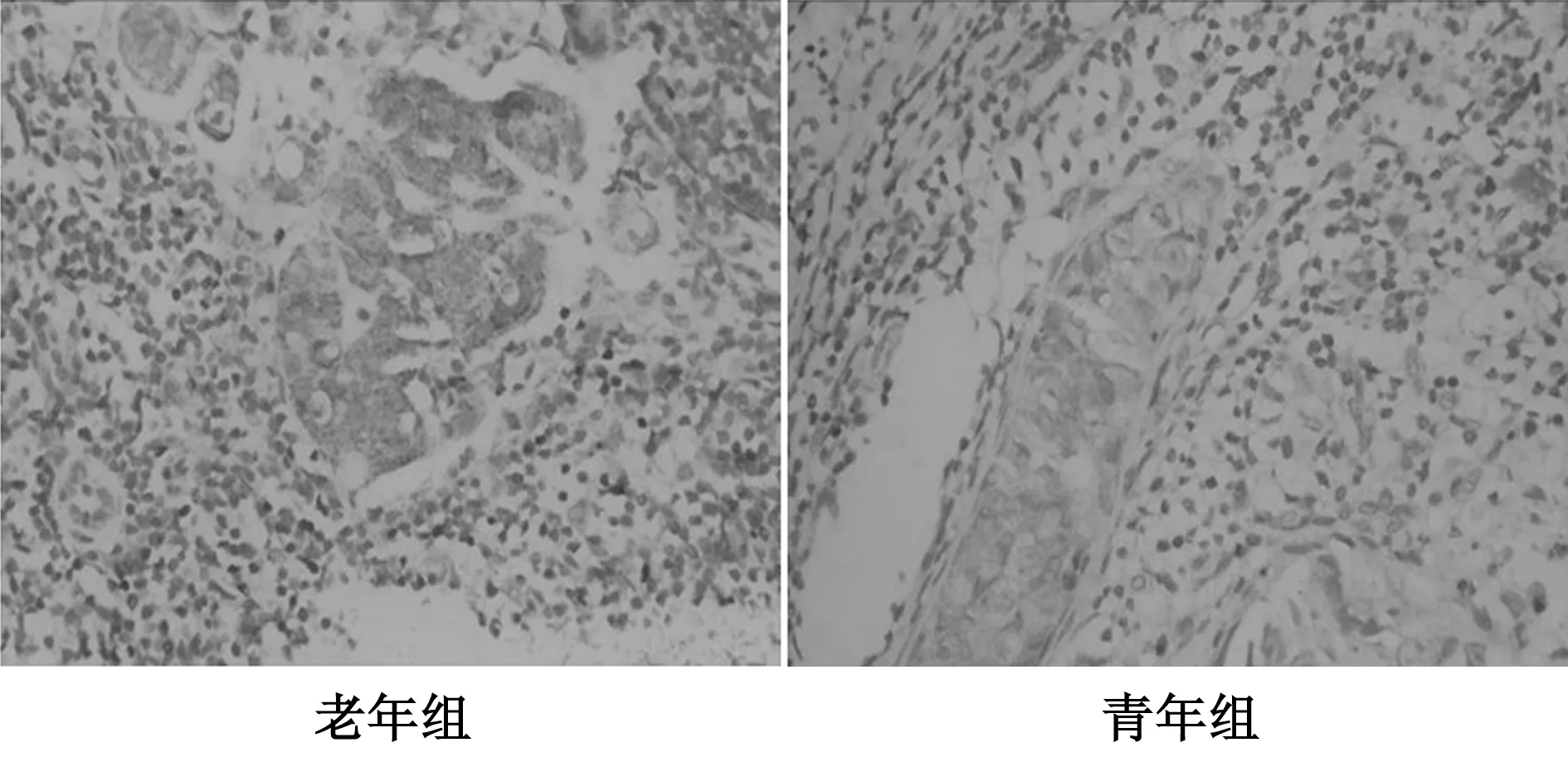
圖1 不同年齡組乳腺癌淋巴結轉移灶中FoxP3表達(EnVision法,×400)
2.3FoxP3表達與老年乳腺浸潤性導管癌臨床病理特征的關系 癌組織FoxP3的表達與淋巴結轉移、Her2表達呈統計學正相關(P<0.05),與ER呈負相關(P<0.05),與組織學分級、腫瘤大小和PR未顯示統計學相關(P>0.05);癌周浸潤的FoxP3+淋巴細胞與淋巴結轉移、Her2呈統計學正相關,與ER、PR表達呈負相關(P<0.05),與組織學分級、腫瘤大小未發現統計學相關(P>0.05)。見表3。
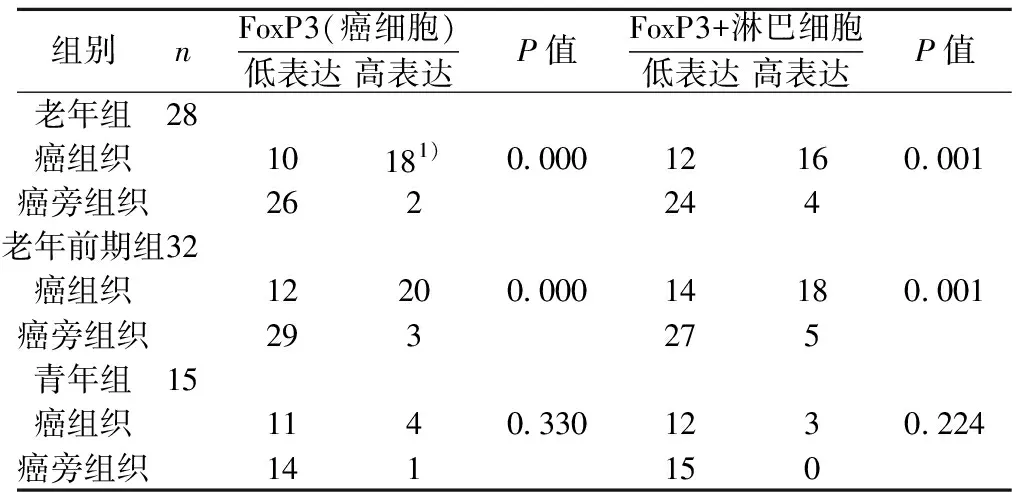
表1 乳腺浸潤性導管癌癌組織中FoxP3的表達(n)
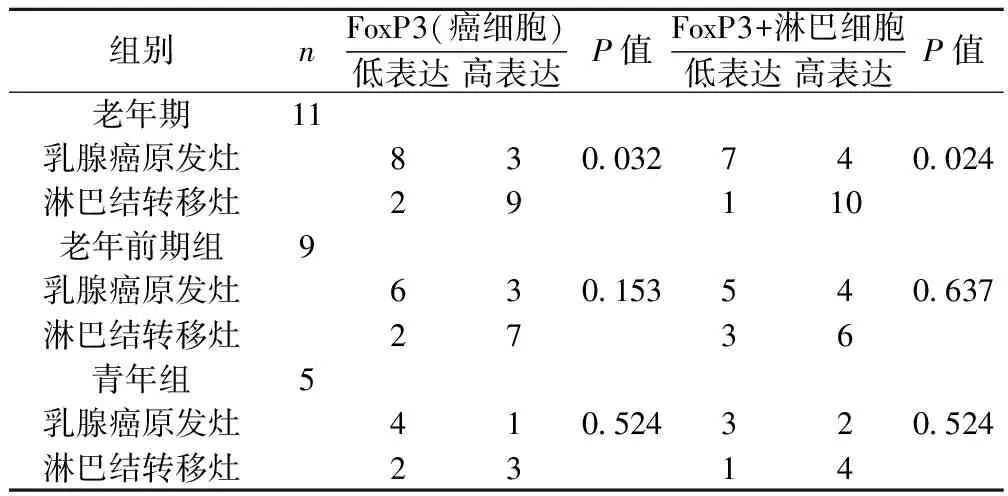
表2 乳腺浸潤性導管癌淋巴結轉移灶及對應原發灶中FoxP3蛋白的表達(n)
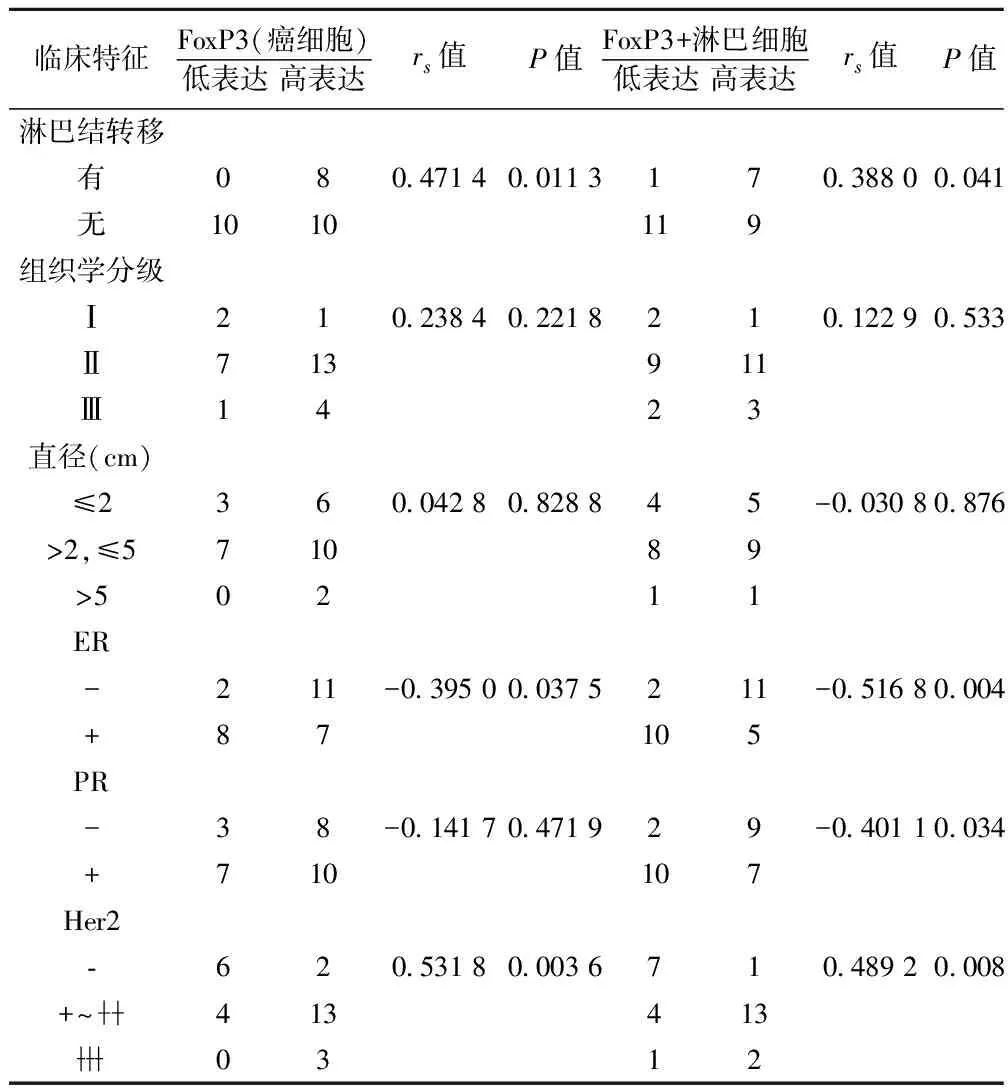
表3 FoxP3表達與老年乳腺浸潤性導管癌臨床病理特征的關系(n)
3 討 論
FoxP3與Treg的分化決定和功能密切相關,最初對其研究集中在自身免疫性疾病方面,隨著研究深入,大量事實表明Treg在腫瘤免疫抑制方面發揮了重要作用。在多種惡性腫瘤中均發現Treg的存在,乳腺癌中Treg與其預后相關性也得到證實〔5〕。目前認為Treg主要分為3個亞群:CD4+Treg細胞、CD8+Treg細胞和γδ-TCR,而CD4+Treg又進一步分為自然發生的CD4+CD25+FoxP3+ Treg、抗原誘導的CD4+CD25+FoxP3+ Treg和CD4+FoxP3-Trl細胞〔6〕。乳腺癌中FoxP3+Treg增多被認為是機體對乳腺癌惡性轉化的反應,并且被作為腫瘤進展的指標〔7〕。多種因子能夠直接或間接與Treg反應而發揮功能作用,TGF通路是Treg較為重要的作用機制之一,在腫瘤進展尤其是轉移過程中極大地影響了腫瘤細胞的擴散能力。首先Treg表達細胞因子受體CCR4,受其配體CCL5、CCL17、CCL22等因子吸引聚集到腫瘤部位,激活后分泌大量TGF-β,后者通過各種途徑加速腫瘤進展,比如介導血管內皮生長因子(VEGF)高表達從而促進腫瘤血管生成〔8〕,Treg還與某些癌基因存在相互作用,如K-ras等,但具體機制尚不明確。
目前研究發現FoxP3還是X染色體連鎖的抑制基因,表達于多種惡性腫瘤細胞,包括乳腺癌、肺癌、腸癌、黑色素瘤等〔9〕,在乳腺癌細胞上表達的FoxP3與預后相關,尤其是乳腺癌淋巴轉移者〔10〕。作為一種轉錄因子,FoxP3具有多種作用影響癌細胞的生長,近期研究認為FoxP3對乳腺癌癌基因SKP2和Her2存在轉錄抑制作用〔11,12〕。盡管FoxP3通常與乳腺癌不良預后相關,但最近有研究發現在Her2過表達的乳腺癌亞型中,FoxP3陽性表達與預后較好相關,具有獨立的預后意義,其機制可能是通過抑制乳腺癌Her2的轉錄表達從而一定程度上對抗癌基因Her2的相關作用,抑制癌細胞生長,對乳腺癌發揮調節作用〔3〕,提示腫瘤本身的特性是FoxP3發揮作用的基礎。與吲哚胺2,3-雙加氧酶(IDO)的協同作用也是可能的促進淋巴結轉移的機制〔13〕。
FoxP3促進乳腺癌淋巴轉移的機制目前尚未明確,可能從兩方面起作用:一方面FoxP3+淋巴細胞(Treg)具有免疫抑制的作用,可通過細胞與細胞間直接接觸或通過分泌某些炎癥調節因子來間接調節,升高的Treg對機體的抗瘤免疫產生抑制,促進了癌組織的免疫逃避從而較容易發生轉移。另一方面,乳腺癌組織表達的FoxP3可連接癌細胞表達化學因子受體CCR7和CXCR4,上調其轉錄、表達〔10〕,促進乳腺癌的浸潤和轉移。
國內目前尚未針對乳腺癌原發灶與淋巴結轉移灶進行對比研究,本實驗發現癌組織FoxP3蛋白表達及癌周FoxP3+淋巴細胞在老年患者中均有所升高,一個可能的原因是隨著年齡增加,免疫系統的功能逐漸減弱,導致乳腺癌患者腫瘤免疫效能偏低下。一些國外研究顯示FoxP3+淋巴細胞與ER、PR負相關,與組織分級、淋巴結轉移、Her2正相關〔14,15〕,FoxP3的mRNA也檢測到在PR陰性或Her2陽性的乳癌中高表達〔16〕,但是否FoxP3的表達具有一定的區域人群間差異尚不明確,有待進一步的研究。相對原發灶而言,淋巴結轉移灶內FoxP3+淋巴細胞(Treg)增多,預示組織局部免疫狀態的改變,同時轉移灶中癌組織本身FoxP3蛋白也表達升高,提示FoxP3可能與乳腺浸潤性導管癌淋巴結轉移相關聯,可以作為老年女性發生淋巴轉移的乳腺浸潤性導管癌的治療靶點之一,反之,在作靶向治療時也要考慮到原發灶與轉移灶之間的差異性,制定合理的化療、放療方案。盡管FoxP3和FoxP3+淋巴細胞作為重要的因素影響乳腺癌的發生發展和浸潤轉移,但是并非單獨發揮作用,許多復雜的機制參與乳腺癌的發生發展過程中,將FoxP3作為影響老年乳腺癌淋巴結轉移的唯一指標而進行處置是不可取的。
4 參考文獻
1Benz CC.Impact of aging on the biology of breast cancer〔J〕.Crit Rev Oncol Hematol,2008;66(1):65-74.
2Feuerer M,Hill JA,Mathis D,etal.Foxp3+ regulatory T cells:differentiation,specification,subphenotypes〔J〕.Nat Immunol,2009;10(7):689-95.
3Tavassoli FA,Devilee P.Pathology and genetics of tumours of the breast and female genital organs.World Health Organization Classification of Tumours〔M〕.Lyon:IARC Press,2003:19-23.
4Ladoire S,Arnould L,Mignot G,etal.Presence of Foxp3 expression in tumor cells predicts better survival in HER2-overexpressing breast cancer patients treated with neoadjuvant chemotherapy〔J〕.Breast Cancer Res Treat,2011;125(1):65-72.
5Bates GJ,Fox SB,Han C,etal.Quantification of regulatory T cells enables the identification of high-risk breast cancer patients and those at risk of late relapse〔J〕.J Clin Oncol,2006;24(34):5373-80.
6Watanabe MA,Oda JM,Amarante MK,etal.Regulatory T cells and breast cancer:implications for immunopathogenesis〔J〕.Cancer Metastasis Rev,2010;29(4):569-79.
7Gupta S,Joshi K,Wig JD,etal.Intratumoral FOXP3 expression in infiltrating breast carcinoma:its association with clinicopathologic parameters and angiogenesis〔J〕.Acta Oncol,2007;46(6):792-7.
8Wilson TJ,Nannuru KC,Futakuchi M,etal.Cathepsin G-mediated enhanced TGF-beta signaling promotes angiogenesis via upregulation of VEGF and MCP-1〔J〕.Cancer Lett,2010;288(2):162-9.
9Karanikas V,Speletas M,Zamanakou M,etal.Foxp3 expression in human cancer cells〔J〕.J Transl Med,2008;6:19.
10Merlo A,Casalini P,Carcangiu ML,etal.FOXP3 expression and overall survival in breast cancer〔J〕.J Clin Oncol,2009;27(11):1746-52.
11Zuo T,Liu R,Zhang H,etal.FOXP3 is a novel transcriptional repressor for the breast cancer oncogene SKP2〔J〕.J Clin Invest,2007;117(12):3765-73.
12Zuo T,Wang L,Morrison C,etal.FOXP3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene〔J〕.Cell,2007;129:1275-86.
13Kodama J,Hasengaowa,Kusumoto T,etal.Association of CXCR4 and CCR7 chemokine receptor expression and lymph node metastasis in human cervical cancer〔J〕.Ann Oncol,2007;18(1):70-6.
14Mansfield AS,Heikkila PS,Vaara AT,etal.Simultaneous Foxp3 and IDO expression is associated with sentinel lymph node metastases in breast cancer〔J〕.BMC Cancer,2009;9:231.
15Liu F,Lang R,Zhao J,etal.CD8+ cytotoxic T cell and FOXP3+ regulatory T cell infiltration in relation to breast cancer survival and molecular subtypes〔J〕.Breast Cancer Res Treat,2011;130(2):645-55.
16Ohara M,Yamaguchi Y,Matsuura K,etal.Possible involvement of regulatory T cells in tumor onset and progression in primary breast cancer〔J〕.Cancer Immunol Immunother,2009;58(3):441-7.

