人參皂甙對氯胺酮麻醉后老年大鼠學習記憶功能的影響
鄧 昌 歐陽波 陶 然 余順治 金 華
(昆明市官渡區人民醫院急診科,云南 昆明 650200)
術后認知功能障礙(POCD)可導致患者喪失獨立生活的能力,給家庭和社會造成嚴重的負擔。氯胺酮為N-甲基-D-天門冬氨酸(NMDA)受體的非競爭性拮抗劑,是一種臨床上常用的靜脈麻醉藥。研究發現,氯胺酮能損害大腦的神經細胞,引發POCD的產生〔1,2〕。目前還沒有一個公認的治療或預防POCD的方法。人參是我國傳統的中藥,其主要活性成分人參皂甙對老齡動物的神經系統具有良好的改善及保護作用。人參皂苷的成分如人參皂甙Rg1和Rb1能促進膽堿能代謝,改善中樞膽堿能系統,增強動物的學習和記憶能力〔3〕。人參皂甙還能通過增加大腦神經營養因子的表達,發揮神經保護作用。研究發現,人參皂甙對電休克、腦缺血和睡眠剝奪等造成的動物學習記憶功能受損均有顯著性地保護作用〔4~6〕。然而,人參皂甙對麻醉術后學習和記憶障礙的影響,目前報道較少。本實驗將通過Morris水迷宮實驗,探討人參皂甙對氯胺酮麻醉后老年大鼠學習記憶的影響及其可能的機制,為臨床防治POCD提供理論依據與參考。
1 資料與方法
1.1實驗動物 14月齡的清潔級健康SD大鼠48只,體重400~450 g,由昆明醫學院實驗動物中心提供。大鼠在實驗前適應性馴養1 w,自由攝食飲水。
1.2實驗藥品及儀器 鹽酸氯胺酮注射液(購自福建古田藥業有限公司,批號:110301-2);人參皂苷(購自吉林省集安萬泰中藥廠);Morris水迷宮儀(由北京普升科技有限公司提供);神經生長因子(NGF)和腦源性神經營養因子(BDNF)檢測試劑盒(Rapidbio公司進口分裝)。
1.3動物分組及處理 隨機分為四組,每組12只:對照組(A組)、氯胺酮組(B組)、人參皂甙低劑量組(C組)和人參皂甙高劑量組(D組)。A組:第1天(D0)腹腔注射生理鹽水,第2天(D1)至第6天(D5)無藥物處理。B組:第1天(D0)腹腔氯胺酮(80 mg/kg),從第2天(D1)開始每日腹腔注射生理鹽水,持續至D5。C組:第1天(D0)腹腔氯胺酮(80 mg/kg),從第2天(D1)開始每日腹腔注射人參皂甙(20 mg/kg),持續至D5。D組:第1天(D0)腹腔氯胺酮(80 mg/kg),從第2天(D1)開始每日腹腔注射人參皂甙(100 mg/kg),持續至D5。
1.4水迷宮實驗 Morris水迷宮由一個直徑130 cm、高50 cm的圓形水池及一個直徑為12 cm的圓柱形玻璃平臺構成。池壁分為4個象限,標有4個入水點。實驗前水池注入水至水平面高于平臺頂1 cm。實驗過程中保持環境的安靜,水溫控制在(23±2)℃。實驗過程參照參考文獻進行,分為兩部分:(1)定位航向實驗,D0于麻醉前讓大鼠自由游泳2 min,熟悉迷宮環境。從D1起,每天注射藥物2 h后,對大鼠進行4次訓練,每次訓練間隔60 s。從4個不同入水點將大鼠面向池壁分別放入水中,記錄大鼠爬上平臺所需的時間(即逃避潛伏期),找到平臺后,讓大鼠停留于平臺上10 s。如果在2 min內大鼠未找到平臺,則人為地將其引至平臺上停留10 s,此時潛伏期記為120 s。(2)空間探索實驗:在D5最后一次訓練后,撤除平臺,在同一入水點將大鼠面向池壁放入水中,測量大鼠在120 s內跨過原平臺位置的次數。
1.5海馬區神經營養因子的檢測 Morris水迷宮實驗結束后,斷頭開顱取腦,將海馬組織用4℃生理鹽水迅速制成1∶9勻漿液,3 000 r/min離心15 min,取上清液,用于NGF和BDNF含量的檢測。NGF和BDNF的檢測采用ELISA法。操作過程嚴格按照試劑盒說明書的要求進行。
1.6海馬區p-ERK和p-CREB表達水平的檢測 Morris水迷宮實驗結束后,斷頭開顱取腦,分離海馬組織,放入玻璃研磨器中磨碎為分散的細胞。加入0.5 ml的細胞裂解液(0.1 mmol/L NaCl,0.1 mmol/L Tris-HCl pH 7.6,1 mmol/L EDTA pH 8.0,1 μg/ml Aprotinin,100 μg/ml PMSF)冰上裂解45 min,15 000 r/min離心15 min,取上清液,-80℃保存,用蛋白免疫印記法檢測p-ERK和p-CREB的表達水平。具體過程如下:BCA法行蛋白定量分析。根據目的蛋白的分子量,配制12%十二烷基硫酸鈉-聚丙烯酰胺凝膠進行電泳分離后,將蛋白質電轉至PVDF膜中。用15 ml含有5%牛血清白蛋白的TTBS緩沖溶液4℃封閉過夜。然后分別加入ERK (1∶1 000)、 p-ERK(1∶500)、CREB (1∶1 000)和p-Ser133-CREB(1∶500)的一抗封閉1 h。TTBS洗膜3次,每次5 min,加入辣根過氧化物酶偶聯的IgG抗體,于室溫輕搖1 h雜交反應,TTBS洗膜6次,每次5 min。加入化學發光底物反應5 min后保鮮膜包裹,暗室內進行X線膠片曝光、顯影和定影。
2 結 果
2.1定位航向實驗結果 經過5 d的隱匿平臺訓練,各組逃避潛伏期呈逐漸縮短的趨勢。D1和D2時各組間均無顯著差異;D3~D5,與A組相比,B組尋找平臺的逃避潛伏期明顯延長(P<0.05);與B組相比,C組的逃避潛伏期于D4時縮短明顯,而D組的逃避潛伏期于D3時已開始顯著縮短。見表1。
2.2空間探索實驗結果 氯胺酮麻醉后各組大鼠穿越原平臺位置的次數與A組(6.8±0.5)相比均有所減少,其中B組(3.8±0.4)差異顯著(P<0.05)。C組(4.2±0.6)和D組(5.9±0.5)大鼠穿越原平臺位置的次數均明顯比B組增加(P<0.05)。
2.3各組大鼠海馬區神經營養因子表達水平的變化 與A組相比,B組大鼠海馬勻漿中NGF和BDNF的含量下降(P<0.01);與B組比較,C組和D組NGF和BDNF的含量均明顯增加(P<0.05)。見表2。
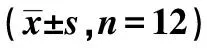
表1 各組大鼠不同時間點逃避潛伏期的變化

表2 各組大鼠海馬區NGF和BDNF的表達變化
2.4各組大鼠海馬CREB、p-Ser133-CREB的表達變化 蛋白免疫印跡結果顯示,與A組相比,B組大鼠海馬總CERB蛋白表達無顯著性差異,B組海馬p-Ser133-CREB的蛋白表達水平顯著降低(P<0.05)。與B組比較,C組和D組海馬p-Ser133-CREB的蛋白表達水平均顯著增加(P<0.05)。見圖1。
2.5各組大鼠海馬ERK、p-ERK的表達變化 蛋白免疫印跡結果顯示,與A組相比,B組大鼠海馬總ERK蛋白表達無顯著性差異,B組海馬p-ERK的蛋白表達水平顯著降低(P<0.05)。與B組比較,C組和D組海馬p-ERK的蛋白表達水平均顯著增加(P<0.05)。見圖2。

圖1 人參皂甙對海馬區CREB活性的影響

圖2 人參皂甙對海馬區ERK活性的影響
3 討 論
神經營養因子是一類對神經組織起著特殊營養作用的小分子多肽因子,在中樞神經系統的發育過程中能夠促進神經細胞的增殖、生長、分化和存活,并可調節突觸的可塑性,其中以NGF和BDNF最為重要。NGF通過與特異性的TrkA受體結合,激活細胞代謝,促進神經細胞的增殖和分化,調節中樞和周圍神經細胞的存活和軸突的生長, 并對神經細胞損傷的修復起著十分重要的作用。而BDNF通過與其特異性的高親和力受體TrkB結合而發揮神經營養作用。隨著研究的深入,研究發現神經營養因子在改善認知功能方面具有十分重要的作用〔7,8〕。NGF和BDNF可以改善老年癡呆模型鼠的學習記憶能力,促進神經元的生長〔9〕。研究證實,氯胺酮會導致認知功能障礙〔10〕。本研究顯示氯胺酮所致的認知功能障礙與其引起的神經營養因子減少有關。人參皂甙可通過增加NGF和BDNF的水平改善氯胺酮所致的學習記憶障礙:①在成熟的神經系統中,NGF和BDNF具有維持神經細胞生存的作用;而在神經系統損傷的情況下其具有神經保護與修復的功能。研究發現,氯胺酮可導致神經細胞的凋亡〔11~13〕。因此,人參皂甙可能通過維持NGF和BDNF表達水平,以維持神經細胞的存活,抑制細胞凋亡,從而改善氯胺酮所致的學習記憶障礙。②乙酰膽堿是中樞膽堿能神經系統的一種重要遞質,參與注意力、記憶和睡眠等過程〔14,15〕。擬膽堿能藥物或海馬區內移植膽堿能胚胎組織均可改善學習記憶功能。NGF的缺失會導致膽堿能神經元發生皺縮,減少膽堿能神經元的纖維密度,降低乙酰膽堿轉移酶和乙酰膽堿的含量〔16〕。NGF和BDNF表達水平的增加能夠促進神經遞質如乙酰膽堿的合成,并對膽堿能神經元起營養作用,改善動物的學習記憶能力。本實驗研究發現,人參皂甙可以阻止氯胺酮所致NGF和BDNF表達水平的減少。因此,人參皂甙可能通過維持NGF和BDNF表達水平,以維持膽堿能神經元的活性,并增加乙酰膽堿的含量,從而改善氯胺酮所致的學習記憶障礙。
cAMP反應元件結合蛋白(CREB)是一種重要的核轉錄因子,具有調節包括學習記憶在內的廣泛的生物學功能〔17〕。當CREB的第133位絲氨酸發生磷酸化時,磷酸化的CREB即成為活性狀態,從而調節啟動子中具有cAMP應答元件的基因轉錄。在中樞神經系統中,CREB參與突觸可塑性和長時程記憶的形成過程。CREB表達量或活性的下降會導致學習記憶障礙,而CREB的高表達可改善學習記憶功能。研究發現,許多與學習記憶相關的基因都受到CREB的調控,如神經遞質受體亞基GluR1、BDNF和即早基因等。CREB的活性受到多條信號轉導通路的調節,如cAMP-PKA通路、有絲分裂原激活的蛋白激酶通路、鈣離子-鈣調蛋白激酶通路和應激相關的P38通路。已有研究發現,氯胺酮所致的學習記憶障礙與其對ERK和CREB活性的抑制有關〔18,19〕。而本實驗研究發現,氯胺酮可降低老年大鼠海馬區內p-ERK和p-CREB的表達水平;而人參皂甙可以阻止氯胺酮對p-ERK和p-CREB的抑制作用。因此,人參皂甙可能通過增加NGF和BDNF表達水平,激活ERK-CREB信號通路,以增加學習記憶相關基因(如NGF、BDNF、c-fos等)的表達,從而改善氯胺酮所致的學習記憶障礙。
人參皂甙是人參的主要活性成分,具有多種生物學活性,如抗氧化作用、抗凋亡作用、抗興奮性毒害和鈣通道拮抗作用等。近年研究發現,人參皂甙還具有神經營養和神經保護作用,能夠增強學習記憶,抵抗衰老。學習和記憶是一個十分復雜的神經活動過程,需要神經遞質、信號分子、神經營養因子和基因表達的協同作用。人參皂甙能增加基底前腦乙酰膽堿轉移酶及海馬區內NGF和BDNF的表達〔20,21〕。在NGF缺失下,人參皂甙可以促進PC12細胞軸突的生長〔22〕。本實驗結果發現,人參皂甙對氯胺酮麻醉后老年大鼠學習記憶功能的改善作用,與其恢復氯胺酮導致海馬區NGF和BDNF的低表達及p-ERK和p-CREB的低活性有關。然而,人參皂甙是否還可以通過其他途徑(如抗氧化和抗凋亡等)改善氯胺酮所致的學習記憶障礙,其機制如何,還有待進一步研究。綜上所述,人參皂甙可用于POCD的防治。
4 參考文獻
1Green SM,Cote CJ.Ketamine and neurotoxicity:clinical perspectives and implications for emergency medicine〔J〕.Ann Emerg Med,2009;54(2):181-90.
2Zou X,Patterson TA,Sadovova N,etal.Potential neurotoxicity of ketamine in the developing rat brain〔J〕.Toxicol Sci,2009;108(1):149-58.
3Rudakewich M.人參皂苷Rb1與Rg1的神經營養與神經保護作用〔J〕.國外醫藥:植物藥分冊,2002;17(3):121.
4倪小虎,白 冰.人參根和莖葉皂甙對大鼠學習記憶障礙改善作用研究〔J〕.時珍國醫國藥,2000;11(9):773-5.
5楊國愉,皇甫恩,張大均,等.人參皂甙對睡眠剝奪大鼠學習記憶和活動性的影響〔J〕.中國臨床心理學雜志,2007;15(1):81-4.
6劉紅梅,李瑞雪,楊學軍,等.人參皂甙的神經保護作用和機制及其在神經變性疾病中的應用〔J〕.大連醫科大學學報,2009;31(5):595-8.
7Walz R,Roesler A,Reinke R,etal.Short- and long-term memory are differentialy modulated by hippocampal nerve growth factor and fibroblast growth factor〔J〕.Neurochem Res,2005;30(2):185-90.
8D′Intino G,Paradisi M,Fernandez M,etal.Cognitive deficit associated with cholinergic and nerve growth factor down-regulation in experimental allergic encephalomyelitis in rats〔J〕.Proc Natl Acad Sci U S A,2005;102(8):3070-5.
9Schindowski K,Belarbi K,Buee L.Neurotrophic factors in Alzheimer′s disease:role of axonal transport〔J〕.Genes Brain Behav,2008;7(Suppl 1):43-56.
10Goulart BK,De Lima MN,De Farias CB,etal.Ketamine impairs recognition memory consolidation and prevents learning-induced increase in hippocampal brain-derived neurotrophic factor levels〔J〕.Neuroscience,2010;167(4):969-73.
11Takadera,T,Ishida A,Ohyashiki T.Ketamine-induced apoptosis in cultured rat cortical neurons〔J〕.Toxicol Appl Pharmacol,2006;210(1-2):100-7.
12Shang Y,Wu Y,Yao S,etal.Protective effect of erythropoietin against ketamine-induced apoptosis in cultured rat cortical neurons:involvement of PI3K/Akt and GSK-3 beta pathway〔J〕.Apoptosis,2007;12(12):2187-95.
13Beals JK,Carter LB,Jevtovic-Todorovic V.Neurotoxicity of nitrous oxide and ketamine is more severe in aged than in young rat brain〔J〕.Ann N Y Acad Sci,2003;993:115;discussion 123-4.
14Micheau J,Marighetto A.Acetylcholine and memory:a long,complex and chaotic but still living relationship〔J〕.Behav Brain Res,2011;221(2):424-9.
15van Waarde A,Ramakrishnan NK,Rybczynska AA,etal.The cholinergic system,sigma-1 receptors and cognition〔J〕.Behav Brain Res,2011;221(2):543-54.
16Hartikka J,Hefti F.Development of septal cholinergic neurons in culture:plating density and glial cells modulate effects of NGF on survival,fiber growth,and expression of transmitter-specific enzymes〔J〕.J Neurosci,1988;8(8):2967-85.
17毛鳳霞,姚梅玲.Creb與學習記憶及情緒關系〔J〕.醫藥論壇雜志,2008;29(22):126-7.
18Peng S,Zhang Y,Ren B,etal.Effect of ketamine administration on memory consolidation,p-CREB and c-fos expression in the hippocampal slices of minor rats〔J〕.Mol Biol Rep,2011;38(4):2401-7.
19Peng S,Zhang Y,Zhang J,etal.Effect of ketamine on ERK expression in hippocampal neural cell and the ability of learning behavior in minor rats〔J〕.Mol Biol Rep,2010;37(7):3137-42.
20Salim KN,McEwen BS,Chao HM.Ginsenoside Rb1 regulates ChAT,NGF and trkA mRNA expression in the rat brain〔J〕.Brain Res Mol Brain Res,1997;47(1-2):177-82.
21Yamaguchi Y,Higashi M,Kobayashi H.Effects of ginsenosides on maze performance and brain choline acetyltransferase activity in scopolamine-treated young rats and aged rats〔J〕.Eur J Pharmacol,1997;329(1):37-41.
22Rudakewich M,Ba F,Benishin CG.Neurotrophic and neuroprotective actions of ginsenosides Rb(1) and Rg(1)〔J〕.Planta Med,2001;67(6):533-7.

