原花青素對HL-60細胞分化及凋亡的影響
謝朝陽 吳斌華 陳小芳 陳秋生 祝 娟 祝其鋒
(廣東醫學院檢驗醫學研究所,廣東 湛江 524023)
原花青素(PAC) 以其高效、低毒、高生物利用度而被不斷研究開發,研究表明PAC有抗動脈粥樣硬化、抗氧化損傷等作用。本課題組前期研究結果提示PAC可劑量依賴性對抗Aβ25~35對PC12細胞的毒性作用,其保護神經元受損機制可能與逆轉紊亂的細胞周期有關〔1〕。近來研究結果表明,PAC可抑制腫瘤細胞增殖和誘導腫瘤細胞凋亡〔2〕,阻滯細胞周期〔3〕等,起到抗腫瘤的作用。但國內外關于PAC對白血病細胞的作用研究極少,本文以人急性髓細胞白血病細胞株HL-60為模型,探討PAC對HL-60細胞增殖、分化及凋亡的影響。
1 材料與方法
1.1實驗細胞、試劑、儀器 HL-60 細胞購于中科院上海細胞庫。胎牛血清為杭州四季青生物工程材料有限公司產品;RPMI1640購自GIBCO公司;CD14、CD11b 為BD Pharmingen產品;CCK-8試劑盒購于碧云天;各種規格培養皿均為美國Corning Costar公司產品;其余試劑為國產分析純。EPICS XL流式細胞儀為美國COULTER公司;OLYMPUS BX41光學顯微鏡為日本OLYMPUS,SSC-DC83P攝像頭為日本SONY公司。M450型ELISA Reader 酶標儀為美國Bio-Rad公司。
1.2實驗藥物 PAC購于南京清澤醫藥公司,為葡萄籽提取物,質量分數大于95%,用DMSO溶解配成貯存液,DMSO終濃度<0.1%(V/V)。
1.3方法
1.3.1細胞培養 細胞培養在含12% 胎牛血清的RPMI1640培養液中(內含0.1% 青霉素),置于37℃、5%CO2孵育箱內備用。
1.3.2CCK-8法檢測 HL-60細胞增殖抑制 用WST-8(CCK-8)細胞增殖及細胞毒性檢測試劑盒檢測。取對數生長期細胞,調節細胞數為1×105cells/ml,于96孔培養板中每孔加100 μl,細胞濃度為1×104cells/ml,加入不同終濃度的PAC,對照組除未加PAC外其余條件完全一致,置37℃、5%CO2、飽和濕度孵箱中培養24 h、48 h和72 h。培養至實驗時間結束前3 h,各孔加入10 μl的CCK-8溶液,繼續孵育3 h,測定450 nm處的OD值,重復三次,以藥物濃度為橫坐標,抑制率為縱坐標繪制增殖抑制曲線。
1.3.3細胞形態學觀察 調整HL-60細胞數為2×105/ml,每孔2 ml種入6孔板中,加終濃度分別為20 mg/L、40 mg/L的PAC誘導24 h、48 h,離心收集細胞,用PBS洗2次,去上清,制細胞涂片,用Wright染色,光鏡觀察形態變化。
1.3.4流式細胞檢測細胞周期變化 取對數生長期的HL-60細胞以3×108個/L接種于6孔板,每孔加2 ml,加入終濃度為20 mg/L、40 mg/L的PAC,培養24 h。收集細胞至1.5 ml EP管中,PBS洗2次,800 r/min 離心10 min,70% 乙醇-20℃固定過夜,用PBS洗1次,1 200 r/min離心10 min,每管加PI至終濃度為50 mg/L,37℃避光孵育30 min,過濾后上機檢測。每個樣品計數10 000個細胞,每組重復3次取平均值。
1.3.5細胞表面分化檢測 調整HL-60細胞數為2×105/ml,每孔2 ml種入6孔板中,加終濃度分別為20 mg/L的PAC誘導24、48 h,采用FCM檢測髓系主要分化抗原CD14 、CD11b表達變化。離心收集細胞,分別加入鼠抗人FITC-CD14單抗和PE-CD11b單抗5 μl,加PBS至100 μl ,4℃孵育30 min,PBS洗,1次,重懸于PBS,經400目尼龍網過濾,用流式細胞儀檢測CD14和CD11b抗原表達。
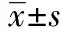
2 結 果
2.1PAC對HL-60細胞生長增殖的影響 不同濃度PAC處理HL-60細胞24、48 h,用CCK-8法檢測細胞存活率,結果顯示作用24 h,隨PAC濃度從5~40 mg/L逐漸增高,細胞存活率逐漸降低(P<0.05),表明PAC對細胞的抑制作用隨濃度的增大而增強(圖1)。當PAC濃度為20 mg/L時,HL-60細胞的增殖抑制率為(72.3±1.8)%,與對照組比較差異有統計學意義(P<0.05)。不同濃度PAC作用HL-60細胞48 h,增殖抑制率比24 h的稍高,但差異無統計學意義,且50 mg/L PAC作用HL-60細胞48 h,細胞出現死亡現象。
圖1 PAC對HL-60細胞生長增殖的影響
2.2細胞形態學觀察 細胞涂片經Wright染色,油鏡下可見,未經藥物作用的HL-60細胞胞體大、核大、多為圓形、核仁清晰、胞質深染、核質比例大。經20 mg/L PAC作用24 h,少數細胞出現核凹陷變形;作用48 h部分細胞體積變小,核形變得不規則,呈現腎形、分葉狀等,核仁不清或消失,胞質變多,部分可見染粉紅色,提示部分細胞分化為較成熟階段細胞。而40 mg/L的PAC作用HL-60細胞48 h,細胞則出現凋亡改變,細胞核固縮、碎裂(箭頭所示),見圖2。
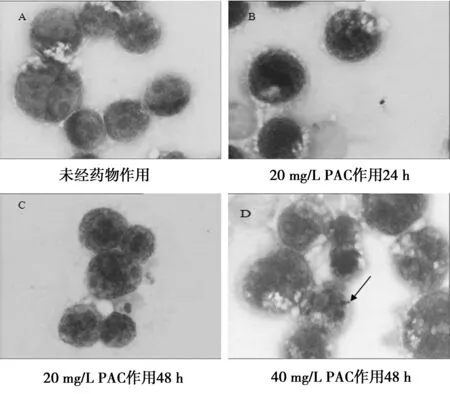
圖2 HL-60細胞形態觀察
2.3PAC對HL-60細胞細胞周期分布的影響 流式細胞術檢測細胞周期結果顯示,經PAC(5~20 mg/L) 處理24 h后,G0/G1期細胞呈劑量依賴性的上升,當PAC濃度為20 mg/L時,細胞周期G0/G1期百分比與對照組(46.3%)比較明顯增高(77.5%)(P<0.05);S期細胞數明顯減少(18.3%,對照組為45.5%)。而當PAC濃度為30 mg/L后,G0/G1期細胞百分率開始降低(50.2%),S期逐漸升高(35.1%)。而40 mg/L的PAC作用HL-60細胞24 h,G2/M期細胞百分比明顯增高(22.4%),并出現凋亡峰。
2.4PAC影響HL-60細胞表面分化抗原的表達 20 mg/L的PAC誘導HL-60細胞24 h,流式細胞術檢測髓系較成熟階段細胞分化抗原CD14表達(15.78%)與對照組(0.33%)比較明顯增高(0.89% vs 0.31%),CD11b表達稍增高,提示HL-60細胞向成熟階段細胞分化。
3 討 論
PAC是一類由葡萄、山楂、松樹皮、銀杏等植物中提取的多酚類聚合物。研究表明PAC能夠減輕腦出血大鼠的細胞凋亡,其機制可能與PAC提高機體的抗氧化能力,同時增強抗凋亡基因bcl-2的表達,降低促凋亡基因bax 的表達有關〔4〕。PAC 可通過減輕腦水腫、改善腦組織的代謝障礙而對腦缺血發揮保護作用〔5〕。研究還表明PAC可以抑制消化道腫瘤、前列腺癌等多種腫瘤的生長,誘導腫瘤細胞凋亡〔6,7〕,提示PAC有可能成為極有希望的低毒、高效的抗腫瘤藥物。但國內外關于PAC對白血病細胞作用的研究報道極少。Hu等〔8〕研究表明低劑量GSPE(葡萄籽原花青素)可誘導人急性髓細胞白血病14.3D10細胞凋亡,但對人正常外周血細胞無影響,提示PAC在治療白血病方面具有一定的應用前景。本研究結果表明PAC可劑量依賴性抑制細胞的增殖,隨著作用時間的延長,抑制率呈增高趨勢,但差異不明顯。提示PAC對HL-60細胞的生長增殖有抑制作用。Feng等〔9〕以花青素誘導氧化應激殺傷白血病細胞實驗中,細胞雙染色檢測凋亡發現,當花青素濃度為50 μg/ml,培養18 h后,HL-60細胞發生凋亡。本文PAC致HL-60細胞凋亡濃度與其比較偏低,但誘導時間延長,推測為實驗室間培養或細胞株來源差異所致。陳夏靜等〔10〕用復方維甲酸注射液在誘導K562細胞分化成熟過程中CD14表達增高。許培權等〔11〕用全反式維甲酸對HL-60細胞誘導分化中CD11b表達增高。本實驗CD11b表達稍增高。國內在利用誘導劑誘導白血病細胞分化研究多有CD11b表達增高,而Park等〔12〕則認為CD11b是細胞黏附分子整合素家族成員之一,參與細胞的黏附與遷移,最早檢測到CD11b 是造血細胞發育過程中髓系祖細胞和原單核細胞階段,隨著進一步分化,其表達逐漸減低。提示CD11b在白血病細胞中的表達尚不明確。
本實驗結果提示PAC能抑制HL-60細胞增殖,低濃度PAC能誘導其分化為較成熟階段細胞,隨濃度的增加分化效應反而降低,高濃度PAC則可能誘導HL-60細胞發生凋亡。表明PAC對急性髓系HL-60細胞株具有雙效作用,其機制可能與細胞周期變化有關。
4 參考文獻
1謝朝陽,梅寒芳,祝其鋒,等.原花青素對Aβ25-35誘導PC12細胞周期紊亂的保護作用〔J〕.中國老年學雜志,2009;29(10):1197-200.
2Actis-Goretta L,Romanczyk LJ,Rodriguez CA,etal.Cytotoxic effects of digalloyl dimmer procyanidins in human caner cell lines〔J〕.J Nutr Biochem,2008;19(12):797-808.
3Kim M,Wu X,Song I,etal.Selective cytotoxicity of synthesized procyanidin 3-O-galloylepicatechin-4b,8-3-O-galloylcatechin to human cancer cells〔J〕.Cell Cycle,2008;7(11):1648-57.
4高 羽,董 志,徐 露.原花青素對實驗性腦出血大鼠腦組織細胞凋亡及凋亡相關蛋白表達的影響〔J〕.中國藥理學通報,2010;26(7):969-73.
5陳香紅,張 艷.原花青素對大鼠腦缺血再灌注損傷代謝障礙的影響〔J〕.中國實用神經疾病雜志,2010;13(22):15-7.
6Miura T,Chiba M,Kasai K,etal.Apple procyanidins induce tumor cell apoptosis through mitochondrial pathway activation of caspase-3〔J〕.Carcinogenesis,2008;29(3):585-93.
7Kampa M,Theodoropoulou K,Mavromati F,etal.Novel oligomeric proan- thocyanidin derivatives interact with membrane androgen sites and induce regression of hormone-in-dependent prostate cancer〔J〕.J Pharmacol Exp Ther,2011;337(1):24-32.
8Hu H,Qin YM.Grape seed proanthocyanidin extract induced mitochondria -associated apoptosis in human acute myeloid leukemia 14.3D cells〔J〕.Chin Med J(Engl),2006;119(5):417-21.
9Feng R,Ni HM,Wang SY,etal.Cyanidin-3-rutinoside,a natural polyphenol antioxidant,selectively kills leukemic cells by induction of oxidative stress〔J〕.J Biol Chem,2007;282(18):13468-76.
10陳夏靜,田 吉,何 兵,等.復方維甲酸注射液誘導K562分化及凋亡作用〔J〕.中藥藥理與臨床,2011;27(2):64-7.
11許培權,龔建平.全反式維甲酸對HL-60細胞分化和凋亡的影響〔J〕.癌癥,2004;23(2):118-23.
12Park H,Shelley CS,Arnaout MA.The zinc finger transcription factor ZBP-89 is a repressor of the human β2-integrin CD11b gene〔J〕.Blood,2003;101(3):894-902.

