蒲公英根多糖的抗氧化活性研究
葛明明,繆月英,孫麗娜,李國(guó)清,胡 北,高金波
(1.黑龍江省教育廳生物藥制劑重點(diǎn)實(shí)驗(yàn)室,佳木斯大學(xué)藥學(xué)院,黑龍江 佳木斯154007;2.黑河學(xué)院物理化學(xué)系,黑龍江 黑河164300;3.哈爾濱學(xué)院,黑龍江 哈爾濱150017)
蒲公英屬菊科多年生草本植物,蒲公英植物體內(nèi)含有胡蘿卜素類[1]、三萜類[2]、植物甾醇類、酚酸類、黃酮類[3]、等多種成 分[4~6],有 抗 腫 瘤[7]、免 疫[8]、抗 菌[9]、抗 氧 化[10]、利膽[11]等功效。還可生吃、炒食、做湯。在生命活動(dòng)中,由于氧化代謝過(guò)程中不斷產(chǎn)生多種自由基,這些自由基一方面是生物體多種生理功能的啟動(dòng)因素和生化反應(yīng)的介導(dǎo)者,另一方面也在免疫細(xì)胞因子網(wǎng)絡(luò)中起調(diào)節(jié)、信號(hào)轉(zhuǎn)導(dǎo)等作用[12]。隨著年齡的增長(zhǎng),自由基的自穩(wěn)態(tài)平衡作用在機(jī)體內(nèi)不斷下降,從而導(dǎo)致生命自身免疫功能的下降,這一下降可導(dǎo)致機(jī)體發(fā)生惡性腫瘤、原發(fā)性高血壓、動(dòng)脈粥樣硬化、Alzheimer型早老性癡呆、糖尿病等自由基疾病[13]。有研究表明:從各種生物體內(nèi)提取的多糖物質(zhì)均具有提高機(jī)體免疫力、可抗菌、抗病毒、抗腫瘤、抗寄生蟲(chóng)、還能延緩衰老等一系列作用,在食品、醫(yī)藥和保健品等領(lǐng)域得到廣泛應(yīng)用[14,15],因?yàn)槠压⒏懈缓嗵牵?6]。所以本實(shí)驗(yàn)經(jīng)摸索后以超聲波協(xié)同酶法從蒲公英根中提取多糖,并在研究了多糖的提取工藝、結(jié)構(gòu)、單糖組成分析的基礎(chǔ)上[17,18],對(duì)其多糖進(jìn)行抗氧化活性測(cè)定,以期待對(duì)蒲公英的進(jìn)一步的應(yīng)用開(kāi)發(fā)等提供科學(xué)依據(jù)。
1 材料與方法
1.1 材料與試劑
蒲公英根夠置于河北省安國(guó)市京華藥業(yè)有限公司,經(jīng)由佳木斯大學(xué)生藥學(xué)教研室教授劉娟鑒定為蒲公英根;1,1-二苯基-2-三硝基苯肼自由基(DPPH自由基)美國(guó)Sigma公司;抗壞血酸(Vc)、番紅花紅T、鄰苯三酚、三羥甲基氨基甲烷、硫酸亞鐵、30%過(guò)氧化氫等均為國(guó)產(chǎn)分析純,甲醇。
1.2 儀器與設(shè)備
Agilent 1100高效液相色譜系統(tǒng)(配有自動(dòng)進(jìn)樣器,可變波長(zhǎng)紫外檢測(cè)器和REV.A.06.03色譜工作站)美國(guó)安捷倫公司;UV 757型紫外分光光度計(jì) 上海精密科學(xué)儀器有限公司;TGL-10B高速臺(tái)式離心機(jī)。
1.3 工作曲線的繪制
分別吸取濃度為0.5mg/m L的葡萄糖標(biāo)準(zhǔn)品溶液0、1.0、2.0、3.0、4.0、5.0、6.0m L,以蒸餾水稀釋至50m L的容量瓶中。各精密吸取1.0mL置干凈的試管中,各管加入5%的苯酚1m L,混勻,迅速加入濃硫酸7.00m L,搖勻,靜置5min后,放入85℃水浴中加熱20min,取出冷卻至室溫,在490nm處測(cè)定吸光度,并以濃度(C:μg/m L)為橫坐標(biāo),以吸光度A為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,計(jì)算相關(guān)系數(shù)。
1.4 多糖的提取及含量測(cè)定
1.4.1 蒲公英根中多糖的提取
蒲公英根→粉碎→過(guò)篩→石油醚、95%的乙醇回流脫脂、脫低聚糖→50℃熱風(fēng)干燥→稱取適量的蒲公英根+提取液(料液比=1:40)+纖維素酶,在一定的溫度下,超聲波提取→濃縮至總體積的1/3→Sevage法除去游離蛋白→大孔吸附樹(shù)脂脫色→終濃度為75%的乙醇沉淀→重蒸餾水重新溶解→終濃度為75%乙醇沉淀→低溫干燥→蒲公英根多糖→過(guò)Sephadex-75柱精制。
1.4.2 多糖含量的測(cè)定
采用苯酚-硫酸法[19]進(jìn)行多糖的含量測(cè)定。
1.5 羥基自由基的生成和清除率的測(cè)定
利用Fenton反應(yīng)體系[20],檢測(cè)多糖提取物對(duì)羥基自由基清除作用。取0.15mol/L的磷酸緩沖溶液(p H=7.4)1.00m L,0.262mg/m L番紅花紅 T 溶液0.20m L,6mmol/L的EDTA-Na+Fe2+1.00m L,然后分別加入7.00m L不同質(zhì)量濃度 (0.02mg/mL,0.04mg/m L,0.06mg/mL,0.08mg/mL,0.1mg/mL)的多糖,后加入0.8mL的3%的過(guò)氧化氫,放入40℃水浴30min后,在520nm處的測(cè)吸光度值。配制相同濃度的VC溶液,根據(jù)以上實(shí)驗(yàn)方法,進(jìn)行實(shí)驗(yàn)。其清除率可用下式計(jì)算:
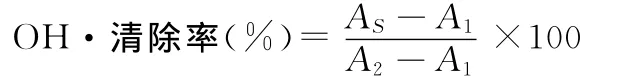
式中:A1—體系中未加樣品溶液時(shí)的吸光度;AS—體系中加了樣品溶液時(shí)的吸光度;A2—番紅花紅和緩沖溶液混合后的吸光度。
1.6 超氧陰離子自由基的生成和清除率的測(cè)定
加入3.00m L的Tris-HC1緩沖溶液(p H=8.2)和0.10m L不同濃度的樣品溶液,25℃水浴20min,加入濃度為7mmol/L的鄰苯三酚溶液3.00m L,反應(yīng)4min,再加入10mol/L的HCl終止反應(yīng),以蒸餾水作參比,在420nm處測(cè)吸光度值,同時(shí)以VC作對(duì)照。其清除率可用下列公式計(jì)算:
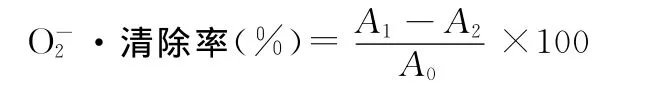
式中:A1—為樣品加入緩沖溶液及鄰苯三酚后的吸光度;A2—樣品加入緩沖溶液后的吸光度;A0為緩沖溶液加入鄰苯三酚后的吸光度。
1.7 HPLC法測(cè)定DPPH·自由基的生成與清除率
1.7.1 色譜條件
色 譜 柱:ZORBAX Eclipse XDB-C18,250mm ×4.6mmi.d.;流動(dòng)相:甲醇∶水=80∶20;柱溫:25℃;流速:1.0mL·min-1,檢測(cè)波長(zhǎng)517nm。
1.7.2 HPLC法測(cè)定清除DPPH·自由基
取多糖試樣液2.00m L及DPPH乙醇溶液2.00m L濃度為2×10-4mol/L,先后加入同一具塞試管中,同時(shí)做空白實(shí)驗(yàn)等,置于37℃是恒溫水浴中,30min后分別測(cè)定DPPH的色譜峰面積;以VC作對(duì)照,其清除率可用下列公式計(jì)算:
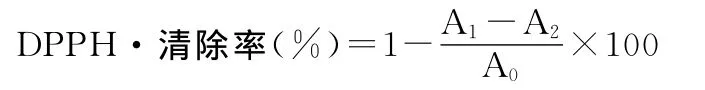
式中:A0—2.00mL DPPH+2mL蒸餾水時(shí)測(cè)定DPPH的色譜峰面積;A1—2mL DPPH+2mL多糖溶液時(shí)測(cè)定DP-PH的色譜峰面積;A2—2m L多糖溶液+2m L乙醇時(shí)測(cè)定DPPH的色譜峰面積。
2 結(jié)果與分析
2.1 蒲公英多糖提取的正交實(shí)驗(yàn)設(shè)計(jì)及實(shí)驗(yàn)結(jié)果
本實(shí)驗(yàn)是在單因素考察的基礎(chǔ)上進(jìn)行的[17],以料液比1:40為固定條件,按照正交實(shí)驗(yàn)設(shè)計(jì)對(duì)影響超聲波纖維素酶法提取蒲公英多糖的因素,如:提取溫度(45℃、50℃、55℃)、p H(4.5、5、5.5)、加酶量(占底物%:1%、2%、3%)、提取時(shí)間(15min、20min、25min)等,進(jìn)行條件正交試驗(yàn)優(yōu)化,平行3次所得結(jié)果見(jiàn)表1。
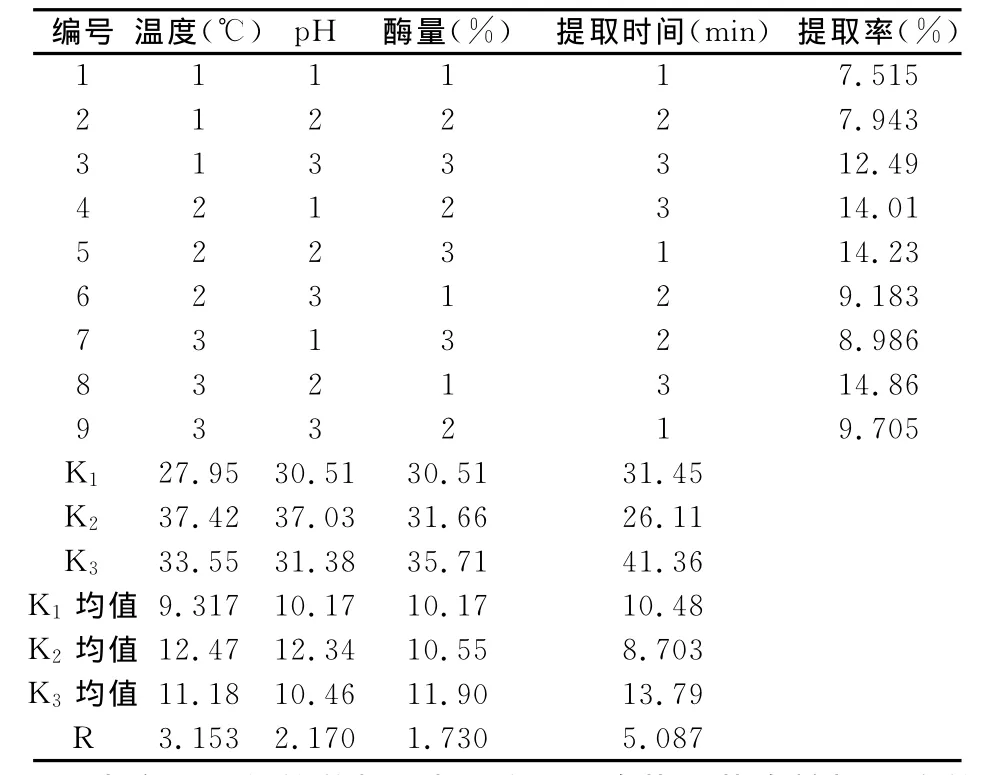
表1 正交試驗(yàn)設(shè)計(jì)L9(34)及實(shí)驗(yàn)結(jié)果(n=3)
由實(shí)驗(yàn)所得的數(shù)據(jù)分析可知,影響蒲公英多糖提取率的主次關(guān)系:影響最大的是提取時(shí)間的多少,其次是提取溫度的大小,然后是p H值的大小,影響最小的是提取時(shí)所加的纖維素酶的量。結(jié)果正交實(shí)驗(yàn)所獲得的最佳工藝條件為:取時(shí)間為25min,提取溫度50℃,p H值為5.0,酶量為底物的3%,多糖的提取率為:15.83%。
2.2 多糖含量測(cè)定的工作方程與含量
以葡萄糖為對(duì)照品,波長(zhǎng)490nm處測(cè)得吸光度(A)與葡萄糖質(zhì)量濃度 (ρ)之間的回歸方程為:A=0.006ρ+0.0239,r=0.9995,線性范圍是10.0~100μg/m L,提取物中的多糖含量為83.31%。
2.3 蒲公英多糖質(zhì)量濃度對(duì)清除·OH的影響
見(jiàn)圖1。
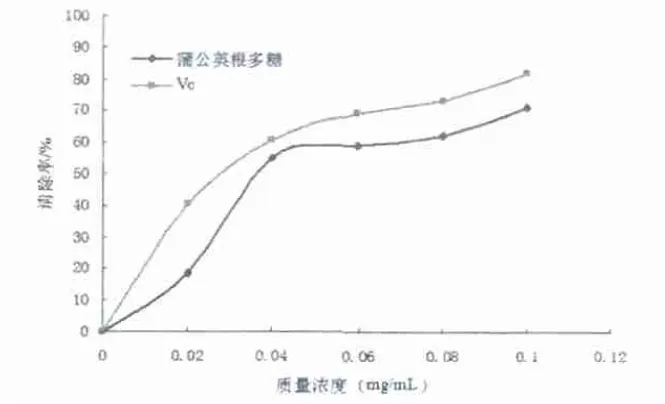
圖1 蒲公英根多糖質(zhì)量濃度對(duì)·OH清除率的影響(n=3)
由圖1可知,蒲公英多糖清除·OH的作用在0~0.1mg/mL范圍內(nèi),隨著多糖質(zhì)量濃度的增大,清除率逐漸升高;與VC的清除率比較分析,雖低于VC,但清除·OH的作用仍然較強(qiáng)。
2.4 蒲公英多糖質(zhì)量濃度對(duì)清除O-2·的影響
見(jiàn)圖2。
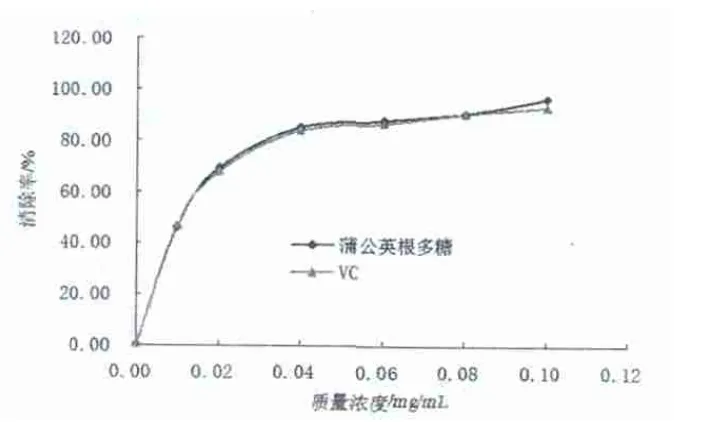
圖2 蒲公英根多糖質(zhì)量濃度對(duì)O-2·清除率的影響
由圖2可知,在實(shí)驗(yàn)所選取的質(zhì)量濃度范圍內(nèi),蒲公英根多糖與Vc相比較對(duì)O-2·的清除率具有相同趨勢(shì),都隨著濃度的增大而升高,且蒲公英根多糖的清除率與Vc的清除率十分接近,說(shuō)明蒲公英根多糖對(duì)O-2·自由基的清除很強(qiáng)。
2.5 DPPH測(cè)定的色譜專屬性實(shí)驗(yàn)
在1.7.1色譜條件下,DPPH自由基的出峰時(shí)間為9.87min,而多糖和溶劑等在此色譜條件下無(wú)色譜峰出現(xiàn)。見(jiàn)圖3。
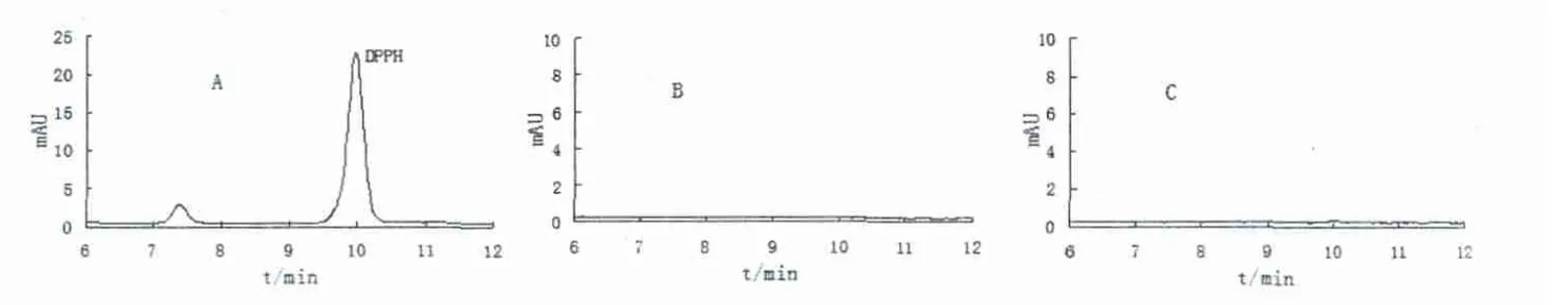
圖3 色譜圖(A:DPPH溶液;B:蒲公英根多糖溶液;C:乙醇+蒸餾水溶液)
2.6 蒲公英多糖質(zhì)量濃度對(duì)清除DPPH·的影響
見(jiàn)圖4。
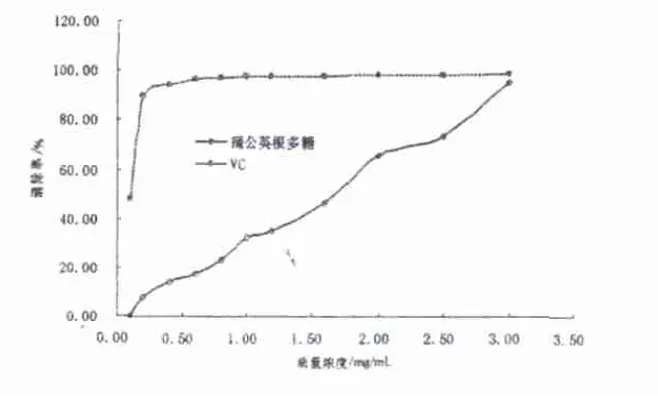
圖4 蒲公英根多糖質(zhì)量濃度對(duì)DPPH·清除率的影響
由圖可知,蒲公英根多糖對(duì)DPPH·具有很明顯的清除作用,清除效果隨著濃度的增加而增大,當(dāng)濃度為3.0mg/m L時(shí),蒲公英根多糖對(duì)DPPH·的清除率已高達(dá)95.4%基本與VC的清除率相同。
3 討論
本實(shí)驗(yàn)在利用建立Fenton反應(yīng)體系模型測(cè)定羥基自由基時(shí),使用了兩種方法,一種為鄰二氮菲亞鐵為顯色劑的方法,一種為番紅花紅為顯色劑的方法,實(shí)驗(yàn)的結(jié)果是測(cè)定多糖的抗羥基自由基不能使用鄰二氮菲亞鐵為顯色劑,因?yàn)樵诜磻?yīng)中會(huì)產(chǎn)生沉淀干擾吸光度的測(cè)定,即使采用離心除去沉淀的方法,但數(shù)據(jù)的重現(xiàn)性仍然較差。而使用番紅花紅T為顯色劑時(shí),則沒(méi)有沉淀產(chǎn)生,重現(xiàn)性較好,較為適合蒲公英根多糖的清除羥基自由基的測(cè)定。本實(shí)驗(yàn)的研究表明,蒲公英根多糖對(duì)O2-·、·OH和DPPH·均具有明顯的清除作用,均隨著多糖液濃度的增加而增強(qiáng),有著明顯的量效關(guān)系,在清除超氧陰離子自由基時(shí)發(fā)現(xiàn)它的清除能力與VC相當(dāng)。總之,蒲公英根多糖對(duì)3種自由基的清除能力由強(qiáng)到弱總體趨勢(shì)是:O2-·>·OH>DPPH·。蒲公英在東北蘊(yùn)藏量很大,蒲公英根中總糖含量較高,超聲波協(xié)同酶法提取的多糖的提取率為15.83%,其含糖高達(dá)83.31%有很高的應(yīng)用價(jià)值。因此,蒲公英根可以作為一種有效的自由基清除劑使用,有很好的開(kāi)發(fā)和應(yīng)用的前景,將來(lái)會(huì)成為我們理想的天然抗氧化劑首選之一。
[1]Booth V H.Taraxien,the carolenoid ester in dandelion flowers[J].phytothemistry,1964,3(2):229-232
[2]Mich D.Isolation of pollinastanol and aseries of 7 sterols from pollens from conpesilae species[J].Bull Soc Chim Biol,1967,49(7):865-868
[3]Shi SY(施樹(shù)云).Preparative isolation and purification ofthree flavonoid glycosides from Taraxacum mongolicum byhigh-speed counter-current chromatography[J].J Sep Sci,2008,31:683-688
[4]吳曉春,杜勝利,陳海生.蒲公英的研究與應(yīng)用[J].天然藥物化,2002,20(4):246-248
[5]楊曉杰,付學(xué)鵬.蒲公英多糖體外抑瘤和抗突變作用研究[J].時(shí)珍國(guó)醫(yī)國(guó)藥,2009,20(10):2470-2471
[6]林云,江林,蔣健,等.蒲公英的藥理作用研究進(jìn)展[J].中國(guó)現(xiàn)代中藥,2011,13(8):42-47
[7]姜寧,宋新波.蒲公英的藥理研究進(jìn)展[J].中國(guó)中醫(yī)藥雜志,2008,12(6):19-22
[8]陳玉杰.蒲公英水提物對(duì)大鼠潰瘍性結(jié)腸炎的實(shí)驗(yàn)研究[J].中國(guó)實(shí)驗(yàn)方劑學(xué)雜,2012,18(8):205-208
[9]楊嵐,李華峰,刁海鵬,等.蒲公英花中總酚酸和總黃酮含量測(cè)定及其抗氧化性能研究[J].食品科學(xué),2011,32(17):160-163
[10]張志明.人間仙草蒲公英[J].家庭醫(yī)學(xué):新健康,2006,(1):56-57
[11]張志軍,李淑芳,魏雪生,等.靈芝多糖體外抗氧化活性的研[J].化學(xué)與生物工程,2011,28(3):63-65
[12]游育紅,林志彬.靈芝多糖肽的抗氧化作用[J].藥學(xué)學(xué)報(bào),2003,38(2):85-88
[13]付學(xué)鵬,楊曉杰,李本麗,等.蒲公英不同器官多糖含量測(cè)定及抗氧化性研究[J].食品研究與開(kāi)發(fā),2008,29(3):26-27
[14]劉曦,黃仁彬,孫懿,等.六月青多糖體外抗氧化作用的研[J].中國(guó)醫(yī)院藥學(xué)雜志,2008,28(23):1983-1986
[15]劉彩紅,王愛(ài)玲,李玉琴,等.款冬花多糖抗氧化能力測(cè)[J].中國(guó)現(xiàn)代應(yīng)用藥學(xué),2011,28(10):886-889
[16]吳小麗,蔡云清,趙巖,等.蒲公英提取物對(duì)小鼠免疫功能的調(diào)節(jié)作用[J].南京醫(yī)科大學(xué)學(xué)報(bào)(自然科學(xué)版),2005,25(3):163-165
[17]高金波,孫麗娜,滕楊,等.蒲公英多糖的分離、純化及結(jié)構(gòu)的初步分析[J].中國(guó)現(xiàn)代應(yīng)用藥學(xué),2010,27(10):905-908
[18]高金波,孫麗娜.柱前衍生化HPLC分析蒲公英多糖的單糖組成[J].中國(guó)現(xiàn)代應(yīng)用藥學(xué),2010,27(1):53-56
[19]朱良,王一飛,朱艷梅.裙帶菜孢子葉多糖含量的測(cè)[J].食品科學(xué),2005,26(10):184-186
[20]王崔平.活性氧自由基的檢測(cè)及其清除研究[D].北京:首都師范大學(xué),2007

