AGO1基因對擬南芥葉邊緣鋸齒狀發育的影響
李素芬,趙 燕,冀蘆沙
(1.聊城大學生命科學學院,山東聊城 252000;2.聊城大學農學院,山東聊城 252000)
葉是植物體的基本營養器官之一,在植物的生命活動中起著重要作用,研究植物葉的發生、發育的分子機理,是發育生物學的一個重要課題。葉片發育的階段大致可分為葉原基的起始和葉極性的建立。葉原基是在莖的頂端分生組織(shoot apical meristem,SAM)中形成的。葉極性的建立是葉發育的核心環節。ZILBERMAN等的新細胞決定理論認為,葉邊緣鋸齒、葉卷曲是某些直接或間接影響細胞分裂或生長分化的基因突變造成的[1]。從葉形成的分子機制上看,SAM細胞及周邊細胞的發育形成葉原基,葉原基產生極性分化并從細胞分裂狀態轉入細胞生長階段,平展、正常的葉片逐漸形成。控制這一發育進程的一系列基因的突變及影響細胞分裂、生長分化的因素都有可能使葉發育異常,產生卷曲、鋸齒狀等異型葉片[1]。
近年來研究表明,AGO1基因在植物葉極性的分化方面具有重要的調節作用。通過對AGO1基因進行突變研究,發現AGO1基因能通過靶向作用于TCP轉錄因子基因家族來調控植物葉形態建成[2]。AGO1基因在芽頂端組織、花器官和果實中表達,AGO1基因過表達突變體產生葉片卷曲、花發育異常、葉片偏上生長、果實畸形等異常表型。西紅柿中,LA基因編碼一個包含AGO1基因的轉錄因子,AGO1基因通過介導LA基因調控葉邊緣細胞發育。LA表達水平升高,導致葉邊緣發育異常化;降低LA表達水平,則使葉邊緣細胞持續生長。
AGO蛋白參與RISC復合體的形成,選擇性的招募microRNAs和siRNAs參與RNA沉默,是PTGS中RISC的催化發動機。另外,AGO蛋白的一個很重要的功能是催化RISC對靶RNA的特異性切割。有研究表明,這個切割作用是由PIWI這個結構域來完成的。PIWI與RNase H具有相似的結構特征[3],可以發揮核酸內切酶活性以切割靶RNA。除了提供催化RISC切割活性外,PIWI結構域中還存在一個可以直接與Dicer結合的區域,AGO蛋白可能就是以此為結構基礎通過與Dicer互作而進入RISC裝配過程的[4]。此外,AGO是構成RdDM復合物重要成分,在異染色質的沉默及傳播中是必需的。
在擬南芥中,AGO家族有10位成員,其中AGO1調節葉片發育,參與PTGS,可能是各種RNA剪切途徑剪切器的組分,是擬南芥中唯一參加miRNA生物途徑的AGO蛋白,AGO1在體外可以結合miRNA并催化靶基因的剪切[2];AGO4參與轉座子和反向重復序列的DNA甲基化[5],是維持異染色質的必需因子,而且AGO4可以催化產生次級siRNA(secondary siRNAs)以放大沉默信號[6];AGO6主要招募與異染色質有關的siRNAs,在DNA甲基化和TGS途徑中起重要作用[7];AGO7(又稱ZIPPY)主要調節植物發育時速,是某些ta-siRNAs沉默復合體的形成所必需的[8-9]。
本實驗以野生型擬南芥為背景克隆出編碼AGO1蛋白的基因[8]。構建基因獲得AGO1植物表達載體pBI121-AGO1,利用農桿菌介導的方法轉化擬南芥,通過抗性篩選,獲得轉基因植株。并通過對轉基因植株進行表型觀察及AGO1蛋白的RT-PCR檢測,以確定擬南芥中AGO1的功能。本實驗為后續AGO1基因在擬南芥中功能的鑒定提供了有利的研究基礎。
1 材料與方法
1.1 材料
1.1.1 擬南芥來源
擬南芥(Arabidopsisthaliana)栽培品種Columbia。
1.1.2 質粒與菌株
E.coliDH5α,BL21,克隆載體pGEM18-T Simple,由 Takara公司提供;P.pastorisGS115,pPIC9,pPIC9K,pF41,均由Clontech公司提供。
1.1.3 酶與試劑
限制性內切酶(NotⅠ,SalⅠ),T4DNA ligase,RNase A,IPTG,X-Gal,DNA Marker DL 2000,TagDNA聚合酶,DNA凝膠回收試劑盒(PCR Fragment Recovery Kit),質粒微量提取試劑盒,RNA PCR Kit(AMV)Ver.3.0,均購自寶生物(大連)公司。Trizol試劑購自Invitrogen公司。其他試劑為分析純。
1.2 方法
1.2.1 擬南芥總RNA的提取及反轉錄
參照Trizol說明書從生長4周大的野生型擬南芥中提取總RNA,將RNA溶于20μL含DEPC水中。按照RNA PCR Kit(AMV)Ver.3.0試劑盒取2μL總RNA進行反轉錄得10μL cDNA[9]。
1.2.2 引物設計
根據TAIR網站中AGO1基因編碼區序列以及酵母表達載體pPIC9K上的多克隆位點,通過Primer Premier 5.0軟件設計3對引物 P1:5′—ATGCCGGTTCAGTAGGAGGAGTCGC—3′;P2:5′—CATAAGCTCGACATTGCTTCCACCAACC—3′;P1GUS:5′—CGCATGATTGAACAAGATG—3′;P2GUS:5′—TCCCGCTCAGAAGAACTCGTC—3′。
1.2.3 質粒表達載體的構建
將AGO1基因的PCR回收產物和pET30空載體以EcoRⅠ和XhoⅠ雙酶切,37℃水浴過夜后,進行瓊脂糖(質量濃度10g/L)凝膠電泳并回收,然后在T4DNA連接酶作用下室溫連接4h,轉化E.coliDH5α,通過氨芐青霉素(Amp+)抗性篩選得到AGO1基因的重組子。挑取陽性克隆小提質粒DNA并雙酶切鑒定。運用BamHⅠ和EcoRⅠ雙酶切重組質粒,將AGO1基因片段連入雙元表達載體pBI121(35S::GUS),與GUS融合蛋白,然后在T4DNA連接酶作用下室溫連接4h,轉化大腸桿菌DH5α,通過卡那霉素(Kan+)抗性篩選得到重組子。
1.2.4 轉基因擬南芥篩選
鑒定正確的質粒轉化農桿菌株GV3101,涂布于Kan+抗性的LB平板37℃過夜培養。PCR鑒定陽性克隆。然后挑取陽性單克隆于2mL LB中,37℃230r/min振蕩培養過夜。次日5 000g離心5min,去上清收集菌體,加入5mL質量分數5%的蔗糖溶液重懸。運用浸花法侵染野生型擬南芥,在含50μg/mL(質量濃度)卡那霉素的MS培養基上篩選T1代,取T1代和野生型植株的葉片提取DNA,以野生型為陰性對照進行PCR鑒定,選取陽性株系。取陽性植株的T1代種子為實驗材料。
1.2.5 轉基因擬南芥拷貝數檢測
選用T1代葉片邊緣為鋸齒狀穩定表型的5個轉基因擬南芥株系中各15棵擬南芥為遺傳材料,采用CTAB法提取T1代擬南芥基因組DNA。事先選取已證明為單拷貝純合體的轉基因擬南芥植株基因組DNA樣品為對照,分別設計特異引物單獨擴增內源基因(α-tubilin)和外源基因(NPTⅡ),結果顯示內源基因和外源基因具有相似的擴增效率。因α-tubilin特異性引物,上游引物:5′-AGAAGAGCCTTTGCTGGCC-3′(P1),下游引物:5′-CCAACAATCTATCAGCCACG-3′(P2),目的片段大小為791bp;同時設計了外源基因NPTⅡ(新霉素磷酸轉移酶Ⅱ基因)的特異性引物,上游引物:5′-ACAATCGGCTGCTCTGATG-3′(P1),下游引物:5′-TCAGAAGAACTCGTCA AGAAG-3′(P2),目的片段大小為741bp。對PCR擴增反應最佳循環數確定在20~25之間[10]。因此本實驗中,以擬南芥核基因組上單拷貝內源基因為內參,與核基因組上插入的外源基因一起以提取的轉基因擬南芥植株基因組DNA為模板,置于單一PCR管中同時進行聚合酶鏈式反應(PCR)。PCR最佳反應體系:94℃,3min,1個循環;94℃30s,56℃30s,72℃1min,24個循環。反應產物經瓊脂糖凝膠電泳,在凝膠成像系統下呈現出外源基因和內源基因兩條目的片段大小不同的條帶,照相保存。將圖片置于ImageJ軟件下,捕捉分析兩條目的條帶的灰度比。同時該實驗在相同條件下重復3次。
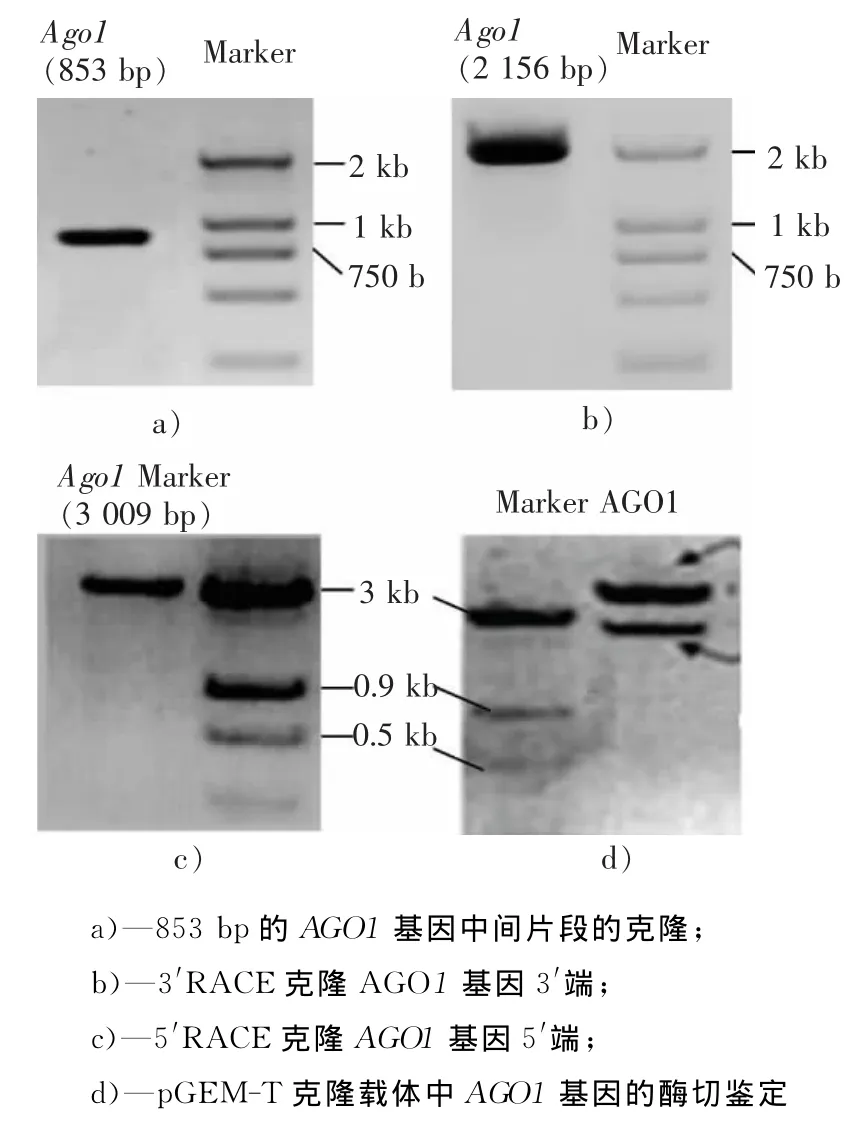
圖1 擬南芥AGO1基因全長序列的克隆及測序Fig.1 Cloning and sequencing of the full-length Arabidopsis AGO1 gene
2 結果與分析
2.1 擬南芥AGO1基因的克隆及鑒定分析
本實驗以擬南芥野生型Columbia品種葉片總RNA反轉錄產物為模板,使用Pfx高保真聚合酶,能夠很好的擴增AGO1基因的相關序列。由于擬南芥基因組已知,根據TAIR網站上發布的AGO1基因序列設計5′端特異引物特異擴增AGO1基因5′端,經生工測序得該片段長853bp(見圖1a)),且測序結果檢測顯示該片段包含AGO1基因轉錄起始位點ATG。隨即在基因的ORF去設計3′RACE引物對AGO1基因3′進行擴增,得到所示長度為2 156bp(見圖1b))的AGO1基因序列,最終得到3 009bp的全長(見圖1c))。對獲得的克隆進行了全長的測序(生工測序),得到了無突變的克隆,通 過 與 NCBI/TAIR 網 站 注 冊 的AGO1基 因(At1g48410)進行比對,兩者的同源性高達96%(比對結果見圖1)。證實本實驗克隆的基因為擬南芥AGO1基因。AGO1全長cDNA基因使用了在PCR產物3′端添加A堿基后,做T-A克隆的辦法,將基因的全長cDNA序列克隆至pGEM T-easy克隆載體中,對連接后的載體進行酶切驗證(見圖1d))。
2.2 重組表達載體pBI121-AGO1的構建
35S啟動子在單子葉和雙子葉植物中可以高效啟動外源插入片段的組成型表達。本實驗用XbaⅠ,BamHⅠ雙酶切將外源AGO1基因插入到植物高效表達載體pBI121的35S啟動子與GUSA報告基因之間,得到如圖2a)所示的AGO1基因的高效表達載體,使AGO1-GUS融合蛋白在植物體內得以高效表達。圖2b)為XbaⅠ和SalⅠ酶切鑒定結果。該載體含有卡那霉素(Kanamycin)抗性基因,轉化擬南芥以后可以用卡那霉素篩選農桿菌轉化體(GV3101-AGO1)。農桿菌浸染植株后,該pBI121載體上左右邊界序列(LB及RB)之間的T-DNA區段將隨機整合入外植體基因組中,進而得以轉錄表達。

圖2 重組表達載體pBI121-AGO1的構建Fig.2 Recombination of the pBI121-AGO1 vector
2.3 農桿菌侵染后抗性轉基因植株的篩選情況及RT-PCR分析
侵染后的擬南芥植株成熟以后收獲的T1代種子,經過消毒,播種在GM抗性培養基上(含 Kanamycin質量濃度50mg/mL),4 ℃春化后放在長日照條件下進行萌發,篩選出抗性植株共34棵。將其進行基因組PCR檢測GUSA基因,共篩選到pBI121-AGO1植株15棵。圖3為34棵T1代卡那抗性株系中對GUSA基因片段(750bp)進行擴增后篩選出的15棵AGO1轉基因植株。轉基因擬南芥在抗性培養基上萌發6~8d后將抗性苗移至營養基質中生長。圖4a)所示為2周及4周后轉基因擬南芥的生長情況。如圖4b)所示為相應的擬南芥RT-PCR分析AGO1的表達情況,Tubulin基因表達情況以及提取的總RNA作對照。
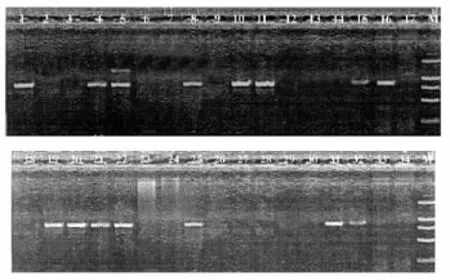
圖3 轉基因擬南芥的PCR鑒定Fig.3 PCR Amplification of the transgenic Arabidopsis
2.4 T1代轉基因植株表型觀察
把T1代轉基因擬南芥在抗性培養基上萌發6~8d后將抗性苗移至營養基質中生長4周,以觀察地上部分表型(如圖5)。與野生型相比,在15個轉AGO1基因的株系中有5個株系擬南芥出現明顯葉片細長,呈鋸齒狀。
2.5 T1代轉基因擬南芥株系的拷貝數檢測
為了鑒定攜帶單拷貝外源基因的轉基因擬南芥植株,以擬南芥核基因組上已知的單拷貝內源基因(αtubulin)為內參,轉基因擬南芥植株基因組DNA為模板,在同一PCR反應體系中擴增內源基(α-tubulin)和外源目的基因(NPTⅡ),循環數為22,反應產物在瓊脂糖凝膠上電泳,獲得了預期大小的2條特異性擴增條帶(見圖6)。從以上5個株系中選取10株轉基因擬南芥植株,經ImageJ軟件捕捉分析兩條目的條帶的灰度比,實驗發現除1號轉基因株系外,其他轉基因株系中外源基因與內源基因的擴增條帶灰度比均為1,及初步說明檢測植株即為單拷貝外源基因的轉基因擬南芥植株。1號轉基因擬南芥的灰度比為1.8,有待孟德爾遺傳實驗的進一步驗證。
3 討 論
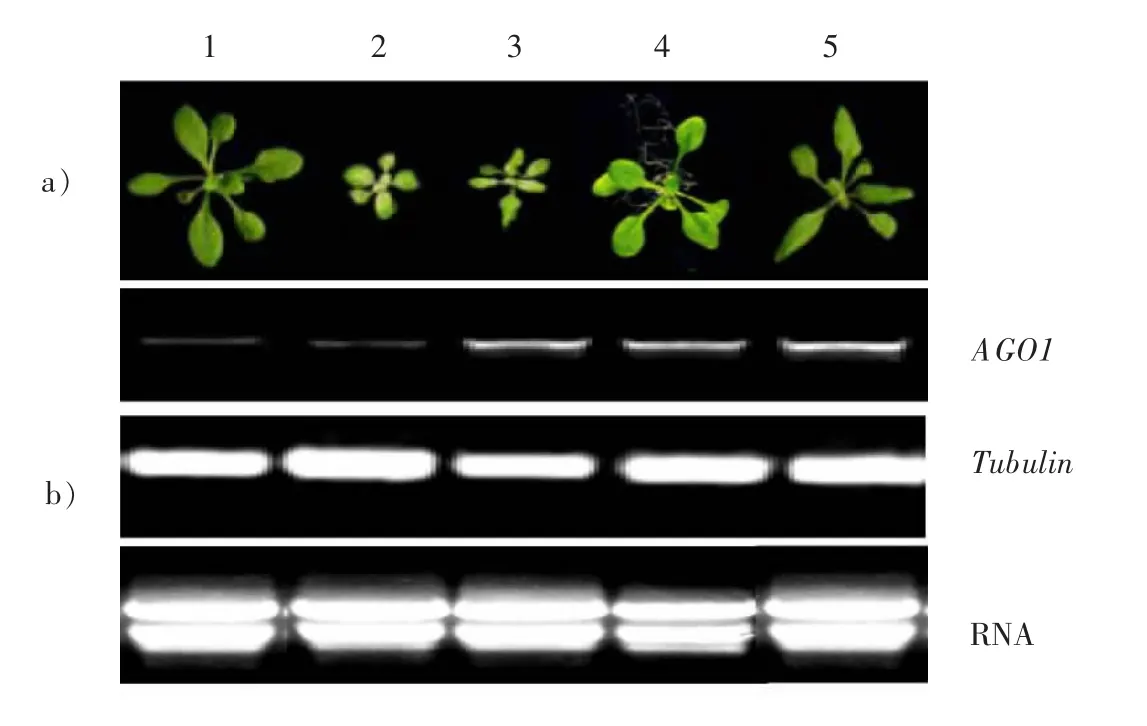
圖4 轉基因擬南芥的表型及RT-PCR分析Fig.4 Phenotype and RT-PCR analysis of the transgenic Arabidopsis
3.1 克隆全長基因的過程中需要注意的問題
1)保證PCR模板的質量 這就要求從RNA的提取開始,每一步都要保證質量,只有獲得高質量的反轉錄產物,才能保證能夠擴增出目的基因。
2)選擇合適的DNA聚合酶和合適的PCR反應條件 一種合適的PCR聚合酶,既要有較高的酶活力,又要有較高的保真度。經過多次實驗摸索,筆者選擇了Invitrogen公司的Pfx高保真DNA聚合酶,該酶的保真度較高,同時酶活力也足以滿足擴增3kb基因的需要。PCR反應條件也是一個很重要的方面,主要的因素有退火溫度、延伸時間、擴增循環數等,這些都需要經過反復實驗來獲得最優化的方案。
3)選擇合適的RACE引物擴增基因全長常規意義上運用RT-PCR技術克隆全長基因,首先擴增的是基因的中間片段,其次是設計特有的5′端和3′端的特異引物對基因的全長進行有效克隆。由于擬南芥基因組中AGO1基因序列已知,實驗設計之初在AGO1基因5′端設計特異引物對其進行擴增,獲得853bp中間片段。根據所得到的中間片段,設計引物3′-RACE嵌套式引物。同樣摸索引物組合及退火溫度。最后實驗得到用5′引物和B26引物做第1次PCR,退火溫度選擇較低的50℃;PCR產物稀釋1 000倍后作為模板,以5′引物和B25為引物進行第2次PCR,退火溫度提高到54℃。測序結果得到目的條帶。

圖5 葉片為鋸齒狀的T1代轉基因擬南芥照片Fig.5 T1transgenic Arabidopsis with the serration margin leaves

圖6 單拷貝外源基因的轉基因擬南芥鑒定Fig.6 Identification of transgenic plants carrying a single copy of integrated T-DNA
4)確定最佳的連接反應和酶切反應的時間 有文獻報道,連接反應的反應時間為48h,筆者的結果顯示,連接12h已經足夠,過長的時間毫無必要,反而延長實驗的周期。若酶切反應不完全,或酶切后末端有復性會造成載體自身環化,平板上長出大量陰性菌落,降低了連接效率,給挑去陽性菌落帶來很大困難,因此應盡量延長酶切時間,保證酶切徹底,酶切反應的時間至少1.5h。
3.2 轉基因方法的選擇
植物表達載體構建好后,下一步即為基因轉化工作。將目的基因導入靶植物細胞內,使其整合到植物基因組,使目的基因成為轉基因植物基因組的有機組成部分,并進行可遺傳的表達。目前,基因轉化的方法主要有農桿菌介導法和DNA直接轉化法。DNA直接轉化法包括:PEG介導基因轉化法、基因槍法、電激法等。
與DNA直接轉化法相比,農桿菌介導法具備很多明顯的優點。在轉化質量方面,農桿菌轉化的DNA結構完整、整合位點較穩定、拷貝數低、轉化的片段較大(可達50kb)、轉化機理清楚、整合后的外源基因結構變化較小[9]。而DNA直接轉化法,DNA結構變化較大,會發生DNA甲基化、環化,片段分離和丟失、重排等,此外轉入基因拷貝數高,由此而引起的甲基化會造成基因表達沉默。在轉化效率方面,DNA直接轉化法效率比較低,為0.01%~1%,而農桿菌介導法的轉化效率約為0.1%~5%,甚至更高。此外,農桿菌介導的轉化方法與DNA直接轉化法相比,在轉化和篩選上有簡易性[10]。
當然,農桿菌介導轉化也存在一些缺點,比如農桿菌感染過程會對植物組織造成損傷,T-DNA整合如植物基因組時邊界可能會發生截短;T-DNA可能以串聯形式整合;甲基化等原因造成基因轉化后失活;轉移到T-DNA區的2個基因未必共表達等。但是瑕不掩瑜,隨著研究工作的深入,農桿菌介導法很可能會廣泛應用于植物基因的轉化。
基于以上分析,筆者選擇了農桿菌介導的方法,轉化擬南芥植株。
3.3 影響農桿菌介導的雙子葉植物基因轉化效率的因素
1)啟動子 設計植物轉化方案所要考慮的一個非常重要的因素是啟動子的選擇。本實驗中筆者選用的是CaMV35S啟動子,這種啟動子在所有組織中都啟動基因表達,具有持續性,不表現時間和空間的特異性;相對恒定的表達RNA和蛋白質。
2)植物基因型 不同雙子葉植物對農桿菌的敏感程度不同,甚至同一種雙子葉植物的不同品種對農桿菌的敏感程度也會大不相同。Columbia型擬南芥對農桿菌較敏感,轉化效率較高。
3)篩選用抗生素 篩選時所用的不同抗生素對于轉化的細胞會有不同的傷害作用,從而使轉化效率受到影響。在篩選方案中應選用對敏感細胞傷害大而對轉化細胞傷害小的抗生素作為篩選劑,既要保證較高的篩選效率又要保證較高的轉化效率。本實驗所采用的表達載體含有卡那霉素(Kanamycin)抗性基因,因此轉化以后可以用卡那霉素作為農桿菌的篩選劑。
4)農桿菌菌株類型 不同菌株對同一種植物的感染能力不同。本實驗采用的根癌農桿菌(Agrobacteriumtumefaciens)GV3101已被初步證明感染后的擬南芥能力較強。
5)表面活性劑的選擇 轉換用的表面活性劑Silwet L-77能促進農桿菌吸附于外植體表面,促進TDNA的轉移,在最佳質量分數0.02%時可以使侵染效率提高到4倍[8]。
4 實驗結論
通過提取總RNA進行RT-PCR,及PCR方法成功克隆了AGO1基因。利用農桿菌介導花序浸泡法成功獲得了轉基因擬南芥植株。RT-PCR分析轉基因植株顯示,轉基因植株生長2周時AGO1蛋白的表達量明顯多于非AGO1基因轉基因植株,在第4周時對照轉基因植株與AGO1基因轉基因植株中AGO1蛋白的表達量基本相當,但比野生型植株表達量多。從獲得的T1代超表達AGO1基因轉基因擬南芥的表型可以看出,超表達AGO1基因轉基因擬南芥葉片明顯成鋸齒狀,說明AGO1基因對擬南芥葉片發育有影響[11-12]。超表達AGO1基因轉基因擬南芥葉片的鋸齒狀表型與已報道的擬南芥AGO1基因突變體表型相近,至于產生這一表型的原因仍需進一步驗證。在15個轉AGO1基因的株系中僅有5個株系擬南芥出現明顯葉片細長,呈鋸齒狀。對以上5個轉基因植株拷貝數檢測,發現除1號株系以外其他4個株系均為單拷貝插入,從實驗水平上證實,轉基因株系葉片鋸齒狀表型并不是由于多拷貝數的外源基因在轉錄翻譯過程中的基因沉默而引起的。表型觀察發現1號轉基因株系葉片鋸齒狀程度明顯低于其他4個株系。此外,本次實驗目的在于以實驗所得的轉有AGO1基因的轉基因擬南芥為實驗材料,僅以分析AGO1在植物發育,響應外源脅迫及相關途徑中的作用。為進一步分析miRNA作用機理及RNAi介導的作用通路提供材料支撐。
AGO1基因是小RNA功能途徑中一個關鍵的基因,目前對于AGO1基因功能的研究已經取得了一些成果。以往的研究多是基于遺傳學手段,從突變體入手,從表型來鑒定基因的功能。使用這一辦法確實取得了一些成果[13-14]。但是,隨著研究的深入,問題逐漸暴露出來:首先,在大多數物種中,AGO1基因家族都是有多個成員組成的,這些成員之間勢必存在著功能上的冗余,這就為遺傳學研究帶來了很大的困難,以擬南芥為例,在擬南芥目前已經鑒定的10個AGO1基因中僅有AGO1,AGO4,AGO7等基因有了明確的功能研究[15],其余的功能至今未知;其次,小RNA發揮功能過程,不僅僅是幾個基因的作用,還有很多基因參與其中,這其中就有一些是我們還未知的[4];最后,小RNA的行使功能的過程,并不僅僅是蛋白組分發揮作用,其中還有小RNA本身。基于上述原因,建議從生物化學的角度出發,結合分子生物學手段來解決這些問題。
[1] ZILBERMAN D,CAO X F,JACOBSEN S E.ARGONAUTE4control of locus-specific siRNA accumulation and DNA and histone methylation[J].Science,2003,299(5607):716-719.
[2] GRISHOK A,PASQUINELLI A E,CONTE D,et al.Genes and mechanisms related to RNA interference regulate expression of the small temporal RNAs that controlC.elegansdevelopmental timing[J].Cell,2001,106(1):23-24.
[3] MA J B,YE K,PATEL D J.Structural basis for overhang-specific small interfering RNA recognition by the PAZ domain[J].Nature,2004,429(6989):318-322.
[4] 宋雪梅,燕 飛,杜立新.RNA誘導沉默復合體中的生物大分子及其裝配[J].遺傳,2006,28(6):761-766.
SONG Xuemei,YAN Fei,DU Lixin.Components and assembly of RNA-induced silencing complex[J].Hereditas:Beijing,2006,28(6):761-766.
[5] 王 鵬,趙顯軍,朱國萍.植物 RNA沉默的分子機制研究進展[J].生命科學,2008,20(5):784-789.
WANG Peng,ZHAO Xianjun,ZHU Guoping.Progress in molecular mechanism of RNA silencing in plants[J].Chinese Bulletin of Life Sciences,2008,20(5):784-789.
[6] PERAGINE A,YOSHIKAWA M,WU G,et al.SGS3andSGS2/SDE1/RDR6are required for juvenile development and the production oftrans-acting siRNAs inArabidopsis[J].Genes &Development,2004,18:2368-2379.
[7] 奧斯伯F,布倫特R,金斯頓R.精編分子生物學實驗指南[M].第3版.顏子穎,王海林,譯.北京:科學出版社,1998.
AUSUBEL F,BRENT R,KINGSTON R.Short Protocols in Molecular Biology[M].3rd ed.Translated by YAN Ziying,WANG Hailin.Beijing:Science Press,1998.
[8] CLOUGH S J,BENT A F.Floral dip:A simplified method for agrobacterium-mediated transformation of arabidopsis thaliana[J].The Plant Journal,1998,16(6):735-743.
[9] CHENG M,FRY J E,PANG S,et al.Genetic transformation of wheat mediated by agrobacterium tumefaciens[J].Plant Physiology,1997,115(3):971-980.
[10] 宋 鋒,孫 敏,羅克明.一種基于PCR技術鑒定單拷貝轉基因煙草的方法[J].中國生物工程雜志,2010,30(4):83-88.
SONG Feng,SUN Min,LUO Keming.A simple and rapid PCR-based method for identifying transgenic tobacco plants carrying a single copy of the integrated gene[J].China Biotechnology,2010,30(4):83-88.
[11] 王文婧,劉 婷,郭 磊,等.SLC/AGO1基因控制擬南芥細胞分裂與定向伸長[J].植物學報,2011,46(4):370-378.
WANG Wenjing,LIU Ting,GUO Lei,et al.SLC/AGO1coordinates cell division and expansion in arabidopsis[J].Bulletin of Botany,2011,46(4):370-378.
[12] CARBONELL A,FAHLGREN N,GARCIA-RUIZ H A,et al.Functional analysis of threearabidopsisARGONAUTES using Slicer-defective mutants[J].Plant Cell,2012,24(9):3613-3629.
[13] 胥 猛,謝雯凡,潘惠新,等.楊樹ARGONAUTE基因的克隆及序列分析[J].林業科學,2011,47(3):46-51.
XU Meng,XIE Wenfan,PAN Huixin,et al.Cloning and characterization ofARGONAUTEgenes in populus[J].Scientia Silvae Sinicae,2011,47(3):46-51.
[14] de ALBA A E M,JAUVION V,MALLORY A C,et al.The miRNA pathway limits AGO1availability during siRNA-mediated PTGS defense against exogenous RNA[J].Nucleic Acids Research,2011,39(21):9339-9344.
[15] 楊燕燕,石林丹,王 西,等.本生煙AGO2全長基因的克隆及序列分析[A].中國植物病理學會2012年學術年會論文集[C].青島:中國植物病理學會,2012.65-69.
YANG Yanyan,SHI Lindan,WANG Xi,et al.The smokeAGO2fail full-length gene cloning and sequence analysis[A].Chinese Society for Plant Pathology,2012Academic Essays[C].Qingdao:Chinese Society for Plant Pathology,2012.65-69.

