CyclinD1和k-ras在宮頸癌中的表達及意義
劉惠琴 張志杰
(包頭市中心醫院婦產科,014040)
CyclinD1和k-ras在宮頸癌中的表達及意義
劉惠琴 張志杰
(包頭市中心醫院婦產科,014040)
目的 通過檢測CyclinD1和k-ras在宮頸癌組織(實驗組),正常宮頸組織(對照組),CINⅠ,CINⅡ,CINⅢ中表達水平的差異,探討它們在宮頸癌疾病發生發展中所起的作用和可能的分子機制,為宮頸癌的病因學研究提供理論依據。方法 采用免疫組織化學方法檢測宮頸癌患者15例,正常宮頸組織20例,CINⅠ 18例,CINⅡ 12例,CINⅢ 20例中CyclinD1和k-ras的表達情況,分析CyclinD1和k-ras在宮頸癌疾病發生、發展過程中的相互關系。結果 CyclinD1和k-ras與正常組織比較,在宮頸癌組織中表達明顯增高,隨著臨床分期的增加,蛋白表達增強差異有統計學意義(P<0.05);k-ras蛋白、CyclinD1蛋白與年齡、宮頸癌組織分型中其表達差異無統計學意義(P>0.05);而在分化程度和淋巴轉移方面差異有統計學意義(P<0.05);且在低分化組為66.7%和59.3%,在高、中分化組為23.7%和28.9%;有淋巴結轉移組為54.8%和63.0%,且CyclinD1和k-ras表達明顯呈正相關。結論 ①k-ras、CyclinD1蛋白的高表達與宮頸癌的發生密切相關,各種蛋白共同發揮了協同作用。②在宮頸癌疾病中CyclinD1和k-ras的表達強度增強,且二者表達明顯相關。
CyclinD1;k-ras;宮頸癌
宮頸癌是最常見的女性生殖系統惡性腫瘤,全世界每年約有50萬婦女患病,僅次于乳腺癌,是引起女性癌癥死亡的重要疾病之一,近年來宮頸癌的發病率有年輕化的趨勢,因此婦科腫瘤的準確診斷和預后的判斷是一個急需解決的問題[1]。宮頸癌的發生、發展及浸潤、轉移的過程非常復雜,多種基因的調控參與了整個過程。細胞周期和癌變不是獨立存在的,細胞周期的失調是細胞過度增殖而致癌變產生的重要原因[2]。Ras信號傳導通路與人類絕大多數腫瘤的發生、發展過程密切相關,該通路中的任何組分發生突變都會影響腫瘤細胞增殖、分化及凋亡。目前研究表明在許多惡性腫瘤組織中均發現Ras通路的異常激活。在黑素瘤、結腸癌、卵巢癌中等多種腫瘤中也發現了Ras的改變,Ras基因具有抑制腫瘤的功能[3]。CyclinD1是主要的G1期正調節因子,促進細胞G1-S期時相的轉換,被認為是原癌基因[4]過度表達的CyclinD1蛋白促進G/S期的轉換,從而加速腫瘤的發生進程[5]。因此,對Ras信號傳導通路的研究,不僅對認識腫瘤的發生發展及預防有重要意義,而且還可以通過干擾該通路的過度激活而達到在基因水平上治療腫瘤的目的。因此,研究者采用免疫組化技術檢測了不同病理類型、不同臨床分期的宮頸癌患者組織中k-ras和CyclinD1蛋白的表達情況,以探討其與宮頸癌的關系及相關的臨床意義。
1 資料和方法
1.1 研究對象和臨床資料
1.1.1 宮頸癌(實驗)組 選取內蒙古包頭市中心醫院婦產科2009—2011年經病理學檢查診斷為宮頸癌的組織標本15例,所有患者臨床資料完整,術前均未行放、化療。
1.1.2 CIN(實驗)組 選取內蒙古包頭市中心醫院婦產科2009—2011年經病理學檢查診斷為CINⅠ的組織標本20例,CINⅡ的組織標本18例,CINⅢ的組織標本12例,所有患者臨床資料完整,術前均未行放、化療。
1.1.3 正常宮頸(對照)組 選取經病理學檢查確診為正常宮頸的組織標本20例,所有患者臨床資料完整。
1.2 主要試劑 k-ras和CyclinD1蛋白抗體購自美國Santa Cruz公司,即用型SP免疫組化超敏試劑盒及DAB顯色試劑盒購自福州邁新生物公司。
1.3 免疫組化檢測 標本置于4%多聚甲醛固定48 h,石蠟包埋組織,常溫保存備用。4 μm石蠟切片常規脫蠟后,分別用于常規HE染色和免疫組化染色,免疫組化染色切片于3%過氧化氫甲醇液中室溫浸泡10~15 min阻斷內源性過氧化酶的活性,檸檬酸鈉緩沖溶液中高壓鍋加熱2 min進行抗原修復,1%小牛血清白蛋白室溫封閉30 min,加入一抗k-ras或CyclinD1蛋白抗體,抗體稀釋比例均為1∶100,置于濕盒中4℃過夜,PBS沖洗滴加辣根過氧化物酶標記的二抗,室溫繼續孵育30 min,PBS沖洗后DAB顯色,洗滌,蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封固,鏡下觀察。k-ras蛋白細胞陽性結果為細胞核和(或)胞漿的黃色或棕黃色染色顆粒;CyclinD1蛋白以細胞核內出現淡黃色至棕褐色顆粒為陽性表達細胞;陰性表達細胞呈藍紫色。陽性標準:在高倍鏡下隨機選擇5個視野,每個視野計數100個細胞,陽性細胞數<10%為陰性表達,>10%為陽性表達。
1.4 統計分析 運用SPSS 17.0軟件包對數據進行統計分析,處理數據,計數資料采用χ2檢驗,檢驗水準α=0.05。相關性分析采用Pearson。
2 結果
2.1 k-ras蛋白和CyclinD1蛋白免疫組化在宮頸癌組織中的表達情況 k-ras蛋白細胞陽性結果為細胞核和(或)胞漿的黃色或棕黃色染色顆粒;CyclinD1蛋白以細胞核內出現淡黃色至棕褐色顆粒為陽性表達細胞;陰性表達細胞呈藍紫色(圖1)。
2.2 k-ras蛋白在不同臨床分期的表達情況比較 k-ras蛋白定位于細胞核,與正常組織比較,k-ras蛋白在宮頸癌組織中表達明顯增高(P<0.05)。隨著臨床分期的增加k-ras蛋白則隨著宮頸癌臨床分期的增加陽性率顯著升高(P<0.05,表1)。
2.3 CyclinD1蛋白在不同期別的表達情況比較 CyclinD1蛋白定位于細胞核,與正常組織比較,CyclinD1蛋白在宮頸癌組織中表達明顯增高(P<0.01)。隨著臨床分期的增加CyclinD1蛋白則隨著宮頸癌臨床分期的增加陽性率顯著性升高(P<0.01,表2)。
2.4 CyclinD1蛋白在宮頸癌中的表達與臨床病理特征的關系 在宮頸癌中,CyclinD1的陽性表達率在年齡、病理類型之間比較差異無統計學意義(P>0.05);在組織學分型、淋巴結轉移與否之間比較差異有統計學意義(P<0.05,表3)。
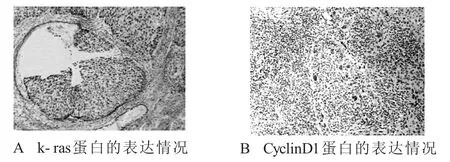
圖1 k-ras蛋白和CyclinD1蛋白免疫組化在宮頸癌組織中的表達
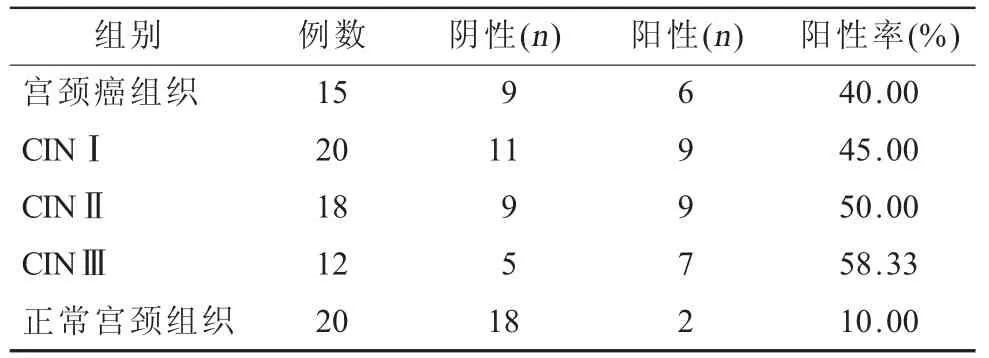
表1 k-ras蛋白在不同期別的表達情況比較

表2 CyclinD1蛋白在不同期別的表達情況比較
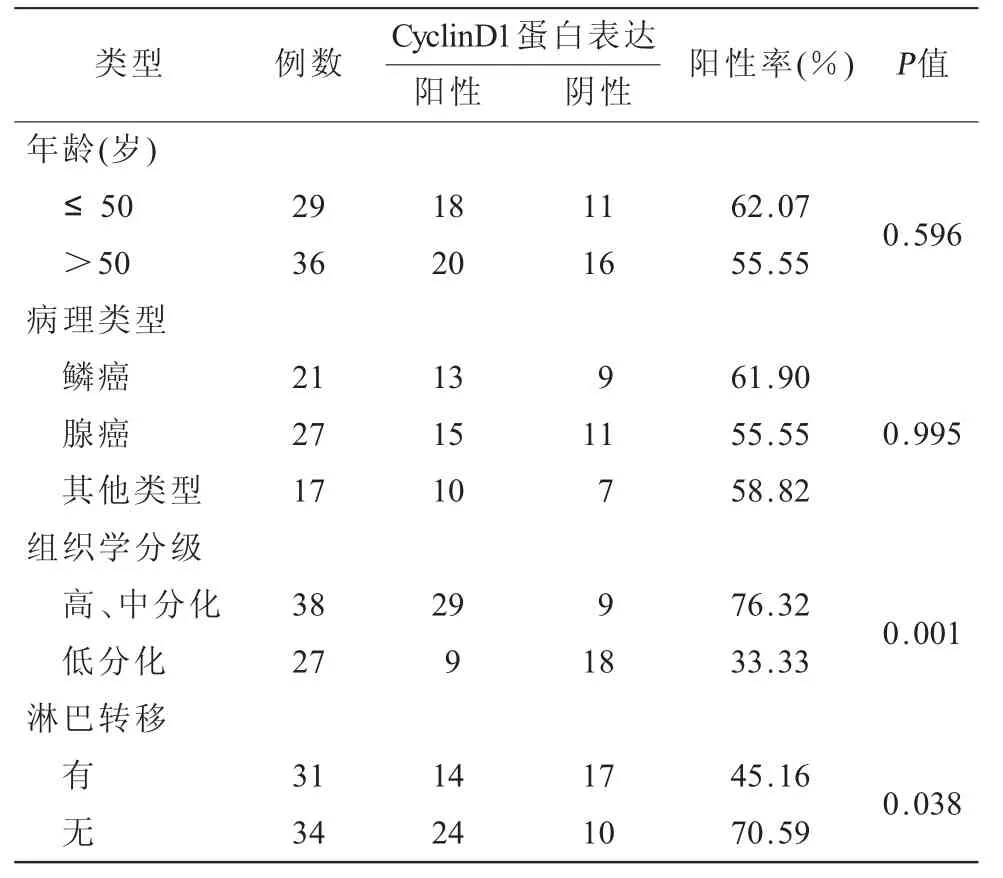
表3 CyclinD1蛋白在宮頸癌中的表達
2.5 k-ras蛋白在宮頸癌中的表達與臨床病理特征的關系在宮頸癌中,k-ras的陽性表達率在年齡、病理類型之間比較差異無統計學意義(P>0.05);在組織學分化程度、是否有淋巴結轉移之間比較差異有統計學意義(P<0.05,表4)。2.6 CyclinD1蛋白與k-ras蛋白相關性研究 在36例卵巢上皮癌中,CyclinD1的表達與k-ras呈正相關(r=0.52,P<0.00,表5)。
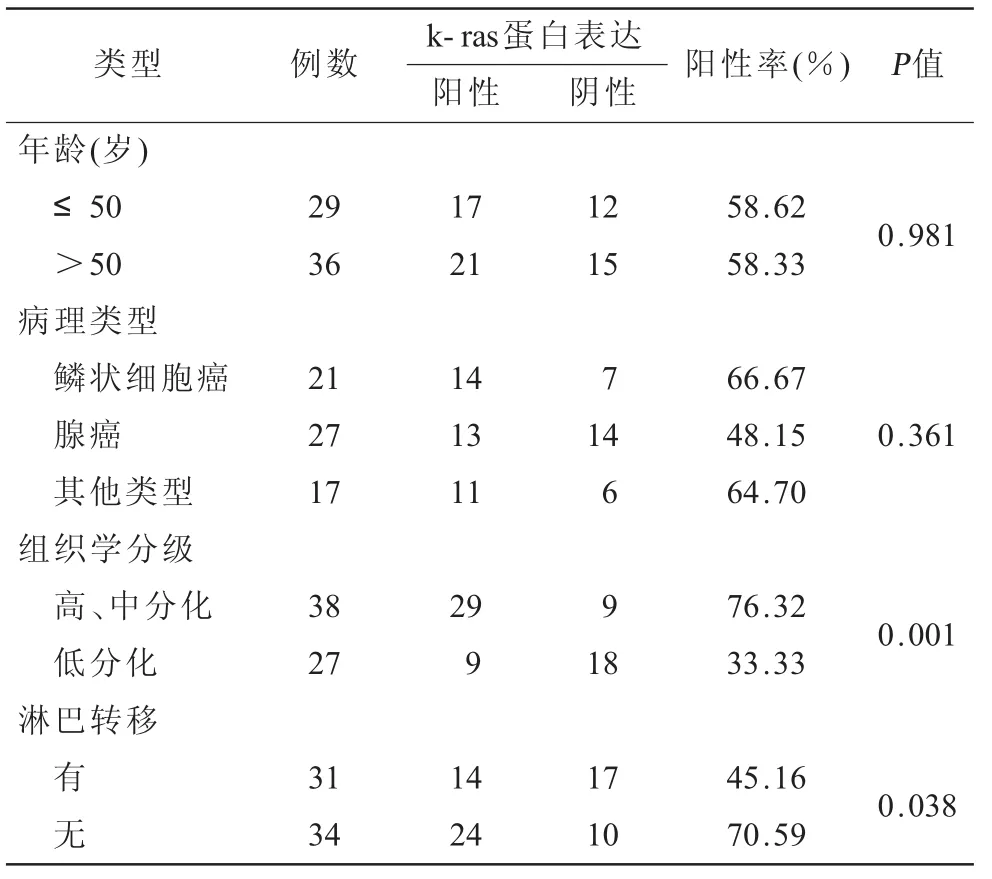
表4 k-ras蛋白在宮頸癌中的表達
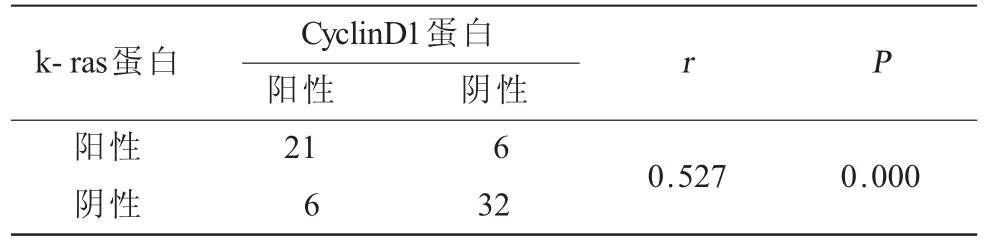
表5 CyclinD1蛋白與k-ras蛋白相關性
3 討論
腫瘤的發生發展是一個逐步的多階段過程,主要與癌基因的激活與抑癌基因的失活及機體免疫調節機制失衡等病理改變有關,引起細胞異常改變,導致組織癌變[6]。近年來有關信號傳導通路與腫瘤發生的相關性研究已成為新的研究方向,目前對Ras/Raf/MAPK信號通路及其下游靶基因CyclinD1在腫瘤研究很多,像在瘢痕組織中研究多見,認為Ras/Raf/MAPK信號通路及其下游靶基因CyclinD1的異常表達或基因突變,與多種腫瘤的發生、發展密切相關[7]。Ras基因是一種癌基因,激活后的Ras基因主要是通過Ras/Raf/MAPK和PI3K/AKT兩條通路介導腫瘤的發生[8],Ras基因激活后可以激活其下游的MAPK信號通路而引起MAPK酶級聯放大作用,使信號向下傳遞。在Ras/Raf/MAPK及其下游靶基因CyclinD1信號傳遞過程中,CyclinD1是信號通路上的重要靶基因。研究證實Ras信號通路在腫瘤的發病中以及在控制細胞生長和分化中起重要作用[9]。有研究報道Ras癌基因可以通過上調CyclinD1的表達加速細胞周期的進程[10],提示Ras與CyclinD1之間有一定的相關性。激活的Ras信號通路使CyclinD1積聚,導致細胞進入靜息狀態[11]。CyclinD1是細胞周期的正調節因子,與細胞周期蛋白依賴性激酶(CDK4/6)結合后,促使細胞從G1期順利進入S期,使細胞發生分裂與增殖,因此CyclinD1蛋白的過度表達會使增殖周期不斷進行,導致腫瘤的發生。國內外的研究已發現,CyclinD1在多種腫瘤中表達明顯增高[12]。
3.1 k-ras蛋白與CyclinD1蛋白在不同組別的表達情況分析 本研究發現,k-ras蛋白與CyclinD1蛋白和正常組織比較,在宮頸癌組織中表達明顯增高。隨著臨床分期的增加,蛋白則隨著宮頸癌臨床分期的增加陽性率顯著升高。這與郭艷萍等[12]有關CyclinD1蛋白的研究結論一致,與胡成久等[13]對于皮膚瘢痕癌中關于k-ras蛋白研究結論一致,說明CyclinD1蛋白、k-ras蛋白的表達與宮頸癌的發生有關,并可以作為判斷宮頸癌臨床進展的指標。
3.2 k-ras蛋白與CyclinD1蛋白在宮頸癌中的表達與臨床病理特征的關系 在對年齡組和宮頸癌組織分型中發現,k-ras蛋白與CyclinD1蛋白表達沒有差別,而在分化程度和淋巴轉移方面有差異,這與汪鑫和白冬雨等[14-15]報道關于k-ras基因表達與那些因素相關的結論部分一致。k-ras蛋白在宮頸癌的不同時期表達均明顯高于正常,并隨分化程度的增加、淋巴結轉移而升高,說明k-ras作為癌基因啟動基因,其表達高可以激活CyclinD1表達,促進宮頸癌組織癌的發生、發展。本研究中k-ras高表達者大部分為組織學分化低、轉移率發生高的患者,提示k-ras蛋白和基因的檢測可以作為宮頸癌嚴重程度參考指標之一。CyclinD1在宮頸癌的不同時期表達均明顯高于正常,并隨分化程度的增加、淋巴結轉移而升高,這與郭艷萍等[12]研究相似,說明CyclinD1作為癌基因在宮頸癌組織的發生、發展中起重要作用。本研究中CyclinD1高表達者大部分(50%以上)為組織學分化低、轉移率發生高的患者,提示CyclinD1蛋白可作為預測宮頸癌預后的參考指標之一。
3.3 CyclinD1蛋白與k-ras蛋白相關性 本研究發現CyclinD1蛋白與k-ras蛋白呈正相關,有關此研究報道較少,但是本研究證實了宮頸癌發生時通過k-ras激活Ras/Raf/MAPK通路及其下游靶基因CyclinD1信號傳遞而實現的,所以其表達具有相關性。
綜上所述,腫瘤的發生是各相關基因相互作用的結果,而引起細胞增殖周期紊亂并導致細胞的無調控增殖。Ras/Raf/MAPK→CyclinD1信號傳導通路上的靶基因Ras、MAPK、CyclinD1三者的關系密切,Ras蛋白的過度表達是開啟此信號通路的鑰匙,而MAPK蛋白的表達則把信號從細胞外轉到細胞內,最終信號通路上的所有信號激活CyclinD1,CyclinD1的異常表達使細胞的增殖失控,導致腫瘤的發生[16]。
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J]. CA Cancer J Clin,2010,60(5):277.
[2]Anderson MC.Invasive carcinoma of the cervix following local destructive treatmentforcervicalintraepithelialneoplasia[J]. Br J Obstet Gynecol,1993,100(7):657-663.
[3]McCubreyJA,Steelman LS,ChappellWH,etal.Rolesof the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[4]Chang ZG,Wei JM,Qin CF,et al.Receptor inhibits epithelial mesenchymal transition in human pancreatic cancer PANC-1 cells[J].Dig Dis Sci,2012,57(5):1181-1189.
[5]GaoP,Zhou GY,Liu Y,etal.Alteralion ofcyclinD1 in gastric carcinoma and its clincopathologic significance[J].World J Gastrornterol,2004,10(20):2936-2939.
[6]張曉金,歸綏琪.宮頸癌發病機制的研究進展[J].中國婦幼健康研究,2008,19(1):56-59.
[7]趙萌,劉月平,劉世正,等.食管鱗癌中ERK及其活化形式蛋白的表達及意義[J].臨床與實驗病理學雜志,2011,27(11):1173-1176.
[8]Mccubrey JA,Steelman LS,ChappellWH,etal.Roles of the Raf/MEK/ERK pathway in cell growth malignant transformationand drug resistance[J].Biochim Biophys Acta,2007,1773 (8):1263-1264.
[9]鄧開玉,田小英.PTEN和K-ras與子宮內膜癌關系的研究進展[J].中華腫瘤防治雜志,2011,18(15):1217-1220.
[10] 喻小蘭,盧科蓮,夏紀毅,等.Ras、CyclinD1在宮頸癌中的表達及黃芩素對其表達的影響[J].繼續醫學教育,2014,28(2):19-22.
[11]Coleman ML,MarshallCJ,Olson MF.Ras promotes p21 (Waf1/Cip1)protein stability via a cyclin D1-imposed block in proteasome-mediated degradation[J].EMBO J,2003,22 (9):2036-2046.
[12]郭艷萍,楊廣英,王建君.PTEN、STAT3和CyclinD1蛋白在宮頸癌中的表達及意義[J].中國婦幼保健,2012,27 (15):2344-2346.
[13]胡成久,郭瑞珍.K-RAS蛋白的表達、基因突變在皮膚瘢痕癌組織中的意義[J].中國現代醫學雜志,2013,23 (1):22-253.
[14] 汪鑫,聶紹發,徐曉,等.大腸癌中p21基因表達的研究[J].九江醫學,2003,18(2):63-65.
[15] 白冬雨,張海萍,鐘山,等.結直腸癌K-ras基因突變位點的檢測及其臨床意義[J].中國普通外科雜志,2012,21(10):1222-1226.
[16]郭瑞珍,王海青,歐小波.Ras、MAPK、CyclinD1與皮膚瘢痕癌的相關性研究[J].臨床與實驗病理學雜志,2013,29(4):393-397.
Objective To detect CyclinD1 and k-ras in cervical cancer tissue(experimental group)and in normal cervical tissue(control group),and the differences in the expression level of CINⅠ,CINⅡ,and CINⅢ,to explore their function and possible molecular mechanisms in development and progression of cervical diseases and so as to provide theoretical basis for the study of the etiology of cervical cancer.Methods Immunohistochemistry was adopted to detect the expression status of CyclinD1 and k-ras among 15 cases with cervical cancer,20 cases with normal cervical tissue,18 cases with CINⅠ,12 cases with CINⅡand 20 cases with CIN,and the interrelation between CyclinD1 and k-ras and the development and progression of cervical diseases.Results The expression of CyclinD1 and k-ras was significantly higher in cervical cancer tissue than in normal tissue.With increasing clinical stage,the protein expression increased with differences of statistical significance(P<0.05).The expression of CyclinD1 and k-ras was not statistically different in ages and the types of cervical cancer tissue(P>0.05),while the differences were of statistical significance in differentiation degree and lymphatic metastasis.The expression was 66.7%and 59.3%in poorly differentiated group,while 23.7%and 28.9%in highly and moderately differentiated group.It was 54.8%and 63.0%in lymphatic metastasis group,which was significantly positively correlated with the expression of CyclinD1 and k-ras. Conclusion It was closely related to the high k-ras and CyclinD1 protein expression and the occurrence of cervical cancer,and the various proteins play a role of synergies;Expression strenth of k-ras CyclinD1 in cervical diseases get enhanced,and both were significantly correlated.
CyclinD1;k-ras;Cervical cancer
2014-05-26)
1005-619X(2014)09-0775-03
10.13517/j.cnki.ccm.2014.09.004

