煙草內生細菌分離方法的優化研究
陳澤斌,代方平,寸林江,李,陳艷芳,許石劍,方飛,黃楊
1昆明學院農學院,云南省高校都市型現代農業工程研究中心,昆明 650214;
2 云南省煙草農業科學研究院,云南 玉溪 653100;
3黔西州煙草公司興仁縣分公司,貴州 興仁 562300;
4德宏州環境保護局,云南 芒市678400;
5無錫園林建設工程管理處,江蘇 無錫 214072
煙草內生細菌分離方法的優化研究
陳澤斌1,2,代方平1,寸林江1,李1,陳艷芳1,許石劍3,方飛4,黃楊5
1昆明學院農學院,云南省高校都市型現代農業工程研究中心,昆明 650214;
2 云南省煙草農業科學研究院,云南 玉溪 653100;
3黔西州煙草公司興仁縣分公司,貴州 興仁 562300;
4德宏州環境保護局,云南 芒市678400;
5無錫園林建設工程管理處,江蘇 無錫 214072
用研磨組織稀釋分離法與表面消毒有效性評價相結合的方法確定了適宜煙草組織的表面消毒方法以及內生細菌分離培養基。采用1%次氯酸鈉浸泡5 min,再用75%酒精浸泡2分鐘能夠100%去除表面附生菌,并且分離得到更多的內生細菌。研究比較了TSA、NA、PDA、LB 四種常用的細菌分離培養基在分離煙草內生細菌中的差異,其中TSA和NA培養基分離得到的內生細菌數量較高,TSA培養基從煙草根、莖、葉中分離出的內生細菌數量分別為5.18 log cfu/g.fw、2.17 log cfu/g.fw、4.69 log cfu/g.fw;NA培養基分別為5.01 log cfu/g.fw、1.81 log cfu/g.fw、4.93 log cfu/g.fw。對分離得到的127株內生細菌進行16S rDNA序列測定表明,TSA和NA培養基分離得到的內生細菌種類最多,其中TSA培養基分別從根、莖、葉中分離到9、7、13種內生細菌;其次是NA培養基,分別從根、莖、葉中分離到8、6、10種內生細菌。結果表明,采用TSA和NA培養基分離煙草內生細菌,可以達到較為理想的分離效果。
煙草;內生細菌;分離;優化
植物內生菌(Endophyte)是在其生活史的一定階段或全部階段生活于健康植物各種組織和器官內部的微生物,屬于植物組織內的正常菌群[1]。世界上大約有30萬種植物,目前人們僅僅研究了幾百種植物的內生細菌,在已經研究的植物當中,幾乎每種植物都具有豐富的內生細菌存在。人們從中不僅分離鑒定出多種細菌新種,還獲得了一大批具有防病,促生或內生固氮等生物學功能的內生細菌,顯示出了良好的研究和應用前景[2-5],內生細菌已成為植物學、微生物學、植物保護學及植物育種學等多學科的研究熱點。
在植物內生細菌的研究中,不同學者針對不同的植物樣品采用不同的分離培養方法。由于培養基營養物質成分、離子濃度以及酸堿度等條件不同,導致不同培養基對于微生物具有不同選擇性[6-7],而且不同的稀釋梯度、消毒劑的選擇及其消毒時間對微生物分離數量也有影響。本文通過不同消毒劑、消毒時間、培養基的優化組合,探討適宜其內生細菌分離條件,建立和完善煙草內生細菌分離體系和培養方法。為后續的內生細菌多樣性研究奠定基礎。
1 材料與方法
1.1 樣品采集
2012年8月下旬,取云南玉溪世界煙草品種園煙草品種K326成熟期的根、莖、葉為試驗材料,選擇生長良好、無病害健康植株。取樣后立即放入樣品袋中,低溫保鮮,在24 h之內進行內生細菌的分離。
1.2 培養基及主要試劑
培養基配方見表1,細菌基因組DNA提取試劑盒、16S rDNA片段擴增所用的各種酶、Marker、dNTPs、Buffer等試劑為寶生物工程(大連)產品;其余試劑均為國產分析純。
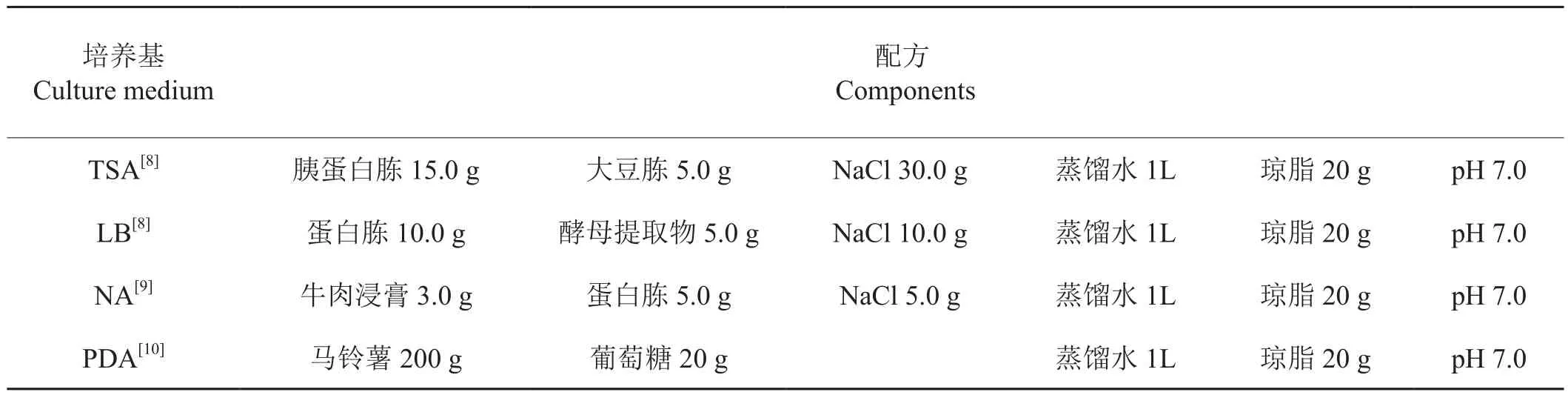
表1 培養基配方Tab.1 Culture medium components
1.3 分離培養條件的選擇
1.3.1 消毒劑及消毒時間的選擇
用0.1% SDS浸泡根、莖和葉片樣品10 min,再用自來水沖洗表面,濾紙吸去水分,隨機取3種樣品各0.4 g,無菌條件下分別采用6種方法消毒處理(見表2)。分別取最后一次無菌水沖洗液200 μL涂布NA固體培養基,每處理3次重復,28 ℃條件下培養3 d,并設無菌水沖洗組織做對照,記錄各處理菌落數量,計算表面除菌率。表面除菌率=(未經消毒劑處理的材料表面細菌數-消毒劑處理后的材料表面細菌數)/ 未經消毒劑處理的材料表面細菌數×100%[11]。

表2 三種消毒劑及其不同的消毒處理方式Tab.2 Different treatments of three chemical reagents
1.3.2 培養基種類的選擇
按1.3.1中處理5的方法將煙草的根、莖、葉各0.4 g消毒處理后用無菌水沖洗4次,無菌濾紙吸去表面水分后,分別與一大一小滅菌鋼珠一并放入2mL滅菌離心管,加入600 μL無菌水,用QIAGEN高通量組織研磨器研磨3 min,頻率為30 r/s。研磨后的汁液用無菌水梯度稀釋至10-4,取10-2,10-3,10-4三個稀釋度的菌懸液各200 μL分別涂布于TSA、NA、PDA、LB平板上;同時取最后一次植物組織沖洗液200 μL分別涂布TSA、NA、PDA、LB平板上為對照,每濃度涂3個平板。將平板倒置于28 ℃恒溫培養箱培養3 d,觀察不同培養基及不同稀釋度下菌落生長情況,根據菌落的形態和數量確定適宜的培養基種類。
1.4 菌落計數
選取合適的濃度(每皿30-300個菌落)計數菌落,計算每克植株鮮重所含的活菌數cfu/g.fw =(菌落數×稀釋倍數×分離用水量)/(涂板用水量×分離組織重量)。并轉換成對數值log cfu/g.fw(Colony-Forming Units Per Gram Fresh Weight)。
1.5 內生細菌的分離和保存
按1.3.1中處理5的方法進行表面消毒,以TSA、NA、PDA、LB作為分離培養基,分離培養煙草根、莖、葉內生細菌,每處理重復3次。28 ℃黑暗培養3 d后取出,用記號筆從背面標出形態相異的菌落,編號并統計。挑取單菌落于NA斜面28 ℃培養3 d后4 ℃冰箱保存備用。
1.6 內生細菌的鑒定
按文獻[12]的方法。
1.7 數據統計與分析
采用WPS Of fice 2012個人版軟件和DPS7.5軟件對數據進行統計分析。
2 結果與分析
2.1 消毒劑及消毒時間的選擇
不同消毒處理對煙草不同組織的表面除菌效果不同(表3)。三種消毒劑除菌能力的大小依次為:0.1%升汞 > 1%次氯酸鈉 > 75%酒精。處理3中,0.1%的升汞不需要與1%次氯酸鈉配合使用除菌率就能達到100%;在處理6中,只用75%酒精單獨處理,未用0.1%升汞與1% NaClO浸泡,表面除菌效果相比其它五種處理較差,對煙草各組織表面的除菌率為55% -100%,這可能與煙草各器官的組織致密性及所處生長環境有關。試驗結果表明處理1、2、3、4、5均能徹底滅活植物組織表面的微生物。從不同消毒處理后內生細菌的數量來看(表4),處理5從根、莖、葉分離到的內生細菌數量均比處理1、2、3、4要多。可能是因為處理1、2、3、4用0.1%升汞或1%NaClO消毒浸泡的時間均比處理5時間長,消毒劑滲入植物組織殺死了部分內生細菌,鑒于此,在保證表面消毒效果的前提下,為了分離得到更多的內生菌,選擇處理5的消毒劑組合和消毒時間進行后續試驗。

表3 各組織不同表面消毒時間的除菌率Tab.3 Sterilization rate of different tissue samples by different disinfectants
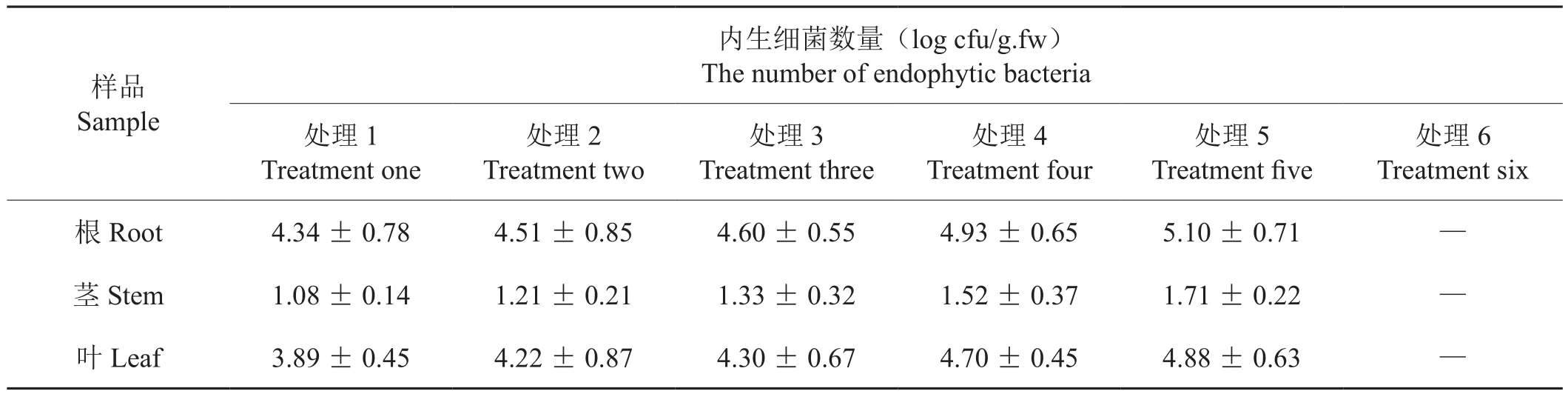
表4 不同消毒處理后內生細菌分離數量Tab.4 Numbers of endophytic bacteria after different sterilization treatments
2.2 不同培養基對煙草內生細菌分離數量的影響
采用處理5方法表面消毒后,研磨各無菌材料,梯度稀釋后涂布于4種培養基上(圖1),培養3 d后對菌落進行計數,不同培養基的內生細菌分離數見表5。分離數由多到少依次為:TSA > NA > LB >PDA。其中TSA和NA培養基分離得到的內生細菌數量最高,與其它培養基分離得到的內生細菌數量相比差異顯著(α=0.05)。TSA培養基從煙草根、莖、葉中分離出的內生細菌數量分別為5.18 log cfu/g.fw、2.17 log cfu/g.fw、4.69 log cfu/g.fw;NA培養基從煙草根、莖、葉中分離出的內生細菌數量分別為5.01 log cfu/g.fw、1.81 log cfu/g.fw、4.93 log cfu/g.fw。結果表明,利用TSA培養基和NA培養基能夠分離出更多的煙草內生細菌。同時還發現,上述4種培養基對煙草根、莖、葉內生細菌分離的菌落數量由多到少依次為:根 > 葉 > 莖,暗示煙草根、莖、葉內生細菌的數量存在差異。
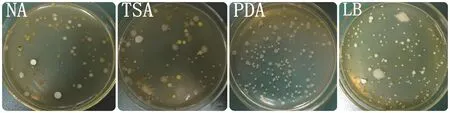
圖1 不同培養基對煙草葉片內生細菌分離的效果(10-3)Fig.1 Separationeffect of endophytic bacteria isolated from tobacco leaves using different medium (10-3)
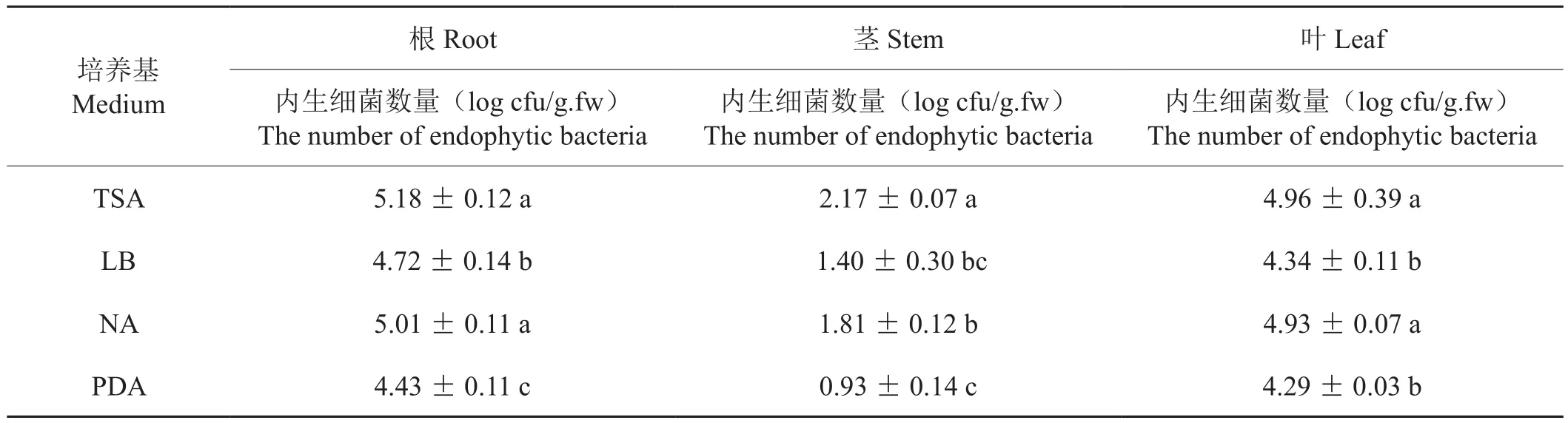
表5 不同培養基對煙草內生細菌分離數量的影響Table 5 Numbers of endophytic bacteria isolated from tobacco using different medium
2.3 不同培養基對煙草內生細菌分離種類的影響
PCR擴增得到不同培養基上分離得到的127株內生細菌的16S rDNA片段,委托上海英駿生物技術公司對16S rDNA片段進行序列測定,通過BLAST尋找與目的序列同源性最高的已知分類地位菌種的16S rDNA序列進行比較鑒定,結果見表6,不同培養基分離得到內生細菌種類數由多到少依次為TSA >NA > LB > PDA,其中TSA培養基分離得到的細菌種類最多,分別從根、莖、葉分離到9、7、13種細菌;其次是NA培養基,分別從根、莖、葉分離到8、6、10種細菌。LB和PDA培養基上雖然也可以分離出大量的內生細菌,但分離出來的菌落較單一(圖1),而TSA和NA平板則可以分離出較多的具有不同菌落形態和顏色的內生細菌;利用LB和PDA培養基分離到的菌株,通過TSA和NA培養基大部分都能夠分離到(表6),表明TSA和NA培養基為分離煙草內生細菌的最適宜培養基。同時還發現,4種培養基對煙草根、莖、葉內生細菌分離的種類數量由多到少依次為:葉 > 根 > 莖,說明煙草不同器官中內生細菌的種類存在差異。
3 討論
內生細菌的分離程序中,表面消毒是關鍵步驟,選擇合適的消毒劑和消毒時間在內生細菌的前期研究中是非常重要的,既要保證能除掉表面的附生菌,又要能最大限度的不對組織造成破壞從而影響內生細菌的長出[13]。鑒于此,本研究綜合考慮表面滅菌效果以及各消毒處理后分離出的內生細菌數量,選擇處理5的消毒劑組合和消毒時間進行后續試驗。
在培養基選擇方面,本研究利用目前普遍采用的4種細菌培養基分離煙草內生細菌,發現TSA和NA培養基分離出的煙草內生細菌無論從數量上還是種類上都顯著優于其它培養基的分離效果;可以認為TSA和NA培養基是分離煙草內生細菌的最適宜培養基。同時發現,不同煙草器官中的內生細菌的數量和種類存在一定的差異,暗示內生細菌在煙草植株中分布不均勻,且寄生程度不同,不同器官和內生細菌之間可能有相互選擇的關系。己有的研究發現內生細菌的種群密度取決于植物品種、植物的基因型、植物組織、植物生長期和環境條件[14-15],本研究也體現了這一特點。
本研究表明煙草根、莖、葉內均存在大量的內生細菌,其中以根中最多,其次為葉,莖中最少。文獻報道的黃瓜、豆類等大多數植物內生細菌的數量分布規律總體為[16-17]:地下組織高于地上組織,根中最多,其次是莖和葉片,這與本研究得出的結果一致。
此外,不同培養基分離得到的內生細菌的種群數量存在一定差異。在分離得到的全部種類的菌株中,發現個別種類的菌株只在一種或者幾種培養基上被分離得到,例如從根部分離得到的海水芽孢桿菌,只在TSA培養基上被分離到;木膠節桿菌只在LB培養基上被分離到;嗜硼芽孢桿菌只在NA培養基上被分離到;腸桿菌只在PDA培養基上被分離到。T abacchioni等[18]在關于玉米根際微生物遺傳多樣性的報道中也指出,利用不同分離培養基得到的根際微生物的種群數量存在一定差異。孫曉棠等[19]的研究也證實不同培養基分離得到番茄根際細菌的種群數量存在一定差異。胡元森等[20]在利用DGGE方法研究不同培養基分離土壤細菌的研究中也曾報道,在分離土壤細菌的7種培養基上均可培養的細菌只占6.25%,其他可培養細菌只在幾種甚至一種培養基中分離得到。這與本研究得出的結果一致。這可能是因為不同培養基對不同種類菌株的選擇壓力不同所造成的,有待進一步研究。
利用TSA和NA培養基能分離到較多數量和種類的內生細菌,然而其它培養基又能分離到TSA和NA培養基分離不到的種類的細菌。說明在分離植物內生細菌的過程中,應盡可能采用多種具有不同選擇性的分離培養基,這樣才能得到較為豐富的植物內生細菌資源。
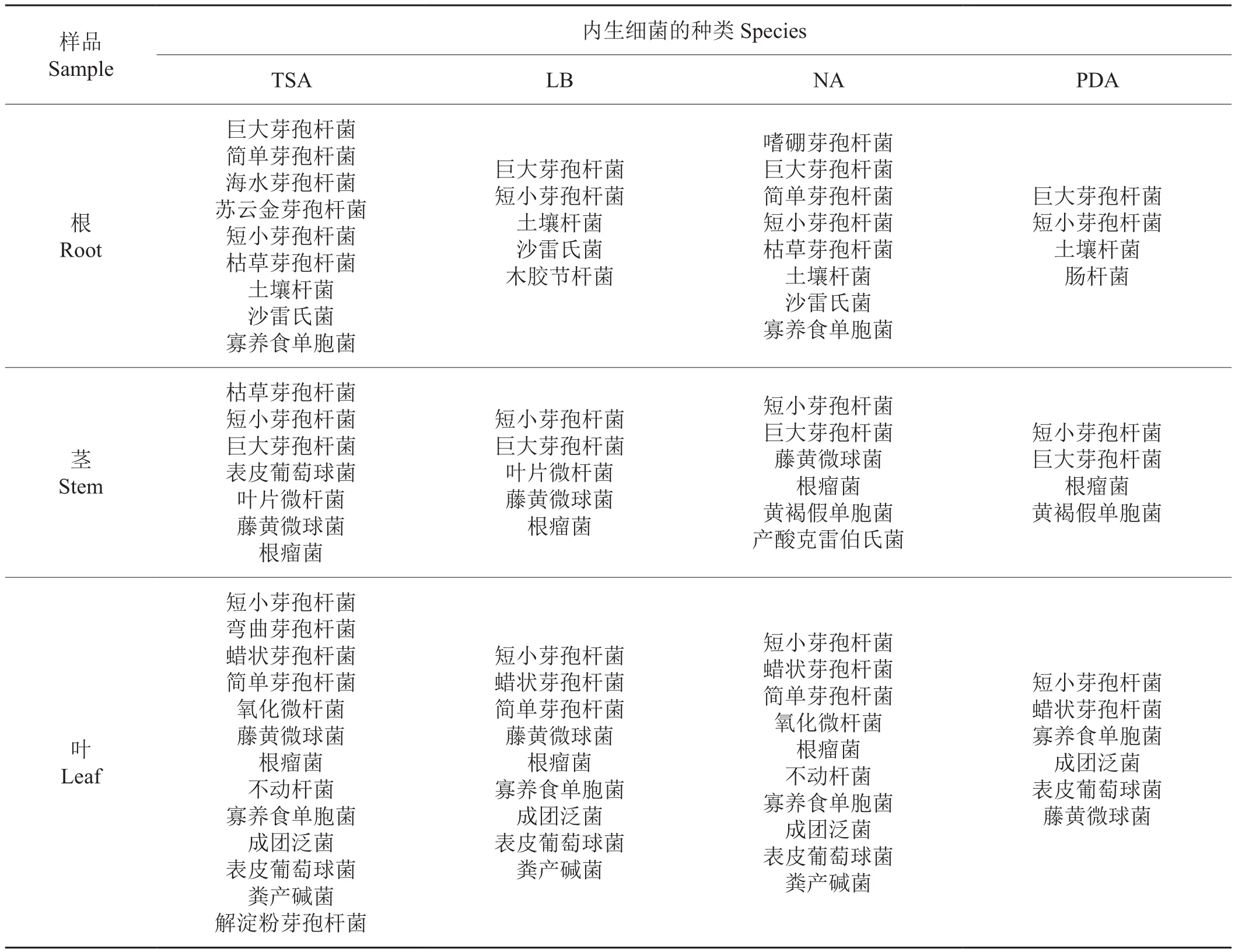
表6 不同培養基對煙草內生細菌分離種類的影響Tab.6 Species of endophytic bacteria isolated from tobacco using different medium
[1]Sturz A,Christie B,Nowak J.Bacterial endophytes potential role in developing sustainable systems of crop production[J].Critical Reviews in Plant Sciences,2000,19(1):1-30.
[2]鄒文欣,譚仁祥.植物內生菌研究新進展[J].植物學報,2001,43(9):881-892.
[3]何紅,邱思鑫,胡方平,等.植物內生細菌生物學作用研究進展[J].微生物學雜志,2004,24(3):40-44.
[4]潘學武,董妍玲,鄒笑笑.喜樹內生真菌的研究進展[J].安徽農業科學,2013,41(1):90-91.
[5]黃麗,張榮易,譚志瓊,等.海南五指山野生美花蘭根部內生真菌研究[J].西南農業學報,2012,25(2):657-660.
[6]張萍,宋希強.蘭科植物內生細菌物種多樣性及其促生機理研究進展[J].熱帶亞熱帶植物學報,2012,20(1):92-98.
[7]張則君,張曉宇,劉宏,等.植物內生細菌分離鑒定方法概述[J].農業技術與裝備,2012,11(250):75-77.
[][]
[8]王剛,李志強.小麥內生細菌的分離及其對小麥紋枯菌的拮抗作用[J].微生物學通報,2005,32(2):20-24.
[9]易龍,肖崇剛,馬冠華,等.防治煙草赤星病有益內生細菌的篩選及抑菌作用[J].微生物學報,2004,44(1):19-22.
[10]喬宏萍,黃麗麗,康振生.小麥內生細菌及其對根莖部主要病原真菌的抑制作用[J].應用生態學報,2004,17(4):690-694.
[11]路國兵,冀憲領,張瑤,等.桑樹內生細菌的分離及生防益菌的篩選[J].蠶業科學,2007,33(3):350-354.
[12]陳澤斌,夏振遠,雷麗萍,等.煙草可培養內生細菌的分離及多樣性分析[J].微生物學通報,2011,38(9):1347-1354.
[13]Barraquio W L,Revilla L,Ladha J K.Isolation of endophytic bacteria from wetland rice[J].Plant and Soil,1997,194:15-24.
[14]Schulz B,Rommert A K,Dammann U,et al.The endophyte-host interaction:a balanced antagonism? [J].Mycol Res,1999,103:1275-1283.
[15]Pamela D,Adams,Joheph W,et al.Effect of host genotype on indigenous bacterial endophytes of cotton (Gossypium hirsutum L.)[J].Plant and soil,2002,240(1):181-189.
[16]何紅,蔡學清,洪永聰,等.辣椒內生菌BS-2在白菜體內的定殖、促生和防炭疽病作用[J].植物保護學報,2004,31(4):347-352.
[17]方揚,張小平,陳露遙,等.天府花生內生細菌種群多樣性研究[J].西南農業學報,2008,21(2):353-358.
[18]Tabacchioni S,Chiarini L,Bevivino A,et al.Bias caused by using different isolation media for assessing the genetic diversity of a natural microbial populations[J].Microbial Ecology,2000,40(3):169-176.
[19]孫曉棠,姚青,劉瓊光,等.利用DGGE評價不同培養基回收番茄根際細菌類群的能力[J].微生物學報,2006,46(3):482-486.
[20]胡元森,李翠香,孫富林,等.不同培養基組合提高土壤細菌可培養性的研究[J].微生物學報,2007,47(5):882-887.
Research on separation optimization of endophytic bacteria in tobacco
CHEN Zebin1,2,DAI Fangping1,CUN Linjiang1,LI Qi1,CHEN Yanfang1,XU Shijian3,FANG Fei4,HUANG Yang5
1 Engineering Research Center for Urban Modern Agriculture of Higher Education in Yunnan Province,Agriculture School,Kunming University,Kunming 650214,China;
2 Yunnan Academy of Tobacco Agricultural Sciences,Yuxi 653100,Yunnan,China;
3 Xingren Branch of Qianxinan Municipal Tobacco Campany,Xingren 562300,Guizhou,China;
4 Environmental Protection Bureau of Dehong District,Mangshi 678400,Yunnan,China;
5 Wuxi Park Construction and Engineering Management Department,Wuxi 214072,Jiangsu,China
The best surface sterilization method and isolation medium of endophytic bacteria in tobacco were determined by grinding separation and surface sterilization ef ficacy check.Results showed that isolation and disinfection effect of soaking by 1% NaClO (5 min) +75% alcohol (2 min) was better in that surface epiphytic bacteria can be 100% eliminated and more bacteria can be separated.Four isolating media including Nutrient Agar (NA),Tryptic Soy Agar (TSA),Potato Dextrose Agar (PDA),Luria - Bertani medium (LB) were utlized to isolate endophytic bacteria from tobacco,aiming at comparing difference of isolation effect between them.Results showed that the isolation effect of TSA and NA was better than that of other media,while LB and PDA showed the lowest isolation effect.The amount of bacteria isolated from root,stem,leaf by TSA medium were 5.18 log cfu/g.fw,2.17 log cfu/g.fw,4.69 log cfu/g.fw respectively.The amount of bacteria isolated from root,stem,leaf by NA medium are 5.01 log cfu/g.fw,1.81 log cfu/g.fw,4.93 log cfu/g.fw respectively.The 16S rDNA of 127 endophytic strains were sequenced.Nine,seven and 13 different kinds of bacteria were isolated from root,stem,leaf by TSA medium respectively while only 8,6 and 10 different kinds of bacteria isolated from root,stem,leaf by NA medium.These results indicated that TSA and NA medium were suitable for isolating endophytic bacteria in tobacco by which ideal separating effect can be obtained.
tobacco;endophytic bacteria;separation;optimization
10.3969/j.issn.1004-5708.2014.01.017
TS414
A
1004-5708(2014)01-0090-06
由云南省煙草公司科技項目(2012YN06)、昆明學院大學生科學研究項目(XJDNX010)、國家自然科學基金項目(30860017)
陳澤斌(1985—),博士,講師。主要研究方向:煙草內生細菌多樣性,Email:zbchenkmu@163.com
2013-06-04

