冰鮮銀鯧魚優勢腐敗菌的分離鑒定及其致腐能力分析
張璟晶 唐勁松 管遠紅 王海波
(江蘇農牧科技職業學院食品科技學院,江蘇泰州 225300)
冰鮮銀鯧能夠最大程度地保持魚肉風味和營養價值,但冰鮮水產品也極其容易腐敗變質,其主要原因是由微生物引起的[1]。導致冰鮮水產品腐敗的往往是少數適合生存、繁殖并產生腐敗臭味代謝產物的特定優勢菌群,這些優勢腐敗菌的生長速度和致腐能力較強,隨著貯藏時間的增加,其在菌落總數中的比例不斷增加[2]。因此找出冰鮮水產品的優勢腐敗菌對于控制該種水產品的腐敗變質具有重要意義。目前國內外對于水產品中腐敗菌已有研究報道,例如:藍蔚青等[3]對冷藏帶魚的主要細菌菌相進行了分析;張雯[4]和許振偉[5]等分別對冰鮮大黃魚腸腔細菌類群結構類型和腐敗菌腐敗能力進行了分析。目前僅有針對鯧魚冷藏期間的微生物多樣性進行的一些研究[6],但對于鯧魚中的優勢腐敗菌的分離鑒定及其腐敗能力的分析并未見報道。
本研究擬對冰鮮銀鯧中的主要腐敗微生物進行分離純化,通過形態學特征、部分生理生化檢驗和16S rDNA分析鑒定相結合的技術,確定腐敗鯧魚中的優勢腐敗菌屬,并比較分析其致腐能力的大小,以便有針對性地對冰鮮銀鯧的優勢腐敗菌加以控制,為延長冰鮮銀鯧的保鮮期提供依據。
1 材料與方法
1.1 試驗材料
1.1.1 原料
銀鯧魚:購于泰州市農貿市場。
1.1.2 試劑
平板計數培養基:北京陸橋生物技術有限公司;
革蘭氏染液、芽孢染色液、微生物生理生化微量鑒定管:青島海博生物技術有限公司;
用于PCR擴增的全套試劑和擴增引物:北京三博遠志生物技術有限公司;
乙醇、無水碳酸鈉、氫氧化鈉等:分析純,上海國藥集團化學試劑有限公司。
1.1.3 試驗設備
電子天平:EL270型,梅特勒—托多利儀器(上海)有限公司;超凈工作臺:SW-CJ-ZFD型,蘇州凈化設備有限公司;電熱恒溫培養箱:HPX-9162MBE型,上海博訊實業有限公司;
立式壓力蒸汽滅菌鍋:LDZX-30FA型,上海博訊實業有限公司醫療設備;
PCR擴增儀:PTC-200型,北京三博遠志生物技術有限公司;
凝膠成像分析儀:YLN-2000A型,北京三博遠志生物技術有限公司。
1.2 試驗方法
1.2.1 冰鮮銀鯧魚腐敗菌的分離純化 在無菌操作環境下,稱取腐敗魚肉樣品10 g,放入滅過菌的研缽中,加入海砂,把魚肉研碎,加生理鹽水90 mL,然后取1 mL進行10倍梯度稀釋,選擇3個合適的稀釋度傾注平板計數培養基上,30℃培養48 h后進行菌落計數[7]。將分離出的典型菌落進行平板劃線分離,反復進行以獲得純化的單菌落。依據菌落特征以及革蘭氏染色、芽孢染色、細胞形狀與細胞間的排列方式等特征進行初步的分類并計數,確定在總數中占有比例較高的3~4種菌為優勢腐敗菌。
1.2.2 優勢腐敗菌致腐能力的確定 用無菌水將分離純化的優勢菌株分別制成菌懸液,菌體濃度為105CFU/mL。將冰鮮銀鯧流水沖洗后用酒精進行表面擦拭消毒后,分割成20 g左右的魚肉塊,后置于菌懸液中浸泡10 s后取出,4℃冰箱保存,在第1、3、5、7天進行菌落總數和揮發性鹽基氮(TVBN)測定,未接種腐敗菌的鯧魚肉作對照[5]。以產量因子(YTVB-N/CFU)作為各種腐敗菌致腐能力的定量指標。
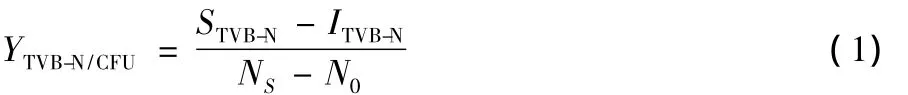
式中:
N0、NS——分別表示初始點和腐敗點的菌落總數,CFU/g;
ITVB-N、STVB-N——分別表示初始點和腐敗點的TVB-N含量,mg/100 g。
菌落總數和揮發性鹽基氮的測定分別依據按GB 4789.2—2010《食品微生物學檢驗 菌落總數測定》和 GB/T 5009—2008中《半微量定氮法》的方法進行測定。
1.2.3 優勢腐敗菌的鑒定
(1)常規生理生化試驗:參照《常見細菌系統鑒定手冊》[8],對分離得到的純菌株進行生理生化鑒定。
(2)優勢腐敗菌分子生物學鑒定:挑取培養18~24 h腐敗菌制成菌懸液,10 000 r/min離心10 min,棄上清,加入100 μL ddH2O,制得模板DNA。以通用引物27F:5’-AGA GTT TGA TCC TGG CTC AG-3’和 1541R:5’-AAG GAG GTG ATC CAC CC-3’進行擴增。
PCR擴增反應體系包括:模板 DNA 2 μL,引物27F 1 μL,引物 1541R 1 μL,Taq PCR Master Mix(2 × )25 μL,ddH2O 補至 50 μL。
PCR擴增程序:95℃預變性5 min,接著30個循環(95℃變性1 min,55 ℃退火1 min,72 ℃延伸 1 min,30 s),最終72℃延伸5 min。取5 μL PCR擴增產物進行瓊脂糖凝膠電泳,后將擴增產物送北京三博遠志生物技術有限公司測序,并登錄NCBI,與數據庫已知序列進行比對,獲得相似性較高的菌株序列,使用MEGA 5.0軟件,構建系統發育樹。
2 結果與分析
2.1 冰鮮銀鯧魚腐敗菌的分離純化
根據在平板上分離得到菌落的形態特征(圖1),結合革蘭氏染色及芽孢的有無對菌落進行分組,大致分為8組,分別計數,并計算其占全部菌落的比例,將比例超過5%的菌落定為優勢腐敗菌。通過表1可以確定在總數中占有比例較高的4種菌為優勢腐敗菌,按其比例由大到小順序依次列為1號、2號、3號、4號菌。對篩選得到4個優勢腐敗菌株進一步的腐敗特性研究。
2.2 優勢腐敗菌致腐能力的初步分析
2.2.1 優勢腐敗菌接種滅菌魚肉后菌落總數和TVB-N的變化 將篩選出的4種腐敗菌進行反接致腐試驗。將無菌魚肉分別浸于105CFU/mL的菌懸液中10 s后取出放于無菌塑料袋中,4℃冰箱保存,以未接種的魚肉樣品為對照。在第1、3、5、7天對魚肉進行菌落總數和TVB-N測定。結果見圖2、3。
銀鯧魚死后的腐敗變質主要是由于魚體受到細菌的污染,細菌生長繁殖所導致,因此通過菌落總數的測定可以初步判斷銀鯧魚的新鮮度和腐敗程度。而揮發性鹽基氮(TVBN)是指動物性食品在細菌和酶的作用下,在腐敗過程中蛋白質分解而產生氨以及胺類等具有揮發性的堿性含氮物質。此類物質含量越高,表明氨基酸被破壞的越多,所以TVB-N是評價魚類肉質新鮮度的重要指標[9]。
圖1 菌落平板計數示意圖Figure 1 The flat schemes of total bacterial count
由圖2可知:在貯藏過程中,隨著時間的延長,各接種腐敗菌的處理組和對照樣品組的菌落總數均呈增加趨勢,各處理組菌數增加幅度較大,在第5天時,分別接種1號、2號、3號菌和4號菌的處理組菌落總數均超過7.0[lg(CFU/g)],說明接種的各優勢腐敗菌,在低溫下仍能利用魚肉中的營養物質迅速生長繁殖,菌數明顯增加。但在后期隨著魚肉中營養物質的消耗和代謝產物的積累,菌落總數的增加趨于平緩。圖3表明,TVB-N值初期增長緩慢,但在第3天以后迅速增加,在第5天時接種1號菌的樣品的TVB-N達到34.3 mg/100 g,說明魚肉已經腐敗。由圖2、3可知,隨著菌數的增加,優勢腐敗菌生長而伴隨TVB-N值的增加,說明優勢腐敗菌的生長繁殖是使魚肉中TVB-N增加的重要原因。
2.2.2 優勢腐敗菌腐敗能力定量分析 參照許振偉[5],黃林[10]等方法,將腐敗點時TVB-N的增加量與腐敗菌落總數增加量的比值作為TVB-N的產量因子(YTVB-N),定量分析各優勢腐敗菌腐敗能力。結果見表2。
由表2可知,接種了1號腐敗菌的魚肉的YTVB-N明顯高于其他菌株,而4號菌的致腐能力相對較弱;4株優勢腐敗菌致腐能力:1號>3號>2號>4號。
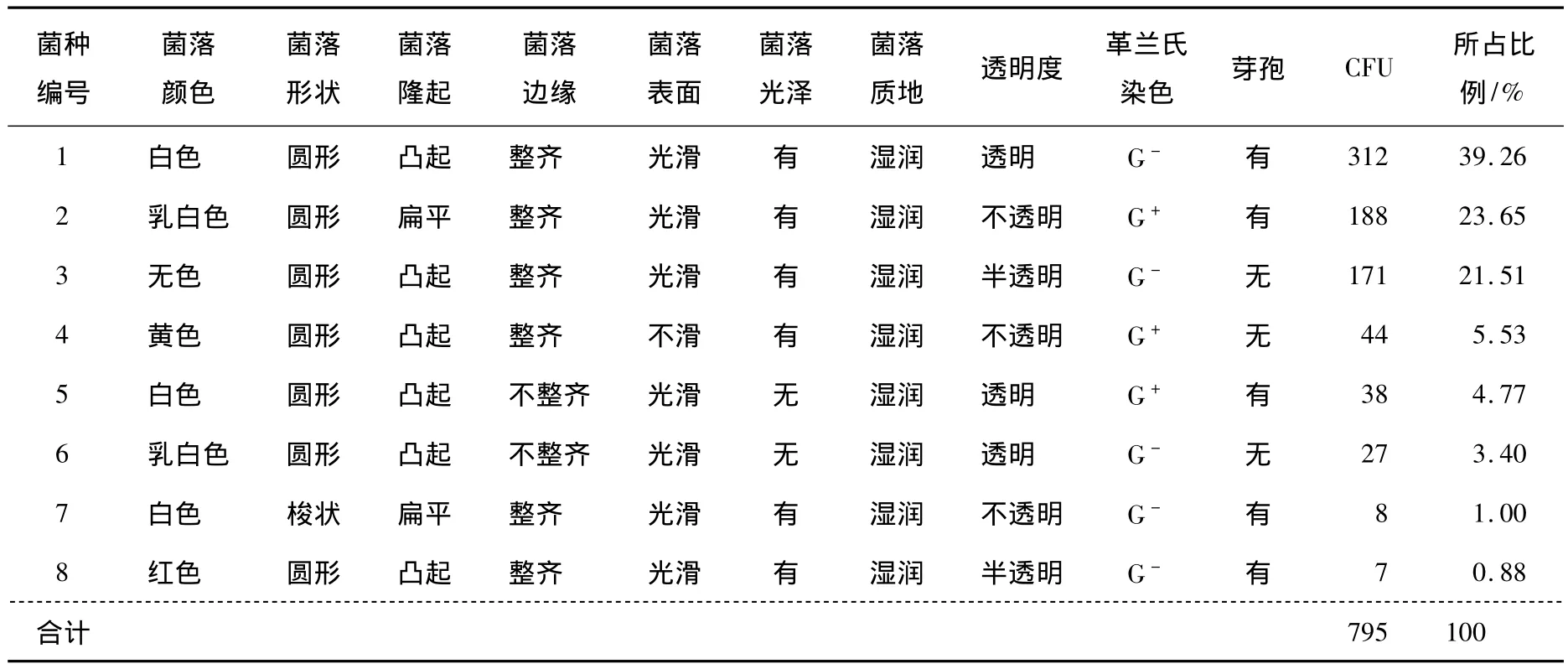
表1 各種腐敗菌菌落特征及比例Table 1 Colonial characteristics and proportion of spoilage bacteria
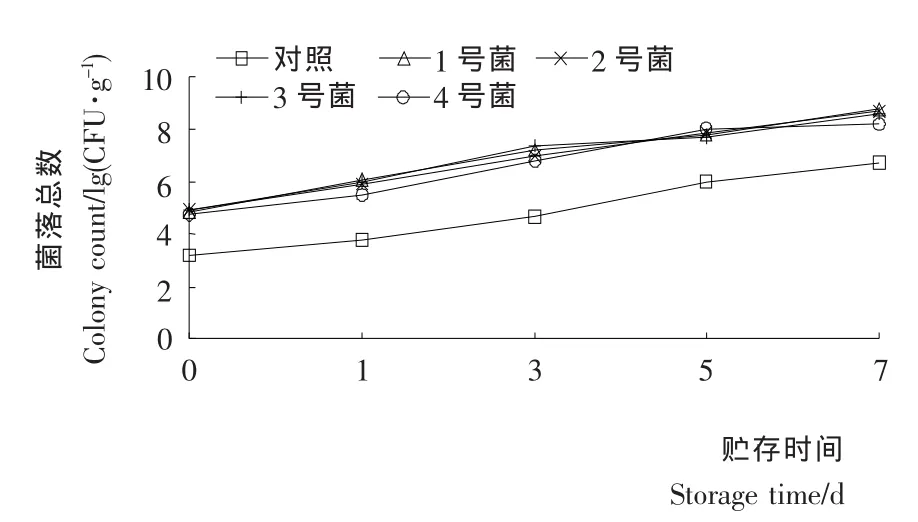
圖2 各種優勢腐敗菌菌落數變化Figure 2 Growth curve of dominant spoilage bacteria
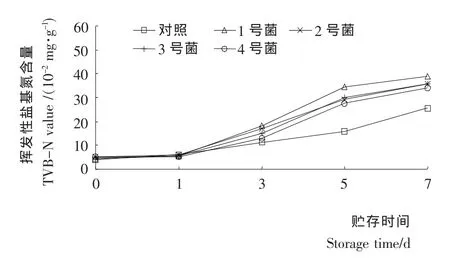
圖3 接種各種優勢腐敗菌對TVB-N的影響Figure 3 Effect of dominant spoilage bacteria on TVB-N value

表2 各種優勢腐敗菌的TVB-N產量因子Table 2 Yield factors of TVB-N of dominant spoilage bacteria
2.3 優勢腐敗菌的鑒定
2.3.1 形態和生理生化特征 通過篩選得到的4個優勢腐敗菌,進行形態特征和部分生理生化特征比較,結果見表3。
2.3.2 優勢腐敗菌16S rRNA的PCR擴增與系統發育樹的構建 由圖4可知,篩選得到的4個優勢腐敗菌經PCR擴增后經電泳檢測,均得到了1 500 bp左右的條帶。將PCR擴增產物送至北京三博遠志生物技術有限公司進行測序,得到16S rDNA序列后與NCBI數據庫已有的序列通過BLAST比對,選取同源性較高的菌株序列構建系統發育樹,見圖5。

表3 各種優勢腐敗菌的形態特征和部分生理生化特征Table 3 Morphological and physiological characteristics of dominant spoilage bacteria
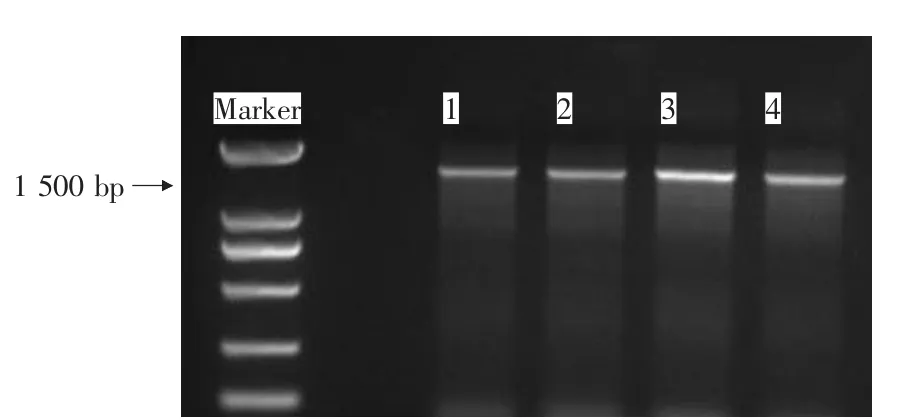
圖4 4個菌株的16S rDNA PCR擴增產物電泳圖譜Figure 4 Electropherogram of PCR amplification products of 16S rDNA genes from four strains

圖5 16S rDNA序列同源性的4株細菌系統發育樹Figure 5 Phylogenetic treeof the four strains based on 16S rDNA sequences
結合表3、圖4和5可以看出:1號菌與Pseudomonas fluorescens的親緣關系最近,2號菌與Lysinibacillus sphaericus的親緣關系最近,3號菌與Shewanella sp的親緣關系最近,4號菌與Microbacterium oxydans的親緣關系最近。有研究[11]表明Pseudomonas fluorescens和Shewanella sp廣泛分布于自然界,水產品攜帶較多,并且在低溫下也能生長,是冷鏈流通中高水分蛋白食品的主要腐敗菌,在有氧冷藏中,這兩種菌也是很多魚貝類和甲殼類的特定腐敗菌(SSO)。而Lysinibacillus sphaericus和Microbacterium oxydans也是水產養殖中主要的細菌,占有絕大多數比例。在本研究中,鯧魚優勢腐敗菌的致腐能力較強的為Pseudomonas fluorescens。
3 結論
本研究通過對鯧魚中腐敗菌進行分離純化,結合菌落形態、細胞形態、生理生化特征和16S rDNA分子鑒定方法,對生長速度較快,在菌群中占有比例較高且致腐能力較強的優勢腐敗菌群進行了鑒定,4種優勢腐敗菌分別鑒定為Pseudomonas fluorescens,Lysinibacillus sphaericus,Shewanella sp和Microbacterium oxydans。同時通過致腐能力的測定,證實了在冰鮮鯧魚的腐敗變質中,Pseudomonas fluorescens的致腐能力是最強的。下一步將對冰鮮銀鯧中主要的腐敗菌群進行有針對性的靶向抑制,以期為延長冰鮮銀鯧的貨架期提供參考。
當然,傳統的微生物分離鑒定方法很難真實反映微生物污染鯧魚的多樣性以及種群變化現象,下一步也將引用PCR—DGGE指紋圖譜技術等,以期望更真實地反映冰鮮銀鯧在貯藏期間的微生物菌群演替情況,對主要腐敗菌之間的相互作用以及腐敗能力進行更深入的研究,為低溫保藏銀鯧奠定理論基礎。
1 黎柳,謝晶.水產品冰鮮技術的研究進展[J].食品與機械,2014,30(1):259~266.
2 Lund B M,Baird-Parker T C,Gould G W.The microbological safety and quality of food[M].Gaithersburg Maryland,USA:Aspen Publishers Inc,2000.
3 藍蔚青,謝晶.PCR結合生理生化鑒定對冷藏帶魚主要細菌菌相組成分析[J].食品與發酵工業,2012,38(2):11 ~13.
4 張雯,倪莉,黃志清,等.冰鮮大黃魚腸腔細菌類群鑒定及菌群結構分析[J].中國食品學報,2013,12(12):189 ~192.
5 許振偉,許鐘,楊憲時,等.大黃魚中復合腐敗菌腐敗能力的分析[J].食品科學,2010,31(23):118 ~122.
6 藍蔚青,謝晶,施建兵,等.冷藏鯧魚貯藏期間的細菌種群變化[J].食品與生物技術學報,2013,32(11):141 ~147.
7 唐勁松,徐安書.食品微生物檢測技術[M].北京:中國輕工業出版社,2012.
8 東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
9 楊憲時,許鐘,肖琳琳.水產食品特定腐敗菌與貨架期的預測和延長[J].水產學報,2004,28(1):106~111.
10 黃林,陳全勝,張燕華,等.冷卻豬肉優勢腐敗菌分離鑒定及致腐能力測定[J].食品科學,2013,34(1):205 ~208.
11 Ellis D I,Goodacre R.Rapid and quantitative detection of the microbial spoilage of muscle foods:current status and future trends[J].Trends in Food Science and Technology,2001,12(1):414 ~424.

