苜蓿根瘤菌對不同形態磷利用效率的研究
劉盧生,玉永雄*,郭蕾,胡艷,周磊,王榮
(1.西南大學動物科技學院,重慶市高校草食動物工程中心,重慶400715;2.農民日報社,北京100089)
紫花苜蓿(Medicagosativa)作為一種優質牧草,在世界草食畜牧業中起著不可替代的作用,我國畜牧業對苜蓿的需求量也逐年攀升,但我國的供應遠不能滿足需求,因此近年來,我國苜蓿的種植面積不斷擴大,甚至在南方的四川、云南、貴州、江蘇等地也開始種植[1]。紫花苜蓿是豆科植物,苜蓿-根瘤菌這一共生固氮體系的穩定高效是栽培苜蓿獲得高產的關鍵因素,而在實際生產中有效磷的缺乏常常是限制苜蓿-根瘤菌體系高效運轉的重要原因。在我國,不管是北方還是南方,種植苜蓿的地塊多數為較貧瘠、土層薄的邊緣地帶,這些地區在北方通常為鹽堿地,在南方則多數為酸性土,這些土壤中的磷多數為難溶性的磷酸鈣、磷酸鋁和磷酸鐵[2],可溶性的有效磷含量很少,因此,土壤有效磷缺乏是限制苜蓿在這類土壤中產量提高的主要因素。
已有的研究表明,在有效磷缺乏的土壤上,豆科植物接種根瘤菌可以促進植株對磷的吸收利用,增加植株磷含量[3-7]。近年來,研究已發現部分豆科根瘤菌存在多種解磷機制[4,8-9],正是這些解磷機制使根瘤菌-豆科植物能利用難溶性磷,保證了這些豆科植物在低有效磷土壤上的正常生長。
雖然苜蓿是一種重要的豆科植物,但苜蓿根瘤菌對難溶性磷利用的研究較少,僅有的少數研究也是針對堿性土壤中普遍存在的鈣-磷進行[10-11],而酸性土壤中主要的難溶性磷為鋁-磷和鐵-磷,目前尚未見苜蓿根瘤菌對它們利用性的報道。因此,本研究利用多種土壤中常見的難溶性磷替代普通培養基中的磷,研究耐酸的根瘤菌對不同難溶性磷的利用和根瘤菌生長對磷可利用性的影響,為根瘤菌的選育、改造和生產實際提供依據。
1 材料與方法
1.1 供試菌種
供試菌種是菌株S01和S02,為西南大學重慶市牧草與草食家畜重點實驗室篩選出的耐酸苜蓿根瘤菌,2個菌株都能在紫花苜蓿植株上正常結瘤。
1.2 培養基
預培養的培養基:采用酵母瓊脂培養基(yeast morphology agar medium,YMA培養基):甘露醇10g/L、酵母膏1.5g/L、K2HPO4·3H2O 681mg/L、MgSO4·7H2O 0.2g/L、NaCl 0.1g/L,Rh微量2mL(Rh微量:H3BO35g/L,Na2MoO45g/L),固體培養基加8g/L的瓊脂。
試驗處理的培養基:
1)無磷培養基:作為無磷對照(CK),為無磷低酵母含量的YMA培養基,因酵母膏含大量有機氮、磷、多種未知營養和生長因子,為降低有機磷和未知營養因子對實驗的影響,將酵母膏添加量減少到0.1g/L(根瘤菌生長必需酵母膏提供生長因子,否則難以正常生長),同時為補充根瘤菌生長必需的氮源,添加(NH4)2SO40.2g/L;為補充 K,添加 KCl 0.2g/L。
2)酵母膏有機磷培養基:作為對照CKYE-P,為添加正常含量酵母膏的YMA培養基,即:對照培養基[不添加(NH4)2SO4]+酵母膏1.5g/L。
3)可溶性無機磷培養基:作為對照CKP,為添加正常含量K2HPO4的培養基,即對照培養基(不加KCl)+K2HPO4·3H2O 0.681g/L。
4)植酸鈣鎂培養基(TPhy-P):對照培養基+植酸鈣鎂3g/L。
5)磷酸鈣培養基(TCa-P):對照培養基+Ca3(PO4)23g/L。
6)磷酸鋁培養基(TAl-P):對照培養基+AlPO43g/L。
7)磷酸鐵培養基(TFe-P):對照培養基+FePO4·4H2O 3g/L。
固體培養基添加15g/L的瓊脂粉和25mg/L的剛果紅。
1.3 試驗方法
試驗在2014年3-5月進行,分固體培養和液體培養兩類處理。
1.3.1 固體平板培養基上不同磷源對苜蓿根瘤菌菌落生長的影響 試驗設計:采用三因素完全隨機試驗設計,試驗包括3個pH 條件(pH 4.1,7.0和9.0)、7個不同磷源(CK、CKYE-P、CKP、TPhy-P、TCa-P、TAl-P和 TFe-P),2個耐酸苜蓿根瘤菌菌株(S01和S02),共3×7×2=42個處理,每個處理2個重復(平板),每個平板接種6個點。
固體培養基的配制:Ca3(PO4)2、AlPO4、FePO4·4H2O和植酸鈣鎂121℃各自單獨滅菌17min,隨后與滅菌后的其他成分混合,用1mol/L的鹽酸或者NaOH調節至所需的pH,隨后培養基放置24h后再次用鹽酸或NaOH調節至所需pH,再與滅菌后的瓊脂剛果紅混合,持續攪拌搖勻,使固體沉淀平均分布于培養基中,待溫度降低到40℃時倒入直徑9cm培養皿中。因CK、CKYE-P和CKp3個對照培養基的pH變化較小,故直接將所有成分混合滅菌倒培養皿。
根瘤菌的接種和培養:2014年3月,將2個保存菌株經正常培養30h后的培養液12000r/min離心2min,棄上清(棄去有磷培養液),將菌體用無菌蒸餾水稀釋,調整吸光度至0.2,吸取6μL接種一個點,每個平板接種6個點,每個處理接種兩個平板,隨后置于28℃靜置培養96h后記錄菌落形態并利用直尺測定菌落直徑。
1.3.2 液體培養條件下不同磷源對苜蓿根瘤菌生長、培養液pH和有效磷含量的影響 試驗設計:采用三因素完全隨機試驗設計,試驗包括3個pH 條件(pH 4.1,7.0和9.0)、7個不同磷源(CK、CKYE-P、CKP、TPhy-P、TCa-P、TAl-P和 TFe-P),2個耐酸根瘤菌菌株(S01和S02)和未接種對照,共3×7×3=63個處理,每個處理2個重復。
液體培養基的配制:Ca3(PO4)2、AlPO4、FePO4·4H2O和植酸鈣鎂121℃各自單獨滅菌17min,隨后與滅菌后的其他成分混合,用1mol/L的鹽酸或者NaOH調節至所需的pH,隨后培養基放置24h后再次用鹽酸或NaOH調節至所需pH。因CK、CKYE和CKp培養基的pH變化較小,故直接將所有成分混合滅菌倒培養皿。
根瘤菌的接種和培養:菌液的預培養和稀釋同1.3.1,吸取蒸餾水稀釋后的菌液20μL接入各三角瓶,28℃120r/min培養72h后測定菌液吸光度、培養液pH和有效磷含量(未接種對照一起培養,一起測定)。吸光度使用的是HITACHI U-1800分光光度計在600nm處進行測定,比色皿為1.0cm×0.5cm的玻璃比色皿,為減小不溶沉淀對吸光度測定的影響,所有處理的吸光度測定都以相應未接種對照作為空白進行調0;培養后培養液的pH使用雷磁PHS-3CpH計進行測定;液體培養結束后,吸取2mL培養液12000r/min 4℃離心20min,然后吸取上清液測定溶液中的有效磷,磷測定采用鉬銻抗比色法[8]。
1.4 數據處理
采用SPSS進行試驗數據的方差分析和多重比較。
2 結果與分析
2.1 固體平板上不同磷源對苜蓿根瘤菌菌落生長的影響
酸性、中性和堿性條件下,苜蓿根瘤菌菌株S01和S02在不同磷培養基平板上生長96h后的菌落直徑見表1。比較3個對照的菌落直徑發現,無磷CK的菌落直徑最小,顯著低于酵母膏對照CKYE-P和無機可溶性磷對照CKP,且其菌落中根瘤菌生長量很小,顯著小于CKYE-P和CKP菌落,說明磷是影響根瘤菌生長和菌落直徑的關鍵因素,缺磷使根瘤菌生長受到顯著的抑制。
4個不同磷源處理中,植酸鈣鎂處理(TPhy-P)菌落直徑最大,磷酸鈣處理(TCa-P)次之,而磷酸鋁處理(TAl-P)和磷酸鐵處理(TFe-P)在各條件下的菌落直徑都較小,說明在固體培養條件下植酸鈣鎂和磷酸鈣是根瘤菌生長的較有效的磷源,而磷酸鋁和磷酸鐵則較難被根瘤菌利用。
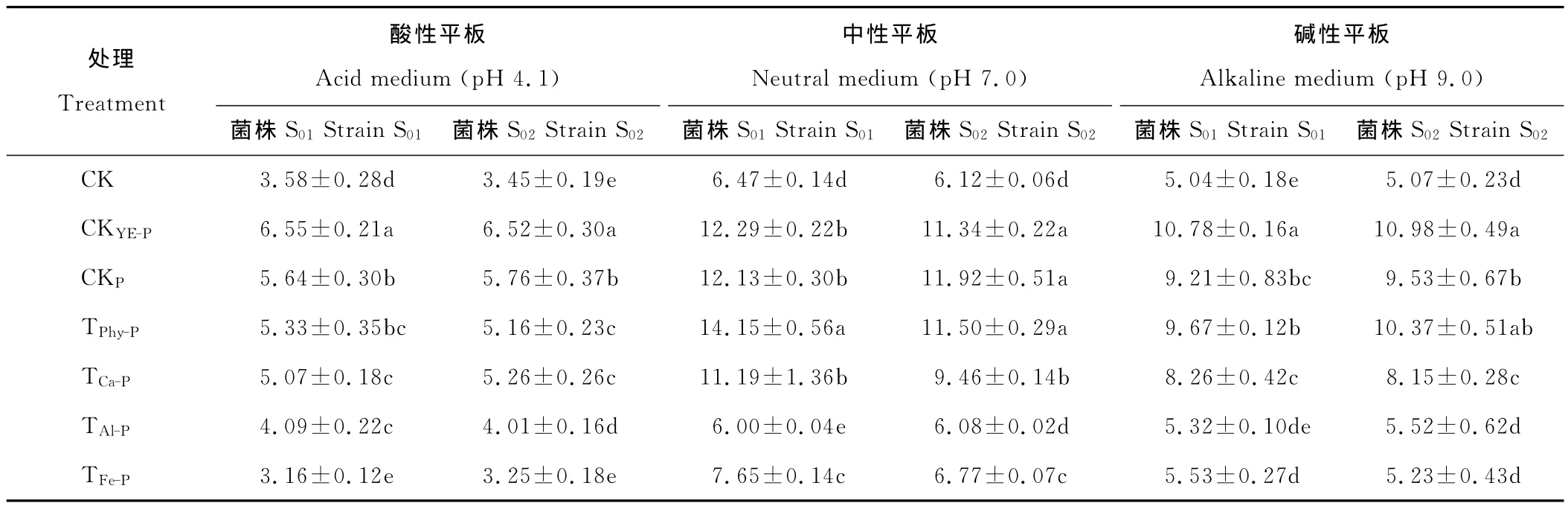
表1 不同磷源固體平板上的根瘤菌菌落直徑Table 1 The rhizobia’s colony diameter in solid medium with different form phosphorus mm
2.2 液體培養基中不同磷源對苜蓿根瘤菌生長、培養液pH和有效磷含量的影響
2.2.1 不同pH條件下不同磷源對苜蓿根瘤菌生長的影響 在中性和堿性條件下,添加到液體培養基中的不溶性磷以沉淀形態存在,在調節pH前后、滅菌前后無明顯變化,培養后仍見明顯沉淀。但在酸性條件下(pH 4.1),添加植酸鈣鎂的培養基在調節pH過程中,植酸鈣鎂溶解,高壓滅菌和接種培養后也一直保持澄清。其原因在于植酸鈣鎂在酸性條件下轉變為可溶性的植酸[9],故沉淀消失。
苜蓿根瘤菌在添加不同形態磷的酸性、中性和堿性培養液中培養72h后的吸光度見表2。在3種pH條件下,無磷對照CK的吸光度皆很小,而添加正常量酵母膏的對照CKYE-P和可溶性無機磷對照CKP的吸光度皆顯著高于無磷對照CK,說明有效磷(不管是有機磷還是無機磷)是影響根瘤菌生長的關鍵因素。
比較不同難溶性磷處理中苜蓿根瘤菌吸光度發現,不管是在酸性、中性還是堿性條件下,TPhy-P和TCa-P的根瘤菌吸光度皆高于相同pH 條件的 TAl-P和 TFe-P,如中性條件下,TPhy-P和 TCa-P的吸光度在1.2以上,而 TAl-P和 TFe-P的吸光度皆小于1;堿性條件下,TPhy-P和TCa-P的吸光度在0.6以上,而TAl-P和TFe-P的吸光度不到0.1,這說明植酸鈣鎂和磷酸鈣是有效的根瘤菌生長所需磷源,而磷酸鋁和磷酸鐵則較難被利用。
較為特殊的是酸性條件下的植酸鈣鎂處理(TPhy-P),因植酸鈣鎂在酸性條件下轉變為植酸而完全溶解,但其根瘤菌吸光度卻很低,其原因在于植酸鈣鎂生成的植酸是防腐劑,能抑制多種細菌生長,故根瘤菌的生長也受到抑制。
2.2.2 不同磷源培養基中根瘤菌生長對培養液pH的影響 各處理培養72h后培養液的pH測定結果(表3)顯示,除酸性條件下的TCa-P外,所有對照和處理的培養液pH都呈下降趨勢,說明根瘤菌生長中分泌酸性物質。
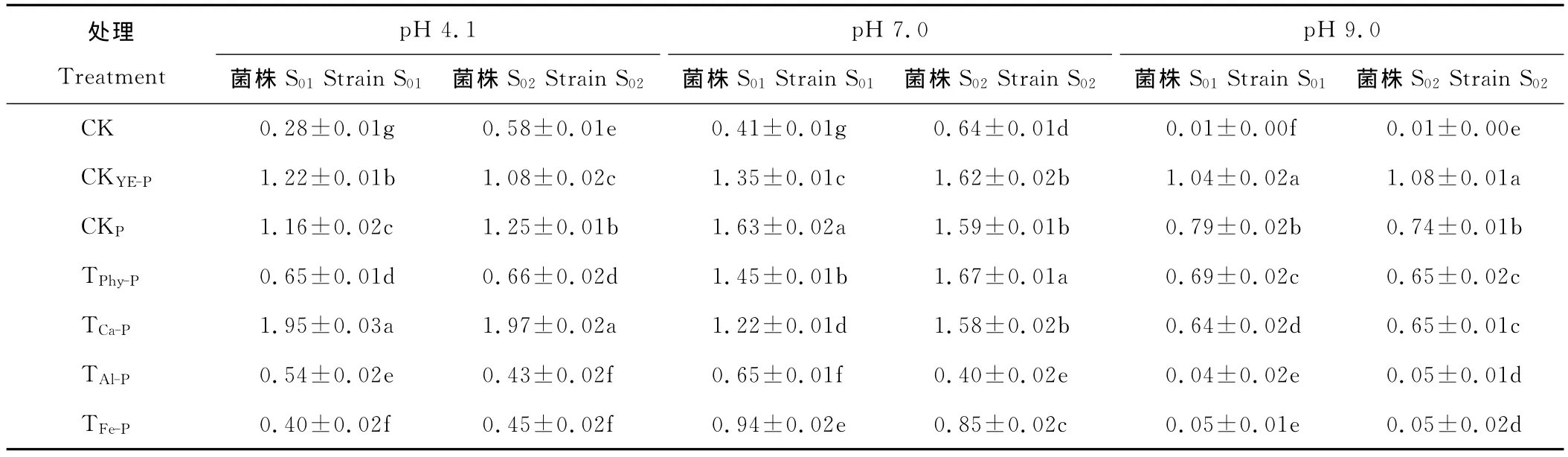
表2 根瘤菌在不同形態磷的培養液中培養72h后的吸光度Table 2 The rhizobia’s absorbance in medium with different form phosphorus after 72hculture
酸性處理組中,3個對照、TPhy-P、TAl-P和 TFe-P的pH 降低程度較大(都在pH 3.5以下),而 TCa-P卻略有上升,原因在于磷酸鈣在酸性條件下能部分溶解,中和了培養基中的H+,由此導致pH未下降。
中性處理組中,除 TPhy-P和 TCa-P外,其他對照和處理的pH 大幅度降低(最終pH<3.7),而 TPhy-P和 TCa-P的pH降低程度較小,原因同樣是因為植酸鈣鎂和磷酸鈣在酸性條件下可部分溶解,能中和培養液中的H+,即植酸鈣鎂和磷酸鈣具有緩沖性,故2個處理pH下降幅度不大。
堿性處理組中,CK的pH 最高(分別為8.85和8.87),其次為 TAl-P(pH 分別為7.29和7.28),這與二者根瘤菌生長較弱(吸光度見表2),H+分泌少,所以培養液pH降低程度小。

表3 根瘤菌在不同形態磷培養基中培養72h后的pHTable 3 The medium pH after 72hculturing in medium with different form phosphorus
2.2.3 不同pH培養條件下苜蓿根瘤菌對難溶性磷轉化的影響 各處理培養72h后培養液中有效磷的含量見表4。比較不同處理的有效磷含量發現,酸性和中性條件下TPhy-P和TCa-P的有效磷含量(接種與未接種處理皆在100mg/L以上)遠高于 TAl-P和 TFe-P(接種與未接種處理皆在21mg/L以下),堿性條件下僅 TPhy-P有效磷含量較高(未接種處理為54.53mg/L,接種處理為129.95和122.25mg/L),其余處理未接種對照仍較低,接種處理雖有上升但皆在50mg/L以下。說明對根瘤菌而言,磷酸鈣在各pH條件下皆為有效的磷源,植酸鈣鎂在中性和酸性條件下是較有效的磷源,而磷酸鋁和磷酸鐵在任何pH條件下都很難成為根瘤菌的有效磷源。
與未接種對照相比,TAl-P和TFe-P接種根瘤菌后的有效磷在各pH條件下都有明顯的上升,特別是在堿性條件下的上升幅度最大,如 TAl-P的有效磷含量從未接種的3.18mg/L上升到49.98和45.38mg/L,分別增加了14.70和13.27倍。對TPhy-P和TCa-P而言,接種根瘤菌僅使中性和堿性處理的有效磷含量上升,特別是堿性條件下 的上升幅度最大(如與未接種對照比,堿性條件下TPhy-P的有效磷含量從2.27mg/L分別增加到40.44和35.22mg/L),說明根瘤菌的生長可以促進難溶性磷的釋放,但在酸性條件下對植酸鈣鎂和磷酸鈣中磷的釋放作用較弱。
比較不同pH條件下的有效磷含量發現,隨pH的升高,TPhy-P和 TCa-P的有效磷含量呈明顯的降低趨勢,如酸性條件下未接種 TPhy-P和 TCa-P對照的有效磷分別為612.01和310.06mg/L,中性條件下分別降低到195.12和119.14mg/L,堿性條件下則降低到2.27和54.53mg/L,而 TAl-P和 TFe-P的有效磷含量在不同pH條件下變化不明顯(表4的未接種對照)。說明環境pH對植酸鈣鎂和磷酸鈣中磷的有效性有較大影響,而對磷酸鋁和磷酸鐵則影響較小。

表4 根瘤菌培養后培養基有效磷含量Table 4 The available phosphate content at the end of culturing mg/L
3 討論
3.1 pH與磷有效性的關系
土壤中的磷包括無機磷和有機磷。無機磷主要包括Ca-P、Al-P和 Fe-P,其中 Ca-P主要存在于中性和堿性土壤中,酸性土壤中含量很少;Al-P和Fe-P占酸性土壤中無機磷的絕大多數[12],在中性和堿性土壤中也有分布。土壤中的有機磷主要來源于植物殘體,其中超過50%以上為植酸及其鹽類[13]。各種磷在土壤中的溶解性與pH密切相關,酸性和中性條件下僅Ca-P和植酸鹽類可部分溶解,堿性條件下各種磷皆難溶于水[5]。本研究測定的各處理有效磷含量也印證了這一點。酸性和中性條件下,TCa-P和TPhy-P中有效磷含量遠高于堿性條件,而TFe-P和TAl-P在各pH條件下的有效磷含量皆較低(表4和表5)。因此在酸性土壤中,無機有效磷含量很低(Ca-P少,Al-P和Fe-P難溶),堿性土壤中同樣容易缺乏有效磷(磷酸鈣含量不到酸性條件的1/10,考慮到本研究的磷酸鈣經過高溫高壓滅菌,堿性土壤中實際的有效磷含量應遠低于試驗值,此外植酸鹽、Al-P和Fe-P溶解度都很低),因此對于酸性土壤和堿性土壤而言,苜蓿和苜蓿根瘤菌都容易缺磷,苜蓿在這類土壤上的栽培必須特別注意磷肥的施入。
3.2 根瘤菌生長與磷有效性的關系
本研究發現根瘤菌能提高各種難溶性磷的有效性,以供自身生長利用,如在初始pH 7.0和pH 9.0的接種處理中有效磷含量較未接種處理都有不同程度的升高,最高的超過未接種對照的10倍(pH 9.0條件下的TAl-P)。這種升高一方面是泌酸的細菌,它的生長會導致環境pH的降低(表3),而環境pH降低將增加Ca-P和有機磷的有效性,但pH降低對磷酸鋁和磷酸鐵中磷的釋放作用并不明顯(表4),這與前人的研究結果一致[2,14-15],即磷酸鈣和有機磷的有效性對pH較為敏感,而磷酸鋁和磷酸鐵則不敏感。
根瘤菌泌酸(H+)導致有效磷的上升并不能完全解釋一些處理中的有效磷在接種根瘤菌后大幅度增加的現象。如pH 9.0條件下的接種根瘤菌處理TAl-P,其培養后培養液有效磷含量達49.48mg/L(表4),而其培養后培養液pH 為7.29,與pH 7.0條件下的未接種處理TAl-P的pH(6.81)相差不大,若接種處理中僅存在酸(H+)的溶磷作用,那么二者的有效磷含量應差異不大,但實際上前者含量卻是后者的10倍以上。這說明根瘤菌培養中存在另外一些導致有效磷含量增加的機理,如這種機理可能是有機酸的分泌[4,8-9],磷饑餓條件下與溶磷相關的酶分泌和相關基因的表達,進而促進磷的溶解和吸收[13-14],而中性和酸性條件培養時因根瘤菌的泌酸作用導致培養液pH下降過低(各處理最終pH皆<4.0),由此導致溶磷相關基因的表達受阻,故接種根瘤菌后有效磷含量未見明顯上升,但這還需進一步試驗的驗證。
3.3 有機質與根瘤菌在土壤中的生存和生長
有機磷(如YMA培養基中的酵母膏)是根瘤菌生長的最有效的磷源之一,土壤中含量最多的有機磷是植酸鹽類。本研究發現雖然植酸鹽與磷酸鈣、磷酸鋁和磷酸鐵等無機磷一樣在水中的溶解度很低,但在中性條件下,它可以作為根瘤菌的有效磷源,其培養后的根瘤菌吸光度與正常培養基中基本一樣,其原因可能在于一方面根瘤菌生長中泌酸降低了環境pH,增加了植酸鈣鎂的溶解度,另一方面,苜蓿根瘤菌可能與其他根瘤菌一樣在低磷條件下能分泌植酸酶[5,16],將植酸鈣鎂分解以供自身生長所需。實驗發現初始pH 4.1的酸性條件下,植酸鈣鎂則因轉變為植酸,而植酸是防腐劑,能抑制多種細菌的生長[17-20],故雖然有效磷含量很高,根瘤菌生長卻很差。不過,田間生產的條件不同于本試驗的室內培養條件,土壤中含有多種能分解植酸的微生物,植酸被這些微生物分解后抑菌作用消失,同時釋放出磷[21],因此酸性條件下土壤中的植酸磷也應該是根瘤菌生長的良好磷源。
雖然在本研究中,堿性條件下含有機磷處理(酵母膏CKYE和植酸鈣鎂TPhy-P)的有效磷很低,根瘤菌生長較差,但這是在單一接種根瘤菌條件下獲得的。實際生產中,若向鹽堿土壤中添加有機質后,會促進多種微生物,如纖維菌、放線菌、各種真菌和多種其他細菌的生長,在它們的共同作用下,土壤會累積有機酸,pH降低,有效磷含量增加[22-24],因此在富含有機質的土壤中根瘤菌的存活和生長所需磷源應該是足夠的。
綜上所述,不管在哪種土壤中,要促進低磷土壤中根瘤菌的生長,提高存活率和結瘤,一個間接有效的方法是采取措施提高土壤的有機質含量。
[1]Zhang Y J,Shen Y X.The Development Potential and Direction of Alfalfa in Southern Farming Areas[C].Beijing:The Third China National Alfalfa Industry Development Conference,2010.
[2]Lu R K.General status of nutrients(N,P,K)in soils of China.Acta Pedologica Sinica,1989,26(3):280-286.
[3]Neila A,Adnane B,Mustapha F,etal.Phaseolusvulgaris-Rhizobia symbiosis increases the phosphorus uptake and symbiotic N-2fixation under insoluble phosphorus.Journal of Plant Nutrition,2014,37(5):643-657.
[4]Tajini F,Trabelsi M,Drevon J J,etal.Combined inoculation withGlomusintraradicesandRhizobiumtropiciCIAT899increases phosphorus use efficiency for symbiotic nitrogen fixation in common bean(PhaseolusvulgarisL.).Saudi Journal of Biological Sciences,2012,19(2):157-163.
[5]Mandri B,Drevon J J,Bargaz A,etal.Interactions between common bean genotypes and rhizobia strains isolated from Moroccan soils for growth,phosphatase and phytase activities under phosphorus deficiency conditions.Journal of Plant Nutrition,2012,35(10):1477-1490.
[6]Jia Y,Gray V M,Straker C J.The influence ofRhizobiumand arbuscular mycorrhizal fungi on nitrogen and phosphorus accumulation byViciafaba.Annals of Botany,2004,94(2):251-258.
[7]Lzaguirre-Mayoral M L,Carballo O,Egea R,etal.Responses ofRhizobium-inoculated and nitrogen-supplied cowpea plants to increasing phosphorus concentrations in solution culture.Journal of Plant Nutrition,2002,25(11):2373-2387.
[8]Atemkeng M F,Remans R,Michiels J,etal.Inoculation withRhizobiumetlienhances organic acid exudation in common bean(PhaseolusvulgarisL.)subjected to phosphorus deficiency.African Journal of Agricultural Research,2011,6(10):2235-2242.
[9]Zhang X T,Kang L H,Ma H B,etal.Selection of AcaciaRhizobiumwhich have the ability to dissolve phosphorus.Forest Research,2008,21(5):619-624.
[10]Carmen B,Roberto D.Improvement of phosphate solubilization andMedicagoplant yield by an indole-3-acetic acid-overproducing strain ofSinorhizobiummelitoti.Applied and Environmental Microbiology,2010,76(14):4626-4632.
[11]Li J F,Zhang S Q,Shi S L,etal.Screening of dissolve phosphorusRhizobiummelilotiantibiotic-resistant strain using microwave mutagenesis.Atomic Energy Science and Technology,2009,43(12):1071-1076.
[12]Jang B P,Lu R K,Yan Y C,etal.The content of iron phosphates in the paddy soils of southern China and their significance to the phosphorus nutrition of rice plant.Acta Pedologica Sinica,1963,11(4):361-368.
[13]Yan Y P,Wan B,Liu F,etal.Distribution,species and interfacial reactions of phytic acid in environment.Chinese Journal of Applied and Environmental Biology,2012,18(3):494-501.
[14]Liu L S,Yu Y X,Hu Y,etal.Effect of acid environment and aluminium on the growth ofRhizobiummeliloti.Journal of Anhui Agricultural Science,2012,40(36):17615-17618.
[15]Liu W G,He Y Q,Zhang K,etal.Isolation,identification and characterization of a strain of phosphate-solubilizing bacteria from red soil.Acta Microbiologica Sinica,2012,52(3):326-333.
[16]Lazali M,Zaman-Allah M,Amenc L,etal.A phytase gene is overexpressed in root nodules cortex ofPhaseolusvulgarisrhizobia symbiosis under phosphorus deficiency.Planta,2013,238(2):317-324.
[17]Xie Y Q,Fang B S.Study on the antimicrobial preservation effect of phytic acid.Fujian Chemical Industry,2002,(4):39-41.
[18]Hou W F,Xie J,Lan W Q,etal.Antimicrobial mechanisms of phytic acid againstEscherichiacoli.Jiangsu Journal of Agricultural Science,2012,28(2):443-447.
[19]Xie J,Hou W F,Tang Y,etal.Antimicrobial mechanisms of phytic acid againstShewanellaputrefacens.Science and Technology of Food Industry,2011,32(10):85-88.
[20]Bari M L,Ukuku D O,Kawasaki T,etal.Combined efficacy of nisin and pediocin with sodium lactate,citric acid,phytic acid,and potassium sorbate and EDTA in reducing theListeriamonocytogenespopulation of inoculated fresh-cut produce.Journal of Food Protection,2005,68(7):1381-1387.
[21]Tong L N,Li S M,Meng L B.Effect of inoculating arbuscular mycorrhizal fungi and rhizobium on soybean by utilizating organic phosphorus source.Journal of Northeast Agricultural University,2009,40(10):37-42.
[22]Wu Y P,Li Y F,Zheng C Y.Organic amendment application influence soil organism abundance in saline alkali soil.European Journal of Soil Biology,2013,54:32-40.
[23]Xu N N,Xie Y H,Feng X.Effect of adding fermented straw powder on the fertility condition of saline alkali soil.Journal of Tianjin University of Technology,2013,29(4):57-59.
[24]Rong L Y,Yao T,Ma W B,etal.The inoculant potential of plant growth promoting rhizobacteria strains to improve the yield and quality ofTrifoliumpretensecv.Minshan.Acta Prataculturae Sinica,2014,23(5):231-240.
參考文獻:
[1]張艷娟,沈益新.南方農區的紫花苜蓿發展潛力與方向[C].北京:第三屆中國苜蓿發展大會,2010.
[2]魯如坤.我國土壤氮、磷、鉀的基本狀況.土壤學報,1989,26(3):280-286.
[11]李劍峰,張淑卿,師尚禮,等.微薄誘變選育耐藥高效溶磷苜蓿根瘤菌.原子能科學技術,2009,43(12):1071-1076.
[12]蔣柏藩,魯如坤,顏益初,等.南方水稻土中磷酸鐵對水稻磷素營養的意義.土壤學報,1963,11(4):361-368.
[13]嚴玉鵬,萬彪,劉凡,等.環境中植酸的分布、形態及界面反應行為.應用與環境生物學報,2012,18(3):494-501.
[14]劉盧生,玉永雄,胡艷,等.酸鋁對耐酸苜蓿根瘤菌生長的影響.安徽農業科學,2012,40(36):17615-17618.
[15]劉文干,何園球,張坤,等.一株紅壤溶磷菌的分離、鑒定及溶磷特性.微生物學報,2012,52(3):326-333.
[17]謝益強,方柏山.植酸抑菌保鮮作用的研究.福建化工,2002,(4):39-41.
[18]侯偉鋒,謝晶,藍蔚青,等.植酸對大腸桿菌抑菌機理的研究.江蘇農業學報,2012,28(2):443-447.
[19]謝晶,侯偉鋒,湯毅,等.植酸對腐敗希瓦菌的抑菌機理.食品工業科技,2011,32(10):85-88.
[21]佟麗娜,李淑敏,孟令波.雙接種對大豆利用不同有機磷源的影響.東北農業大學學報,2009,40(10):37-42.
[23]徐娜娜,解玉紅,馮忻.添加發酵秸稈粉對鹽堿土壤肥力的影響.天津理工大學學報,2013,29(4):57-59.
[24]榮良燕,姚拓,馬文彬,等.岷山紅三葉根際優良促生菌對其宿主生長和品質的影響.草業學報,2014,23(5):231-240.

