前壁ST段抬高型心肌梗死患者的心電圖改變對多支血管病變的預測價值
戴麗萍
臨床研究論著
前壁ST段抬高型心肌梗死患者的心電圖改變對多支血管病變的預測價值
戴麗萍
目的探究前壁ST段抬高型心肌梗死(ASTEMI)患者的心電圖改變與多支冠狀動脈病變的相關關系及其對多支冠狀動脈病變的預測價值。方法選擇ASTEMI患者230例,用回顧性分析的方法對其心電圖的改變與冠狀動脈血管造影資料進行分析。結果ASTEMI患者的aVL導聯、V6導聯ST段壓低并伴下壁導聯鏡像性改變與冠狀動脈血管造影顯示為多支血管病變(MVD)相關(P均<0.01);當對所有ASTEMI患者進行分析時,若患者aVL導聯、V4導聯、V5導聯、V6導聯的ST段出現壓低,則與冠狀動脈血管造影顯示為MVD相關(P均<0.01)。結論對于ASTEMI并伴有下壁導聯鏡像性改變的患者,其前側壁導聯ST的壓低與冠狀動脈血管造影顯示為MVD密切相關。
前壁ST段抬高型心肌梗死;心電圖;下壁導聯鏡像性改變;多支血管病變;梗死相關動脈
前壁心肌梗死是心血管疾病中的常見疾病,其具有發病率高,預后差等特點[1]。心電圖以其簡便性、經濟性、快捷性、無創性、可持續性等優點,一直是臨床診斷心肌梗死的重要常規手段。它不但能夠確定心肌梗死的臨床診斷,而且還可以指示梗死的相關部位,更為重要的是根據心電圖能夠對梗死進行分期,這對于患者的治療有極其重要的價值[2]。對于前壁心肌梗死的患者,一個或多個下壁導聯ST段壓低或抬高是其心電圖的常見特征。ST段的偏移幅度不僅受心肌缺血范圍的影響,也受梗死部位和缺血的嚴重程度影響,還受胸廓的形態、厚度等的影響[3]。部分患者在AMI的早期,其心電圖的ST段出現特殊的墓碑型改變,且預后不良。目前,對于出現這種改變的確切機制尚不十分清楚,有研究認為其可能與患者心肌梗死后側支循環建立不完善有關[4]。本研究選擇230例被診斷為前壁ST段抬高型心肌梗死(ASTEMI)的患者,對其心電圖的改變與冠狀動脈血管造影資料進行分析,旨在探究ASTEMI患者的心電圖改變與多支血管病變(MVD)的相關關系及其對MVD的預測價值。
對象與方法
一、研究對象
2014年1月至12月連續于我院急診科就診的患者中,選擇230例被診斷為ASTEMI的患者,用回顧性分析的方法對其心電圖的改變與冠狀動脈血管造影資料進行分析。納入標準:Ⅰ型心肌梗死;患者持續性胸痛30 mim以上,且經硝酸酯類藥物治療后無明顯好轉;心肌損傷標志物心肌肌鈣蛋白I(cTnI)顯著升高且呈現出動態變化(超過其參考值上限的99百分位值);心電圖V2導聯、V3導聯ST段出現抬高,其中女性大于等于0.15 mV,男性大于等于0.2 mV,且在V2導聯、V3導聯上出現新的J點或者T波變高尖[5]。排除標準:有起搏器植入史和冠狀動脈搭橋術史,有陳舊性心肌梗死,患有先天性心臟病和預激綜合征,有主動脈夾層和早期復極,有暫時或永久性束支傳導阻滯。
二、冠狀動脈造影及分析
入選的230例患者均在我院醫技科行冠狀動脈造影術,再由我院心內科多名主任醫師采用單盲法對造影結果進行解釋評價。當冠狀動脈直徑目測狹窄程度大于等于50%視為有意義[6]。根據冠狀動脈管腔內血管夾層的存在與否、潰瘍和血栓殘留物等的有無,并結合心電圖判定梗死相關動脈。根據病變累及的部位不同,按照累及左前降支的MVD和累及左前降支的單支血管(SLAD)將所入選患者進行分類。
三、統計學處理
采用SSPS 19.0統計軟件,數據以n(例)表示,分類變量組間比較行χ2檢驗,若理論頻數有小于1,或者小于5的格子數較多時采用Fisher確切概率法。P<0.05為差異有統計學意義。
結 果
一、一般資料
230例被診斷為ASTEMI患者,依據患者心電圖Ⅱ導聯、Ⅲ導聯和aVF下壁導聯ST段改變的不同(測量J點后0.08 s時ST段的偏移量,至少相鄰兩個導聯其偏移量應大于等于1 mm),將所入選的230例ASTEMI患者分為2組。即ASTEMI合并下壁導聯ST段抬高組(A+H組)、ASTEMI合并下壁導聯鏡像性改變組(A+R組)。A+H組163例,其中SLAD 98例,MVD 65例。A+R組67例,其中SLAD 27例,MVD 40例。
二、下壁導聯ST段壓低合并前壁導聯鏡像性改變
當患者心電圖顯示為A+H時,MVD組患者V6導聯、aVL導聯ST段出現壓低的比例顯著高于SLAD組患者,表明患者心電圖V6導聯、aVL導聯ST段出現壓低與MVD相關(P=0.002,P=0.003),見表1。
三、下壁導聯ST段抬高合并前壁導聯鏡像性改變
當患者心電圖顯示為A+R時,SLAD組與MVD組患者心電圖各導聯的ST段出現抬高的比例比較差異均無統計學意義(P>0.05),見表2。
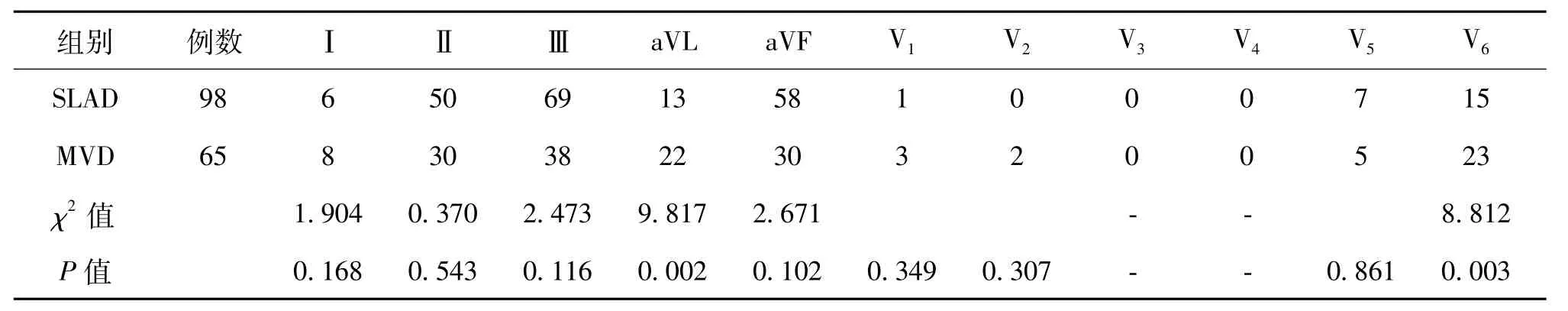
表1 下壁導聯ST段壓低合并前壁導聯鏡像性改變
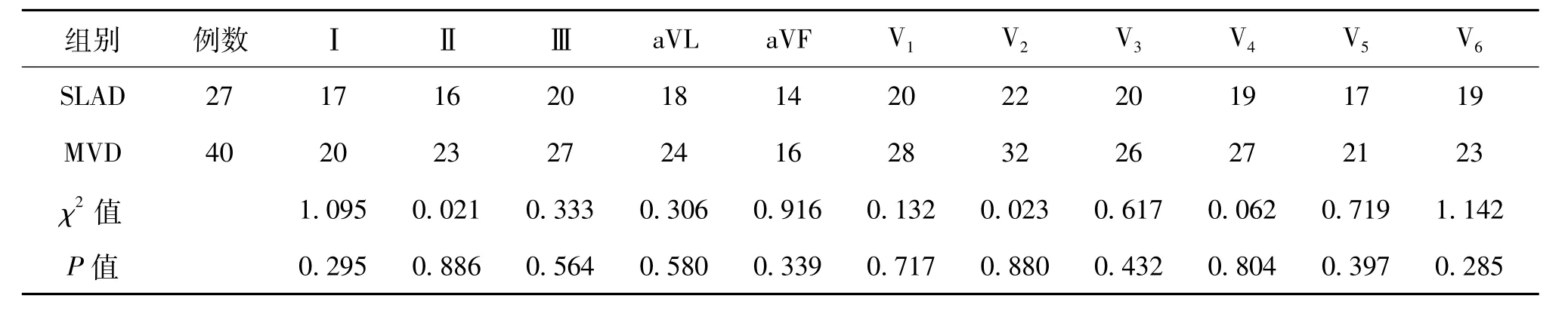
表2 下壁導聯ST段抬高合并前壁導聯鏡像性改變
四、下壁導聯ST段壓低合并前壁導聯鏡像性抬高或壓低
230例ASTEMI患者中,病變僅累及左前降支的SLAD患者所占比例為56.1%(129/230),病變僅累及左前降支的MVD患者所占比例為43.9% (101/230)。MVD組的心電圖的aVL導聯、V4導聯、V5導聯和V6導聯的ST段出現壓低的比例明顯高于SLAD組(P=0.006,P=0.004,P=0.003,P=0.005),見表3。
五、下壁導聯ST段抬高合并前壁導聯鏡像性抬高或壓低
SLAD組與MVD組患者中心電圖各導聯的ST段出現抬高的比例比較差異無統計學意義(P均>0.05),見表4。
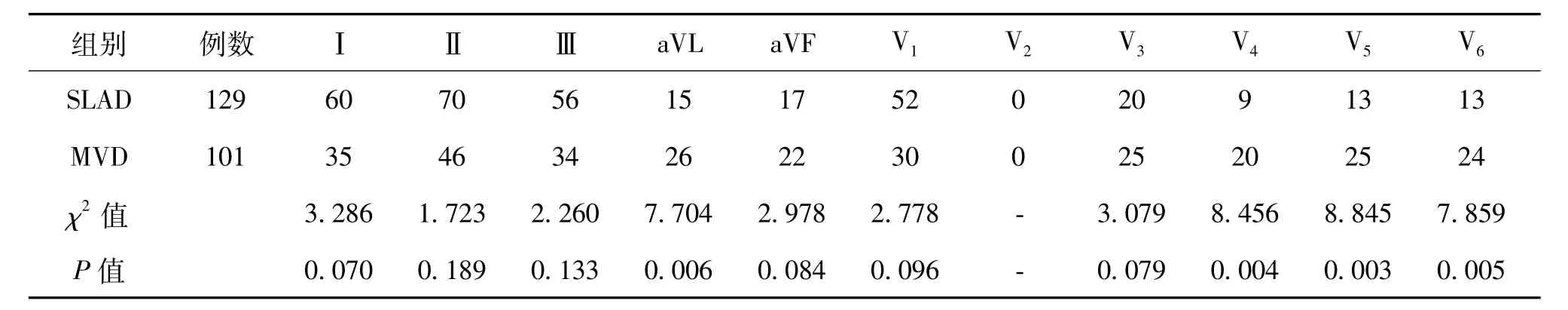
表3 下壁導聯ST段壓低合并前壁導聯鏡像性抬高或壓低
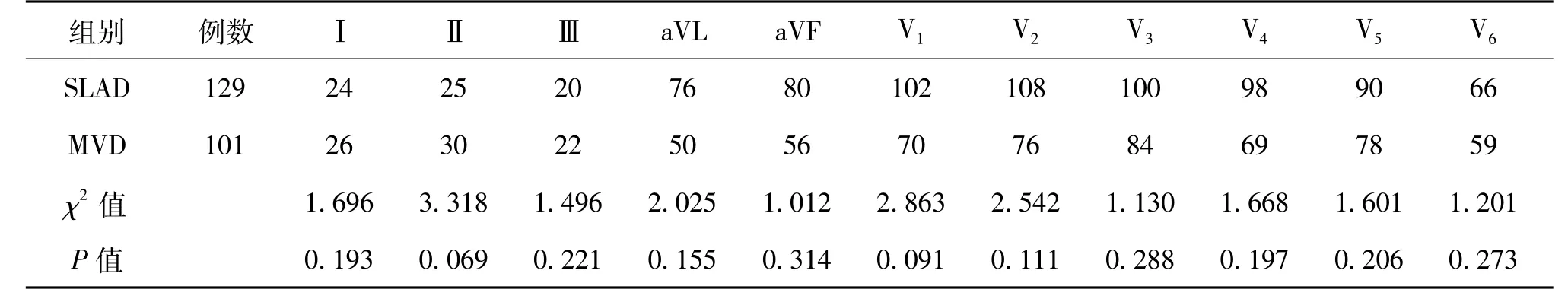
表4 下壁導聯ST段抬高合并前壁導聯鏡像性抬高或壓低
討 論
心肌梗死是臨床常見的心血管疾病之一,是由于冠狀動脈急性、持續性缺血缺氧而導致的心肌壞死。臨床上常表現為胸骨后疼痛,劇烈而持久,一般持續30 min以上,同時伴有心電圖進行性改變、血清心肌酶活性增高[7]。患者經休息和使用硝酸酯類藥物治療后不能完全緩解,可并發心力衰竭、心律失常和休克等癥狀,嚴重威脅患者的生命健康。
心電圖是臨床診斷心肌梗死的重要手段,根據心電圖的進行性改變情況,不僅可指導心肌梗死患者的臨床治療,還可對患者的預后進行評估和病情進行分析[8]。前壁心肌梗死患者病變不僅累及SLAD,亦可累及MVD。在SLAD或MVD時,患者心電圖均可出現下壁導聯ST段鏡像性改變。故aVL導聯ST段出現抬高或下壁導聯出現鏡像性改變時,對MVD的預測是不可靠的。而當前壁心肌梗死患者側壁導聯ST段出現壓低時,MVD組與SLAD組具有顯著性差異,因此對于MVD的預測可靠性較好。在本研究中,60%的前壁心肌梗死患者為MVD,而在下壁導聯有鏡像性改變的患者中MVD所占比例為40%。
目前,ASTEMI伴下壁導聯ST段出現壓低的機制尚不十分清楚,多數研究者認為有以下2種機制[9]。部分患者的左冠狀動脈在血供上占優勢,其左心室下壁的部分心肌的血液由繞過心尖部的左前降支供應,當患者前降支閉塞血供不暢時,除前壁心肌受損外,下壁心肌也會被累及引起缺血性損傷,從而出現ASTEMI合并下壁導聯ST段壓低;部分患者梗死累及多支血管,而左回旋支及右冠狀動脈供應左心室下壁心肌所需血液,其雖出現狹窄但并未完全閉塞,從而形成了一條由左前降支供應血液到下壁心肌缺血區的側支循環。因此,一但患者的左前降支完全閉塞而導致側支循環中斷,下壁心肌血液供應受阻,從而引起患者下壁心肌缺血性損傷,以致出現ASTEMI合并下壁導聯ST段壓低。有研究表明,前壁ST段抬高型心肌梗死合并下壁導聯ST段抬高的患者的死亡率顯著高于單純性前壁心肌梗死患者,并且下壁導聯ST段出現抬高常常預示患者發生了室間隔穿孔[10]。有研究表明出現下壁導聯ST段壓低的ASTEMI患者的左心室功能較未出現者差,且MVD及并發癥的發生率也較高[11]。
ASTEMI患者的左前降支和第一對角支閉塞導致其心電圖出現下壁導聯ST段壓低的現象,但患者的左心室下壁區域并未出現缺血,它僅僅反映了一個鏡像性的電生理現象。鏡像性ST段壓低與心前區導聯ST段出現抬高密切相關,但其不能反映患者心臟冠狀動脈病變的嚴重程度。目前,對于心肌梗死患者梗死相關動脈(IRA)累及的范圍(SLAD或MVD)的預測,許多研究者提出了不同的假設。Brogan等[12]研究指出,第一鈍緣支、左前降支近端及第一對角支閉塞均可引起前壁心肌梗死患者aVL導聯ST段出現抬高。這表明ASTMEI患者左前降支堵塞發生在第一對角支之前是可通過患者心電圖aVL導聯、V2導聯、V3導聯、V4導聯和V5導聯ST段出現抬高來預測的。而第一鈍緣支堵塞則表現為患者心電圖aVL導聯ST段抬高同時伴有V2導聯ST段壓低。Schreck等[13]研究發現,可通過計算患者心電圖V5導聯、Ⅰ導聯以及aVL導聯T波倒置的總和及V1導聯至V4導聯ST段抬高的總幅度預測SLAD和MVD中的IRA。在此基礎上,他們開發出了一套用于預測IRA的記分系統。如果ASTEMI患者側壁導聯T波的倒置的總和減小,同時前壁導聯ST段抬高總和也減小時,患者的IRA是回旋支的可能性最大;但患者側壁導聯T波的倒置總和減小,同時前壁導聯ST段抬高總幅度增加時,患者的IRA極可能為左前降支;而當側壁導聯T波的倒置總和增加,同時前壁導聯ST段抬高總幅度減小時,患者的IRA最有可能是鈍緣支。
綜上所述,對于ASTEMI并伴有下壁導聯鏡像性改變的患者,其前側壁導聯ST的壓低與冠狀動脈血管造影顯示為MVD密切相關。
[1]史小麗.ST段抬高型心肌梗死超急性期心電圖表現分析.中西醫結合心腦血管病雜志,2012,10 (12):1438-1438.
[2]關欣亮,艾輝,王春梅,李艷芳,朱小玲.對應導聯ST段壓低在急性ST段抬高心肌梗死患者中的臨床價值.首都醫科大學學報,2012,33(6):818-821.
[3]Jones WS,Clare RM,Chiswell K,Perera D,French JK,Kumar AS,Blaxill J,Pijls N,Mills J,Ohman EM,Patel MR.The impact of processes of care on myocardial infarct size in patients with st-segment elevation myocardial infarction:observations from the CRISP-AMI trial.Clin Cardiol,2015,38(1):25-31.
[4]Meimoun P,Abouth S,Boulanger J,Luycx-Bore A,Martis S,Clerc J.Relationship between acute strain pattern and recovery in tako-tsubo cardiomyopathy and acute anterior myocardial infarction:a comparative study using two-dimensional longitudinal strain.Int J Cardiovasc Imaging,2014,30(8):1491-1500.
[5]Stavileci B,Cimci M,Ikitimur B,Barman HA,Ozcan S,Ataoglu E,Enar R.Significance and usefulness of narrow fragmented QRS complex on 12-lead electrocardiogram in acute ST-segment elevation myocardial infarction for prediction of early mortality and morbidity.Ann Noninvasive Electrocardiol,2014,19(4):338-344.
[6]王瑞強,王志倩,王利梅,胡小正.急性心肌梗死不典型心電圖32例臨床分析.西部醫學,2014,26 (4):455-457.
[7]Gür M,Türkogˇlu C,Ta?kln A,U?ar H,B?rek?i A,Seker T,G?zükara MY,Kaypakl O,Akyol S,Selek S,Sahin DY,Elbasan Z,Cayl M.Paraoxonase-1 activity and oxidative stress in patients with anterior ST elevation myocardial infarction undergoing primary percutaneous coronary intervention with and without no-reflow.Atherosclerosis,2014,234(2):415-420.
[8]吳素芬.下壁正后壁合并右心室心肌梗死的心電圖表現1例.中華保健醫學雜志,2012,14(6):448,455.
[9]Roifman I,Zia MI,Zavodni A,Wolff R,Ghugre NR,Leber AW,Dick AJ,Wright GA,Connelly KA.Evolution of right ventricular function post-acute ST elevation myocardial infarction.J Magn Reson Imaging,2014,40 (3):709-714.
[10]Caretta G,Passamonti E,Pedroni PN,Fadin BM,Galeazzi GL,Pirelli S.Outcomes and predictors of mortality among octogenarians and older with ST-segment elevation myocardial infarction treated with primary coronary angioplasty.Clin Cardiol,2014,37(9):523-529.
[11]Tamis-Holland JE,O'Gara P.Highlights from the 2013 ACCF/AHA guidelines for the management of ST-elevation myocardial infarction and beyond.Clin Cardiol,2014,37(4):252-259.
[12]Brogan RA,Malkin CJ,Batin PD,Simms AD,McLenachan JM,Gale CP.Risk stratification for ST segment elevation myocardial infarction in the era of primary percutaneous coronary intervention.World J Cardiol,2014,6(8):865-872.
[13]Schreck DM,Fishberg RD.Diagnostic accuracy of a new cardiac electrical biomarker for detection of electrocardiogram changes suggestive of acute myocardial ischemic injury.Ann Noninvasive Electrocardiol,2014,19 (2):129-144.
Value of electrocardiogram changes in predicting multivessel disease in patients with anterior ST elevation myocardial infarction
Dai Liping.Yinzhou People's Hospital,Ningbo 315050,China
ObjectiveTo analyze the correlation between electrocardiogram(ECG)variations and multivessel disease(MVD),and evaluate ECG changes in predicting the risk of MVD in patients diagnosed with anterior ST elevation myocardial infarction(ASTEMI).MethodsIn this study,230 patients diagnosed with ASTEMI were recruited.ECG findings and imaging data of coronary artery were retrospectively analyzed.ResultsIn the ASTEMI patients,the ST-segment depression in aVL and V6leads complicated with reciprocal changes in the inferior leads were significantly correlated with the incidence of MVD assessed by coronary angiography(all P<0.01).The ST-segment depression in aVL,V4,V5and V6leads were remarkably associated with the presence of MVD assessed by coronary angiography(all P<0.01).Conclusion For ASTEMI patients with reciprocal changes in the inferior wall leads,ST-segment depression in the anterolateral leads is closely related to the incidence of MVD reflected by coronary angiography.
Anterior ST elevation myocardial infarction;Electrocardiogram;Reciprocal changes in the inferior leads;Multivessel disease;Culprit artery
2015-06-06)
(本文編輯:楊江瑜)
10.3969/j.issn.0253-9802.2015.11.013
315050寧波,浙江鄞州人民醫院

