滲透汽化原位分離耦合拜氏梭菌丁醇發酵的研究
劉曉潔,沈兆兵,劉 莉*,史吉平3,*
(1.中國科學院上海高等研究院,上海201210;2.中國科學院大學,北京100049;3.上海科技大學生命科學與技術學院,上海201210)
滲透汽化原位分離耦合拜氏梭菌丁醇發酵的研究
劉曉潔1,2,沈兆兵1,2,劉 莉1,*,史吉平1,3,*
(1.中國科學院上海高等研究院,上海201210;2.中國科學院大學,北京100049;3.上海科技大學生命科學與技術學院,上海201210)
以篩選得到的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)-聚偏氟乙烯(polyvinylidene fluoride,PVDF)復合膜為分離用膜,開展了拜氏梭菌(Clostridium beijerinckii)ZL01丁醇發酵與滲透汽化原位分離耦合的研究,結果表明:分批發酵-滲透汽化原位分離耦合與分批發酵相比,初始葡萄糖質量濃度從50 g/L提高至90 g/L;在90 g/L的初始葡萄糖質量濃度下,發酵結束時發酵液和滲透液中的丁醇總產量從13.2 g/L提高到16.9 g/L,總溶劑(丙酮(acetone)、丁醇(butanol)、乙醇(ethanol),簡稱ABE)產量從17.8 g/L提高到24.3 g/L,葡萄糖利用率從59.4%提高到95.7%。另外,分離過程中膜的總滲透通量平均為705 g/(m2·h),丁醇分離因子平均為19.0;經滲透汽化分離,滲透液可直接進入下一步蒸餾階段,其中丁醇和總溶劑ABE質量濃度分別為178 g/L和292 g/L,與分批發酵工藝中發酵液直接進入蒸餾塔相比,丁醇和總溶劑ABE質量濃度分別提高了10.9倍和14.1倍,可大大降低蒸餾能耗。
丁醇;滲透汽化;原位分離;拜氏梭菌;發酵
丁醇作為一種優良的有機溶劑和重要的化工原料,廣泛應用于化工、食品、塑料、有機合成、油漆等工業[1-2],同時丁醇也是一種非常有潛力的車用液體燃料[1]。目前丁醇的生產方法主要有化學法和生物法,生物法生產丁醇早在一戰期間是僅次于乙醇的第二大發酵工業[3]。后來因石化工業迅猛發展,化學法替代了丁醇的生物發酵法生產。20世紀末,隨著石油資源的日趨減少和全球環境污染問題的日益嚴重,可持續發展受到越來越多的關注,由于生物法可以利用可再生的生物質資源,而且生物丁醇作為液體燃料不會產生NOX和硫化物等引發大氣污染的物質,因此生物發酵法生產丁醇技術又重新受到重視[4]。
生物發酵法生產丁醇,產品除丁醇(butanol)外還含有丙酮(acetone)、乙醇(ethanol)等副產物,因此簡稱為ABE發酵。發酵所用菌種多為丙酮丁醇梭菌(Clostridium acetobutylicum)、拜氏梭菌(Clostridium beijerinckii)等,以玉米、木薯等淀粉質原料或者秸稈、玉米芯等木質纖維素原料,在厭氧條件下發酵得到丁醇等產物[5-7]。但是發酵過程中產物丁醇對微生物的生長代謝產生抑制,使得發酵液中總溶劑ABE質量濃度一般維持在23 g/L以下,其中丁醇一般不超過13 g/L[8]。發酵液中丁醇質量濃度低導致工業分離提取成本高。為了減弱產物抑制,提高產量,降低成本,解決方法主要有:1)采用基因工程等生物技術手段對菌種進行改造,獲得耐丁醇的高產菌株;2)采用有效的分離技術與發酵工藝耦合,及時移除丁醇,減弱產物抑制。研究較多的分離提取方法有液-液萃取[9]、氣提[10-11]、吸附[12]、精餾[13]和滲透汽化[14-17]等。滲透汽化是一種節能有效的新型膜分離技術,操作簡單、選擇性高、能耗較低[18],與發酵耦合時對菌體沒有危害[19],因此得到廣泛的關注[15-17]。目前滲透汽化分離丁醇的研究大多集中在新型滲透汽化膜材料的開發上,對發酵耦合工藝研究的關注較少。Qureshi等[20]將滲透汽化應用于C. acetobutylicumATCC 824發酵液中丁醇等溶劑的分離提取,研究滲透汽化與分批補料發酵相耦合,發酵液體積0.50 L,滲透汽化膜面積0.022 m2,發酵結束后,溶劑產率從0.30 g/(L·h)提高至0.37 g/(L·h)。Li Jing等[21]以木薯為底物,研究滲透汽化與C. acetobutylicumDP217間歇發酵耦合,發酵液體積1.0 L,滲透汽化膜面積0.007 2 m2,丁醇和總溶劑ABE產量分別達到13.0 g/L和21.3 g/L。當滲透汽化與連續發酵耦合時,發酵320 h,總溶劑ABE產量達到201.8 g/L。本研究利用實驗室誘變得到的高產丁醇菌株Clostridium beijerinckiiZL01,將丁醇發酵工藝與滲透汽化原位分離耦合,考察丁醇分離及產量提高效果,以期為滲透汽化分離工藝在丁醇提取中的實際應用提供參考。
1 材料與方法
1.1菌種與培養基
菌種:拜氏梭菌(Clostridium beijerinckii)ZL01,是上海高等研究院生物煉制實驗室由C. beijerinckiiNCIMB 8052(購于美國菌種保藏中心)誘變選育獲得的丁醇高產菌株。
TYA種子培養基:葡萄糖40 g、酵母粉2.0 g、蛋白胨6.0 g、牛肉粉2.0 g、CH3COONH43.0 g、MgSO4·7H2O 0.2 g、K2HPO40.5 g、FeSO4·7H2O 0.01 g,蒸餾水定容至1 L,自然pH值,115℃滅菌15 min。
TYA發酵培養基:葡萄糖50 g、酵母粉2.0 g、蛋白胨6.0 g、牛肉粉2.0 g、CH3COONH43.0 g、MgSO4·7H2O 0.2 g、K2HPO40.5 g、FeSO4·7H2O 0.01 g,蒸餾水定容至1 L,自然pH值,115℃滅菌15 min。
1.2儀器與設備
LC-20A高效液相色譜儀、GC-2010 plus高效氣相色譜儀 日本Shimadzu公司;MDF-U53V-80℃超低溫冰箱 日本三洋公司;ZDP-A2160全自動新型電熱培養箱上海智誠分析儀器制造有限公司;D8C-31046歐瑞康萊寶真空泵 歐瑞康萊寶真空設備(天津)有限公司;A23617分光光度計 德國Beckman公司。
1.3方法
1.3.1菌種活化與培養
從-80℃冰箱取出保藏菌種,以200μL轉接到含10 mL種子培養基的試管中,在沸水中熱激1.0 min,迅速放入室溫水中冷卻5 min,37℃恒溫培養箱中靜置培養24 h,然后按10%的接種量轉入含有40 mL種子培養基的100 mL三角瓶,在37℃恒溫培養箱中靜置培養24 h后,按10%的接種量轉入含有100 mL種子培養基的250 mL三角瓶,在37℃恒溫培養箱中靜置培養24 h后用于實驗。
1.3.2滲透汽化原位分離耦合丁醇發酵裝置的建立
滲透汽化原位分離耦合丁醇發酵裝置為自制,如圖1所示。滲透汽化原位分離耦合丁醇發酵裝置包括發酵罐、蠕動泵、滲透汽化膜組件、冷肼、真空系統、管路等部件,發酵液從發酵罐經蠕動泵進入滲透汽化膜組件,在膜組件內經過滲透汽化分離,透過膜一側的滲透液在真空系統中汽化后由液氮冷肼收集,未滲透的組分循環回到發酵罐。發酵罐體積為2 L,加入1 L發酵液,發酵溫度由水浴加熱控制,流量由轉子流量計設定,結合蠕動泵調節流量為15 L/h。滲透汽化膜的有效膜面積為2.4×10-3m2,膜下游側真空壓強小于800 Pa,膜材料由清華大學化工系和同濟大學提供。在發酵與滲透汽化分離耦合開始前,滲透汽化裝置首先用75%酒精循環沖洗1 h,然后用1 L無菌水循環沖洗1 h。
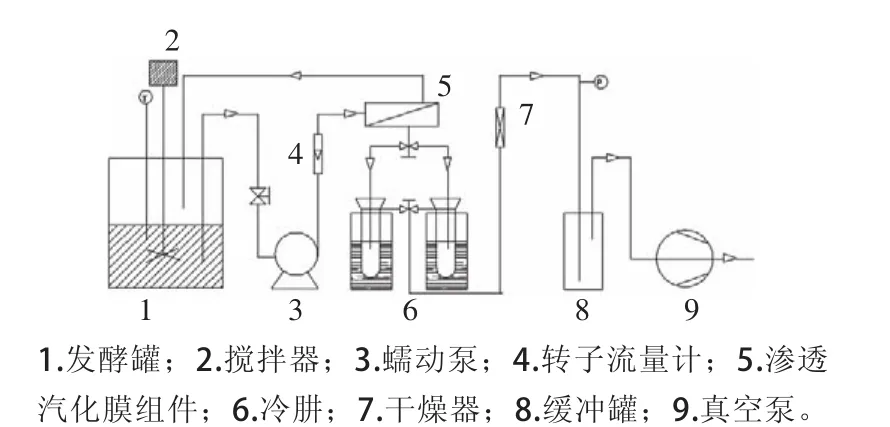
圖1 滲透汽化原位分離耦合丁醇發酵裝置Fig.1 Schematic diagram showing the experimental setup for butanol fermentation integrated with in situ pervaporation
滲透汽化原位分離性能的評價指標主要有滲透通量(J)和分離因子(α)。

式中:m為滲透液質量/g;A為膜有效面積/m2;t為滲透汽化過程操作時間/h;J為滲透通量/(g/(m2·h));y為組分在滲透液中的質量分數/%;x為組分在原料液中的質量分數/%。
1.3.3滲透汽化原位分離耦合丁醇發酵
將活化培養好的菌種按10%的接種量轉入含有1 L發酵培養基的發酵罐中,37℃靜置培養至發酵液中丁醇質量濃度為6.0 g/L左右時,開始耦合滲透汽化分離。
1.3.4發酵液和滲透液中溶劑的測定
采用氣相色譜法(gas chromatography,GC)測定發酵液和滲透液中的各溶劑含量,滲透液中由于有機溶劑質量濃度高故分為兩相,在測定前用去離子水稀釋。氣相色譜儀Shimadzu 2010 Plus,色譜條件:毛細管色譜柱Inert Cap Pure Wax(30 m×0.25 mm,0.25μm);程序升溫:50℃保持3.8 min,以20℃/min升至220℃,保持3 min;進樣口溫度200℃,FID檢測器溫度230℃;載氣N2流量1.0 mL/min,H2流量40 mL/min;空氣流量400 mL/min;進樣量0.5μL;分流比50∶1。采用內標法定量,內標為異丁醇[22]。
1.3.5發酵液中殘糖的測定
采用高效液相色譜法(high performance liquid chromatography,HPLC)測定發酵液中殘留葡萄糖的含量,液相色譜儀Shimadzu LC-20A,色譜條件:液體色譜柱Bio-Rad Aminex HPX-87H(300 mm×7.8 mm),柱溫65℃;流動相0.005 mol/L H2SO4,流速0.8 mL/min;檢測器為RID;進樣量20μL。采用外標法定量[22]。
1.3.6發酵液中菌體細胞濃度的測定
采用分光光度法[20]測定發酵液中的菌體細胞濃度,將發酵液搖勻后取樣,樣品稀釋至適當濃度,在波長600 nm處測定光密度(OD)值。
2 結果與分析
2.1滲透汽化膜材料的篩選
用于丁醇滲透汽化分離的膜材料主要集中于聚合物膜及其改性膜,有代表性的是含硅聚合物膜和聚醚酰胺嵌段共聚物(poly(ether block amide),PEBA)聚合物膜材料[23],含硅聚合物膜中聚二甲基硅氧烷(polydimethylsiloxane,PDMS)最受關注[24-25]。因此本研究主要選取了PEBA膜和PDMS膜,進行了質量分數1.5%丁醇-水溶液滲透汽化分離實驗,以篩選最佳的丁醇分離用膜,結果見表1。

表1 不同滲透汽化膜材料分離丁醇-水溶液的結果比較Table1 Comparison of pervaporation performance by different membranes in butanol-water solution
滲透通量與分離因子之間一般是相互矛盾的,滲透通量較大的膜,分離因子較小。在考察的12種膜中,PDMS-18#的滲透通量最大,高達1 889.5 g/(m2·h),但其分離因子最低,只有3.2,不能滿足丁醇的分離要求。PDMS-1#是一種PDMS-PVDF復合膜,分離1.5%丁醇-水溶液的滲透通量為1 054.6 g/(m2·h),分離因子為20.8,綜合考慮分離效率,選擇膜PDMS-1#做進一步的研究。
2.2初始葡萄糖質量濃度對丁醇分批發酵的影響
在初始葡萄糖質量濃度50.3 g/L時,經過44 h發酵結束,發酵液中丁醇、丙酮、乙醇以及總溶劑ABE產量分別為15.0、4.0、0.4 g/L以及19.4 g/L,此時總溶劑ABE產率為0.44 g/(L·h)。44 h發酵結束后,發酵液中殘糖含量為0.3 g/L,葡萄糖利用率為99.4%,葡萄糖幾乎全部耗盡。為提高溶劑產量,研究最佳初始糖質量濃度,降低成本,分別進行了初始葡萄糖質量濃度為70.3、90.0 g/L及111.0 g/L的分批發酵,結果見表2。隨著葡萄糖質量濃度升高至70.3 g/L和90.0 g/L,丁醇產量下降至13.3 g/L和13.2 g/L,并且發酵時間延長。在高質量濃度葡萄糖條件下,底物對菌種發酵過程產生了負作用,降低了產量。當葡萄糖質量濃度為111.0 g/L時,丁醇產量僅僅為11.3 g/L,與50.3 g/L相比,總溶劑ABE產率降低了50%,說明此時高質量濃度的底物已嚴重抑制了菌體正常的生長代謝,原因可能為:1)葡萄糖質量濃度太高,培養基中滲透壓較大對菌體細胞有一定的危害作用;2)葡萄糖作為碳源,過高質量濃度的葡萄糖與其他營養成分比例不平衡,存在制約,影響了發酵[26]。
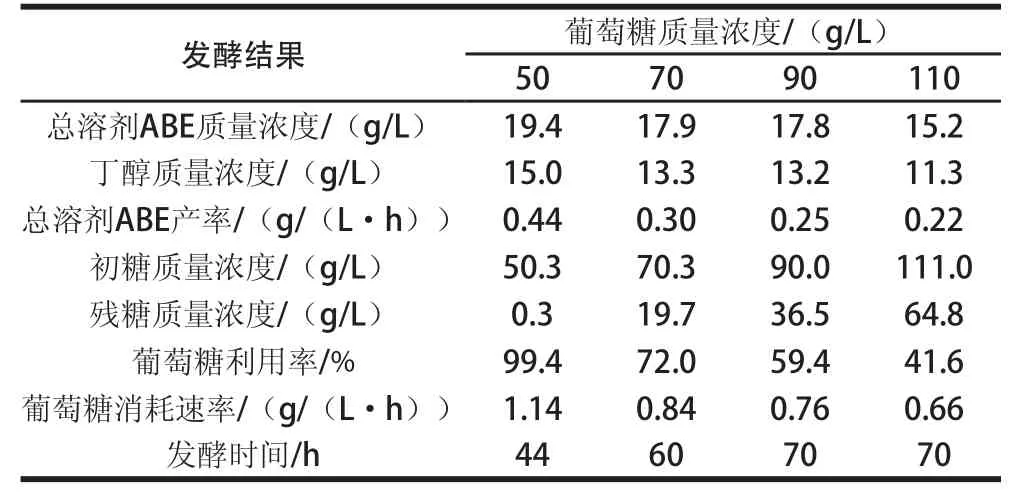
表2 C. beijerincckkiiii ZL01在不同初始葡萄糖質量濃度下分批發酵的結果比較Table2 Comparison of batch fermentation from different concentrations of original glucose byC. beijerinckii ZL01
由表2可知,C. beijerinckiiZL01在4個葡萄糖質量濃度下的分批發酵過程中,被利用的葡萄糖大約都在50 g/L左右。這可能是隨著發酵液中丁醇的累積,產物對菌體生長代謝的抑制作用逐漸增強,反過來影響了菌種對葡萄糖的利用,為了減弱產物抑制,提高產量,需要及時移除丁醇。
2.3丁醇分批發酵-滲透汽化分離耦合的研究
2.3.1初始葡萄糖質量濃度對分批發酵-滲透汽化分離耦合的影響
適當增加底物質量濃度發酵能夠減小設備規模,降低工業成本,因此,考察了初始葡萄糖質量濃度為50、70、90、110 g/L時,分批發酵與滲透汽化分離耦合工藝下各項發酵指標,結果見表3。
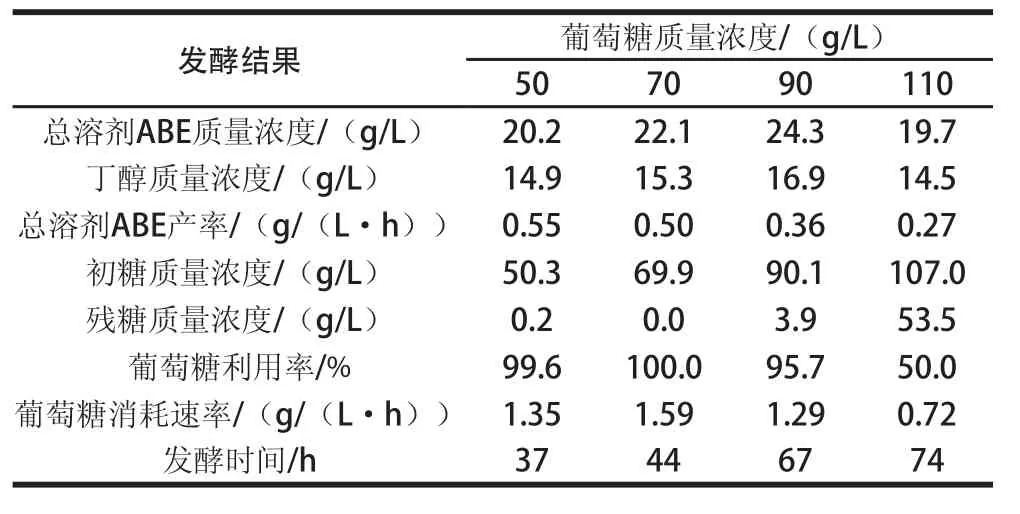
表3 C. beijerinckii ckii ZL01在不同初始葡萄糖質量濃度下分批發酵-滲透-汽化原位分離耦合的結果比較Table3 Comparison of batch fermentation integrated with Table3 Comparison of batch fermentation integrated with in situ itu pervaporation from different concentrations of original glucose by pervaporation from different concentrations of original glucose by C. beijerinckiikii ZL01ZL01
當初始葡萄糖質量濃度為50 g/L時,總溶劑ABE產量為20.2 g/L,與分批發酵的19.4 g/L相差不大,但滲透汽化耦合發酵時間為37 h,比分批發酵的44 h縮短了7 h,因此總溶劑ABE產率從0.44 g/(L·h)提高到0.55 g/(L·h),滲透汽化原位分離耦合丁醇發酵在低質量濃度初始葡萄糖(50 g/L)條件下大大提高了發酵效率。當初始葡萄糖質量濃度為70 g/L,與分批發酵相比,總溶劑ABE產量由17.9 g/L提高到22.1 g/L,提高了23.5%,葡萄糖消耗速率從0.84 g/(L·h)增加到1.59 g/(L·h),增加了89.3%。當初始葡萄糖質量濃度增加至90 g/L,與分批發酵相比,總溶劑ABE產量由17.8 g/L提高到24.3 g/L,提高了36.5%,葡萄糖消耗速率從0.76 g/(L·h)增加到1.29 g/(L·h),增大了69.7%。由于滲透汽化移走丁醇等產物,減弱了產物抑制,與分批發酵相比,溶劑產量均提高,糖消耗速率加快,發酵時間縮短,溶劑產率提高。由表3可知,隨著初始葡萄糖質量濃度的增加,溶劑產量先升高后降低。當葡萄糖質量濃度增加至110 g/L,發酵時間延長至74 h,總溶劑ABE產量下降為19.7 g/L,這可能是因為高質量濃度的葡萄糖對菌株有嚴重的底物抑制,使得發酵不能正常進行,導致丁醇產量降低。
從2.2節分析得出,分批發酵最適葡萄糖質量濃度為50 g/L時,多余的糖不能被利用。但是當分批發酵與滲透汽化原位分離耦合,丁醇被及時移除,菌體細胞濃度增加,促進發酵,多余的糖能夠被利用。如表3所示,50、70 g/L及90 g/L葡萄糖利用率幾乎約為100%,絕大部分葡萄糖被耗盡,滲透汽化原位分離丁醇對發酵過程的進行有明顯的促進作用。分批發酵-滲透汽化原位分離耦合提高了葡萄糖的利用率,并及時移除丁醇,發酵液中丁醇質量濃度降低,減弱了丁醇對菌株的毒害,菌株能夠正常生長代謝,所以糖利用率增加。但是,當初始葡萄糖質量濃度從50 g/L增加至90 g/L,底物抑制作用較弱,總溶劑ABE產率隨糖質量濃度的升高反而降低,這可能是因為膜面積及料液循環等其他因素影響。
綜上所述,本研究以總溶劑ABE質量濃度為指標,認為初始葡萄糖質量濃度為90 g/L,為分批發酵-滲透汽化原位分離耦合工藝的最佳初始糖質量濃度。
2.3.2分批發酵-滲透汽化原位分離耦合過程研究
為了更好地考察滲透汽化對發酵產物的分離效果,對C. beijerinckiiZL01在葡萄糖初始質量濃度50 g/L的TYA培養基中的分批發酵-滲透汽化分離耦合過程中各發酵指標的變化進行了監測,同時以分批發酵過程中各指標作為對照。分批發酵時,50 g/L葡萄糖能被菌種完全利用,經濟性好,但是受到丁醇產物抑制,總溶劑ABE產量只有19.4 g/L。因此在發酵20 h,此時發酵液中丁醇累積至5.5 g/L,將發酵罐與滲透汽化裝置連接,移除丁醇、丙酮等溶劑,直至發酵結束。發酵過程中發酵液中的各溶劑產生情況如圖2所示。圖2a是沒有耦聯滲透汽化分離的分批發酵過程,隨著發酵的進行,發酵液中丁醇、丙酮和乙醇質量濃度持續增加,產物累積逐漸影響菌體正常新陳代謝,最終發酵44 h丁醇質量濃度只能達到15.0 g/L。而從圖2b中明顯可以看出,20 h開始發酵與滲透汽化分離耦聯后,發酵液中尚存的丁醇、丙酮和乙醇質量濃度的增加變慢,28 h時丁醇質量濃度為8.6 g/L,隨著發酵進行,丁醇質量濃度基本保持在該較低水平,直至發酵結束。結果表明滲透汽化有效地起到了分離丁醇等發酵產物的作用。
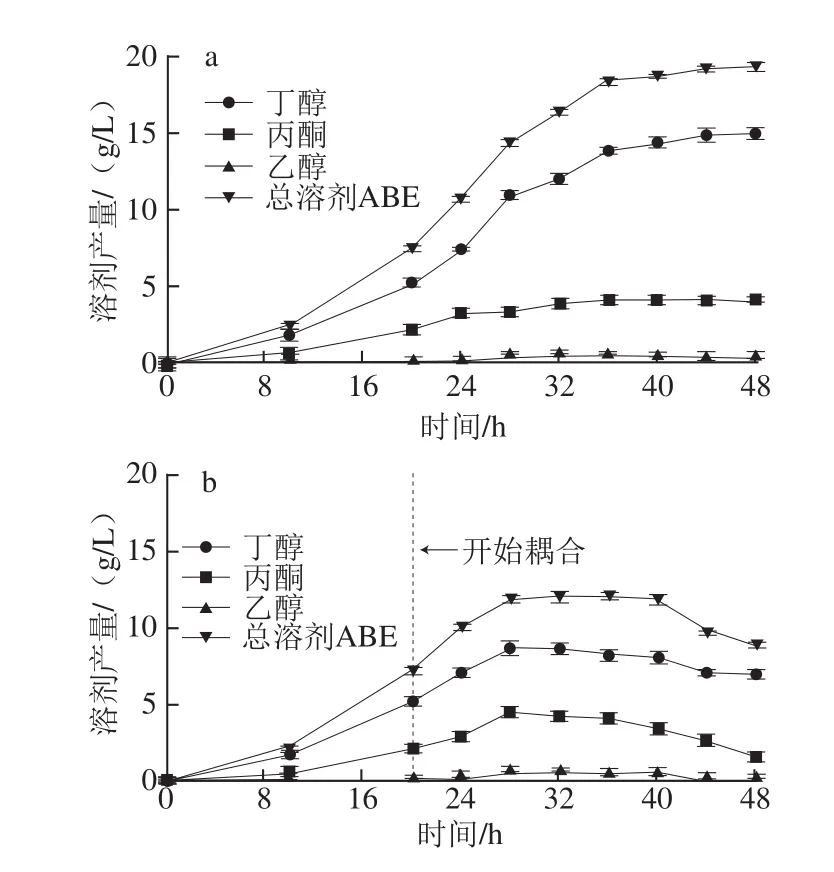
圖2 C. beijerinckii ZL01分批發酵(a)和分批發酵-滲透汽化原位分離耦合(b)過程的發酵液中ABE產生情況Fig.2 ABE production in fermentation broth during batch fermentation by C. beijerinckii ZL01 alone and integrated with in situpervaporation (initial glucose concentration of 50 g/L)
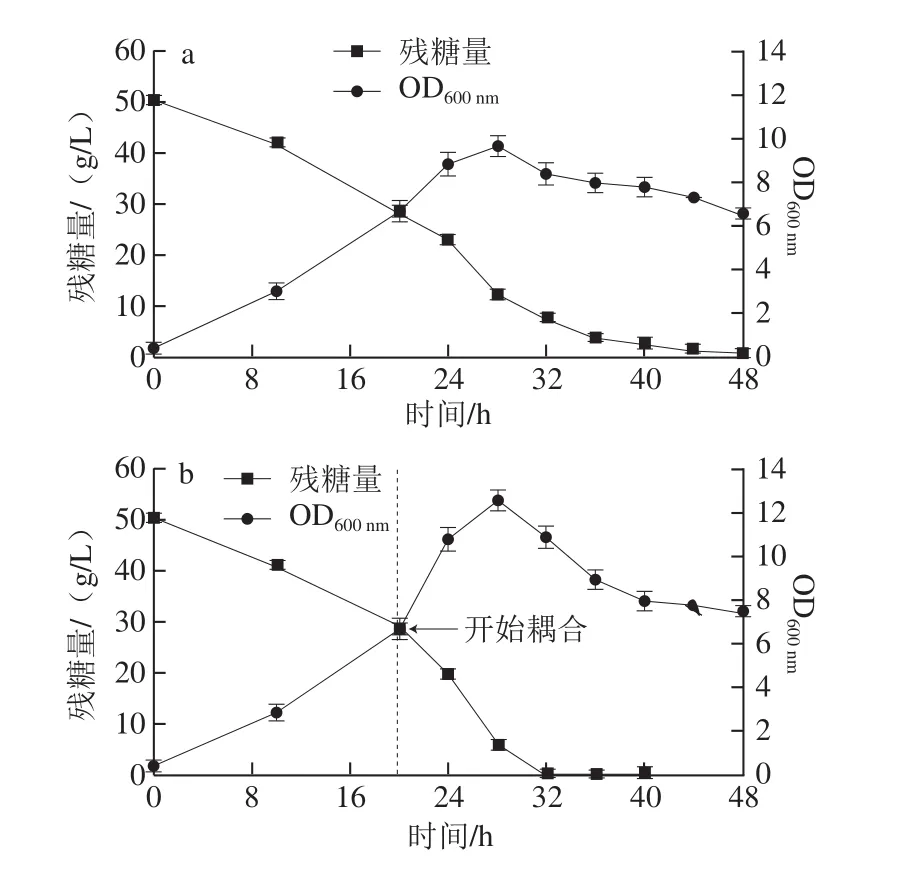
圖3 C. beijerinckii ZL01分批發酵(a)和分批發酵-滲透汽化原位分離耦合(b)過程中葡萄糖消耗和菌株OODD60000 nnmm值的變化Fig.3 Glucose consumption and cell concentration during batch fermentation by C. beijerinckii ZL01 alone and integrated with in situ pervaporation
由圖3a與圖3b對照分析可以得出,從發酵20 h滲透汽化分離耦合以后,由于丁醇、丙酮產物被及時移走,對菌株的產物抑制作用降低,因此發酵20~40 h期間,菌株OD600nm值均高于分批發酵,OD600nm值在28 h達到最高(12.7),與分批發酵的最高值9.6相比,提高32.3%。發酵結束時,丁醇和總溶劑ABE產量分別為14.9 g/L和20.2 g/L,與分批發酵的15.0 g/L和19.4 g/L相比,溶劑產量基本不變,這是由于不論是分批發酵還是滲透汽化耦合發酵,50 g/L葡萄糖都被完全利用,收率是不變的。從葡萄糖消耗情況來看,分批發酵在44 h殘糖量為0.7 g/L,幾乎全部消耗完。而耦合滲透汽化分離之后,32 h時殘糖量就已降至0.5 g/L,到37 h發酵結束時殘糖量僅為0.2 g/L,底物葡萄糖消耗速率提高了37.7%,發酵時間大大縮短。
2.3.3滲透汽化分離耦合丁醇發酵中滲透液各溶劑質量濃度及膜的分離性能
滲透汽化分離可以濃縮丁醇等溶劑,如圖4所示,滲透液中丁醇和總溶劑ABE最高質量濃度分別能達到178 g/L和292 g/L,與分批發酵相比,總溶劑ABE質量濃度提高了14.1倍,可大大降低下一步蒸餾提取的能耗。同時,從圖5中可以看出,分批發酵-滲透汽化原位分離耦合過程中,總滲透通量平均為705 g/(m2·h),丁醇、丙酮和乙醇分離因子分別為19.0、20.4和4.9。與滲透汽化分離1.5%丁醇-水溶液相比,滲透通量和分離因子均減小,這是由于發酵液中丁醇質量濃度為7~8 g/L,溶劑質量濃度低,通量降低,丙酮和乙醇與丁醇競爭性通過膜,使得丁醇分離因子減小。另外,菌體細胞、葡萄糖、蛋白胨和牛肉膏的存在,發酵液黏度大于水溶液,同時這些成分會黏附在滲透汽化膜表面,阻礙溶劑組分吸附滲透過程,導致滲透汽化分離性能下降。
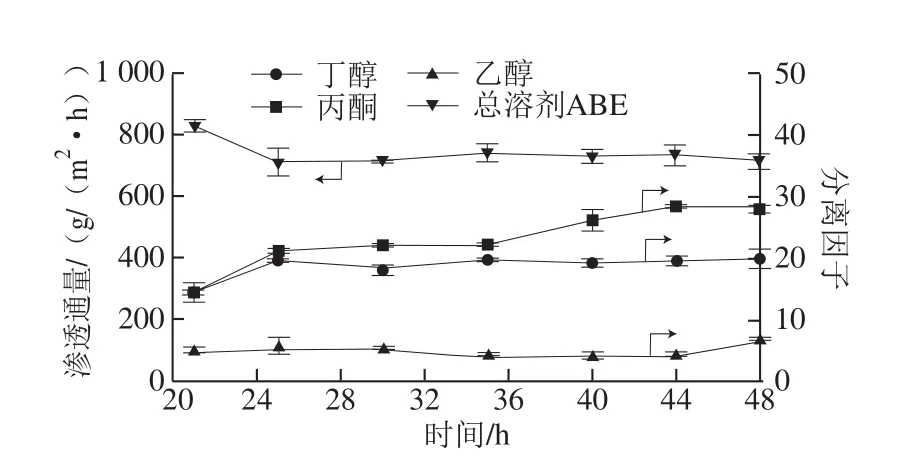
圖5 分批發酵-滲透汽化原位分離耦合過程中膜的分離性能Fig.5 Performance of the composite membrane in batch fermentation integrated with in situ pervaporation
3 結 論
本研究首先篩選出一種PDMS-PVDF復合膜,用于分離1.5%丁醇-水溶液的滲透通量 為1 054.6 g/(m2·h),丁醇分離因子為20.8。將該復合膜應用于滲透汽化原位分離耦合C. beijer inckiiZL01丁醇發酵,可及時移除丁醇等毒性產物,減弱其對菌株的毒害作用,明顯提高總 溶劑ABE產量以及葡萄糖利用率。當葡萄糖初始質量濃度為90 g/L時,滲透汽化耦合分批發酵的 總溶劑ABE產量為24.3 g/L,與分批發酵的17.8 g/L相比,提高了36.5%,葡萄糖利用率 為95.7%,與分批發酵的59.4%相比,提高了61.1%。滲透汽化耦合分批發酵過程的滲透通量平均為705 g/(m2·h),丁醇、丙酮和乙醇分離因子分別平均為19.0、20.4和4.9。經滲透汽化分離,滲透液中總溶劑ABE可濃縮至292 g/L,與分批發酵結束時發酵液中的總溶劑ABE 19.4 g/L相比,是分批發酵的15.1倍,可大大提高進入蒸餾塔時的總溶劑濃度,降低蒸餾能耗。
[1] 陳騊聲, 陸祖祺. 發酵法丙酮和丁醇生產技術[M]. 北京∶ 化學工業出版社, 1999∶ 5-16.
[2] LEE S Y, PARK J H, JANG S H, et al. Fermentative butanol production by Clostridia[J]. Biotechnology and Bioengineering, 2008, 101(2)∶ 209-228.
[3] EZEJI T C, QURESHI N, BLASCHEK H P. Production of acetone, butanol and ethanol by Cl ostridium beijerinckii BA101 and in situ recovery by gas stripping[J]. World Journal of Microbiology & Biotechnology, 2003, 19(6)∶ 595-603.
[4] 金萬勤, 劉公平, 徐南平. 滲透汽化在丙酮-丁醇發酵制備燃料丁醇中的研究進展[J]. 膜科學與技術, 2011, 31(3)∶ 25-31.
[5] 張九花, 蟻細苗, 柳穎, 等. 木質纖維原料制備燃料丁醇的研究進展[J].甘蔗糖業, 2014(4)∶ 38-45.
[6] 華連灘, 王義強, 彭牡丹, 等. 生物發酵產丁醇研究進展[J]. 微生物學通報, 2014, 41(1)∶ 146-155.
[7] 吳又多, 齊高相, 陳麗杰, 等. 可再生原料發酵生產生物丁醇的研究進展 [J]. 現代化工, 2014, 34(2)∶ 44-48.
[8] 王風芹, 程翔, 謝慧, 等 . 滲透汽化技術在生物丁醇生產中的應用進展[J]. 化學與生物工程, 2013, 30(1)∶ 1- 6.
[9] KRAEMER K, HARWARDT A, BRONNEBERG R, et al. Separation of butanol from acetone-butanol-ethanol fermentation by a hybrid extraction-distillation process[J]. Computers & Chemical Engineering, 2011, 35(5)∶ 949-963.
[10] XUE Chuang, ZHAO Jingbo, LIU Fangfang, et al. Two-stage in situ gas stripping for enhanced butanol fermentation and energy-saving product recovery[J]. Bioresource Technology, 2013, 135∶ 396-402.
[11] SETLHAKU M, HEITMANN S, GORAK A, et al. Investigation of gas stripping and pervaporation for improved feasibility of two-stage butanol production process[J]. Bioresource Technology, 2013, 136∶ 102-108.
[12] LIN Xiaoqing, WU Jinglan, JIN Xiaohong, et al. Selective separation of biobutanol from acetone-butanol-ethanol fermentation broth by means of sorption methodology based on a novel macroporous resin[J]. Biotechnology Progress, 2012, 28(4)∶ 962-972.
[13] 蔣波, 張曉東, 許海鵬, 等. 生物丁醇精餾工藝中醪塔的模擬與優化[J].化工進展, 2010(增刊1)∶ 221-225.
[14] HUANG Jicai, MEAGHER M M. Pervaporative recovery of n-butanol from aqueous solutions and ABE fermentation broth using thin-film silicalite-filled silicone composite membranes[J]. Journal of Membrane Science, 2001, 192(1/2)∶ 231-242.
[15] LIU Fangfang, LIU Li, FENG Xianshe. Separation of acetone-butanolethanol (ABE) from dilute aqueous solutions by pervaporation[J]. Separation and Purification Technology, 2005, 42(3)∶ 273-282.
[16] ZHOU Haoli, SU Yi, WAN Yinhua. Phase separation of an acetonebutanol-ethanol (ABE)-water mixture in the permeate during pervaporation of a dilute ABE solution[J]. Separation and Purification Technology, 2014, 132∶ 354-361.
[17] 應超, 陳春燕, 崔海娣, 等. PDMS膜 生物反應器中ABE發酵的實驗研究[J]. 釀酒科技, 2013(3)∶ 28-31.
[18] 陳雄, 吳堅平, 童燦燦, 等. 硅橡膠滲透汽化復合膜在丁醇發酵中的應用[J]. 化學工程, 2011, 39(9)∶ 83-87.
[19] 劉曉潔, 沈兆兵, 張麗麗, 等. 我國生物丁醇分離提取技術研究進展[J].生物技術進展, 2014, 4(5)∶ 325-330.
[20] QURESHI N, MEAGHER M M, HUANG J C, et al. Acetone butanol ethanol (ABE) recovery by pervaporation using silicalitesilicone composite membrane from fed-batch reactor of Clostridium acetobutylicum[J]. Journal of Membrane Science, 2001, 187∶ 93-102.
[21] LI Jing, CHEN Xiangrong, QI Benkun, et al. Efficient production of acetone-butanol-ethanol (ABE) from cassava by a fermentationpervaporation coupled process[J]. Bioresource Technology, 2014, 169∶251-257.
[22] GROOT W J, SCHOUTENS G H, van BEELEN P N, et al. Increase of substrate conversion by pervaporation in the continuous butanol fermentation[J]. Biotechnology Letters, 1984, 6(12)∶ 789-792.
[23] YEN H W, LIN S F, YANG I K. Use of poly(ether-block-amide) in pervaporation coupling with a fermentor to enha nce butanol production in the cultivation of Clostridium acetobutylicum[J]. Journal of Bioscience and Bioengineering, 2012, 113(3)∶ 372-377.
[24] NIEMIST? J, KUJAWSKI W, KEISKI R. Pervaporation perfor mance of composite poly(dimethyl siloxane) membrane for butanol recovery from model solutions[J]. Journal of Membrane Science, 2013, 434∶ 55-64.
[25] van HECKE W, HOFMANN T, de WEVER H. Pervaporative recover y of ABE during continuous cultivation∶ enhancement of performance[J]. Bioresource Technology, 2013, 129∶ 421-429.
[26] 林有勝. 玉米秸稈的酶水解與丁醇發酵研究[D]. 大連∶ 大連理工大學, 2009.
Butanol Fermentation by Clostridium beijerinckii Integrated with in situ Pervaporation
LIU Xiaojie1,2, SHEN Zhaobing1,2, LIU Li1,*, SHI Jiping1,3,*
(1. Shanghai Advanced Research Institute, Chinese Academy of Sciences, Shanghai 201210, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. School of Life Science and Technology, Shanghai Tech University, Shanghai 201210, China)
Butanol fermentation byClostridium beijerinckiiintegrated within situpervaporation using a polydimethylsiloxane-polyvinylidene fluoride (PDMS-PVDF) composite membrane was carried out. The results showed that the original glucose concentration was increased to 90 g/L for butanol fermentation integrated with pervaporation, as compared to that (50 g/L) for the batch fermentation, and the glucose utilization was increased to 95.7%as compared to that (59.4%) for batch fermentation. Meanwhile, butanol concentration was increased from 13.2 to 16.9 g/L, and the total amount of solvents (acetone-butanol-ethanol, ABE) was increased from 17.8 g/L to 24.3 g/L based on the original glucose of 90 g/L. In addition, the average total flux was 705 g/(m2·h) and separation factor of butanol was 19.0 during the butanol separation process. The concentrations of butanol and total solvents were 178 and 292 g/L in the permeates, which were increased by 11.9 and 15.1 folds, respectively, as compared to those for batch fermentation.
butanol; pervaporation;in situseparation;Clostridium beijerinckii; fermentation
Q815
1002-6630(2015)17-0118-06
10.7506/spkx1002-6630-201517023
2015-02-11
國家自然科學基金青年科學基金項目(21306219);上海市科委院市合作項目(10dz1210400);
中國科學院青年創新促進會專項經費項目(2015232);中國科學院上海高等研究院交叉學科青年創新基金項目(141002)
劉曉潔(1991—),女,碩士研究生,研究方向為發酵工程。E-mail:liuxj@sari.ac.cn
*通信作者:劉莉(1982—),女,助理研究員,博士,研究方向為食品生物技術。E-mail:liul@sari.ac.cn
史吉平(1964—),男,研究員,博士,研究方向為生物工程。E-mail:shijp@sari.ac.cn

