新型復方制劑斑曉膠囊對內皮祖細胞刺激活化的影響
王 賢 吳宗貴
在全世界范圍內,隨著人類生活水平的提高,社會老齡化的加劇,以動脈粥樣硬化( atherosclerosis,AS) 為病理基礎的心腦血管疾病逐漸成為危害人類健康的最主要的疾病。AS 及其并發癥的研究在世界各國都作為心腦血管疾病研究中的重點。隨著人們對AS 病因認識的日趨完善,血脂代謝異常、炎性反應、氧化反應等因素逐漸被發現。其中在血管缺血、損傷等病理過程中,內皮祖細胞( endothelial progenitor cells,EPCs) 的動員和補充起著非常重要的作用,并在缺血后血管組織重構過程中發揮著關鍵作用。EPCs 是一類具有較強增殖能力并能定向增殖為血管內皮細胞的前體細胞,具有增殖、黏附、遷移并形成血管結構的特定能力[1]。當前EPCs 在治療方面的應用前景被廣泛接受。EPCs 的體外分離培養來源很多,其中比較成熟的方法就是從骨髓中提取分離后刺激動員細胞增殖[2]。新型復方中藥制劑斑曉膠囊,其中含有瓜蔞、薤白和三七。目前,臨床和實驗研究已經表明,斑曉膠囊可以顯著降低血脂水平,抑制動脈粥樣硬化的進展。本研究采用不同濃度斑曉膠囊萃取液作用于小鼠骨髓源性EPCs,觀察其對細胞增殖及其功能的影響及探討其可能的作用機制,以求為復方斑曉膠囊在AS 中的治療提供實驗依據。
材料與方法
1.實驗動物:由第二軍醫大學基礎部實驗動物中心提供的6 ~8 周齡的C57BL/6 雄鼠,適應性喂養1 周。
2.主要試劑:EGM -2 培養基( Clonetics 公司) ;Flk1 -PE流式抗體( BD Pharmingen 公司) ; CD34 -FITC 流式抗體( BD Pharmingen 公司) ; Bcl -2 抗體( Santa Cruz 公司) Bax( Santa Cruz 公 司) ; CCK8 試 劑 盒( 翊 圣 生 物 公 司) ; Transwell 小 室( Falcon 公司) 。
3.藥品:斑曉膠囊萃取液,由筆者醫院藥劑科提供。
4.小鼠骨髓EPCs 分離培養: 小鼠頸椎脫臼法處死,取下其股骨及脛骨,操作過程注意無菌,同時避免毛發沾染骨髓腔,小心剔除上面的肌肉組織,EGM2 培養基沖洗骨髓腔至骨髓腔發白。骨髓腔沖洗液用Ficoll 分離單核細胞,調整細胞密度為(2 ~3) ×106,平均接種到無菌6 孔板中,2 毫升/皿,置入37℃恒溫CO2細胞培養箱中培養;培養第7 天可見大量單克隆細胞增殖,可進行流式鑒定CD -34 及VEGFR -2 雙抗表型。
5.CCK8( cell counting kit8) 法檢測細胞增殖情況:用上述提取分離EPCs 的方法將細胞懸液平均置于96 孔板中,培養48h 后換液,分別加藥0、20、200μg/ml,分別在加藥培養24、48、72h 后,向每孔加入10μl CCK8 溶劑,注意不要產生氣泡,重新置于37℃,5%CO2孵育箱內4h,酶標儀檢測490nm 處吸光度。
6.流式細胞術鑒定: 細胞培養4 天后分別用斑曉萃取液20μg/ml、200μg/ml 及空白對照分組刺激細胞,培養72h 后;吸凈培養基,0.25%胰酶消化細胞,加入200μl 流式Buffer,加入上述雙標抗體( 另空白對照組準備2 種抗體的單標標本已經空白標本,以作流式調補償用) ,震蕩后避光置于4℃冰箱孵育30min,取出離心1200r/min,去上清加流式Buffer,洗2遍,加300μl 的1%多聚甲醛固定,準備上機檢測。
7.Transewell 法檢測細胞遷移功能變化:用上述提取分離EPCs 的方法提取培養細胞,培養第7 天0.25%胰酶消化細胞,終止消化后離心去培養液,用PBS 洗2 遍,用無血清培養基M199 重懸,調整細胞密度至2 ×105;上室加入100μl 含細胞培養液,下室加入500μl 含藥培養基0、20、200μg/ml; 孵育箱內培育24h;用棉簽擦去基質膠和上室內的細胞,結晶紫染色;鏡下觀察。
8.Western blot 法:檢測EPCs 細胞Bcl-2/Bax 蛋白水平,上述方法提取EPCs 以5 ×105接種于6 孔板中,孵育箱內培養4 天后各組分別加入不同濃度斑曉液,分為3 組( 0、20、200μg/ml) 。第7 天加入含有蛋白酶抑制劑的RIPA 裂解液每孔60μl 于冰上(4℃) 靜置15min 后12000g,4℃離心30min,采用BCA 法檢測蛋白濃度后加入上樣緩沖液,煮沸5 ~10min 變性,10%的分離膠進行SDS-PAGE 電泳,每孔上樣總蛋白約30g 左右,后進行轉膜,5%脫脂奶粉室溫封閉1h,TBS/T( 含0.2%Tween-20 的三羥甲基氨基甲烷緩沖鹽水) 洗膜后加入Bcl-2、Bax 及β-actin 抗體,用5%二氨基聯苯胺(3,3' -diaminobenzidine,BSA) 稀釋(1∶1000 稀釋) ,4℃搖床12h,TBS/T洗膜后二抗室溫孵育1h,(1∶3000 稀釋) ,ECL 化學發光劑倒在PVDF 膜5min 后進行顯影。
9.統計學方法:采用SPSS 13.0 軟件進行統計學分析,實驗數據資料用均數±標準差(±s) 表示,CCK8,流式細胞鑒定,transwell 實驗均采用t 檢驗進行數據分析。以P <0.05 為差異有統計學意義。
結 果
1.不同濃度的斑曉制劑可影響鼠源EPCs 的增殖:CCK8 實驗結果表明,斑曉低劑量組(20μg/ml) 和高劑量組(200μg/ml) 與對照組相比細胞增殖能力明顯增強[P >0.05( 第1 天、第2 天20μg/ml 斑曉組) ,P <0.05 ( 第3 天) ,圖1]。
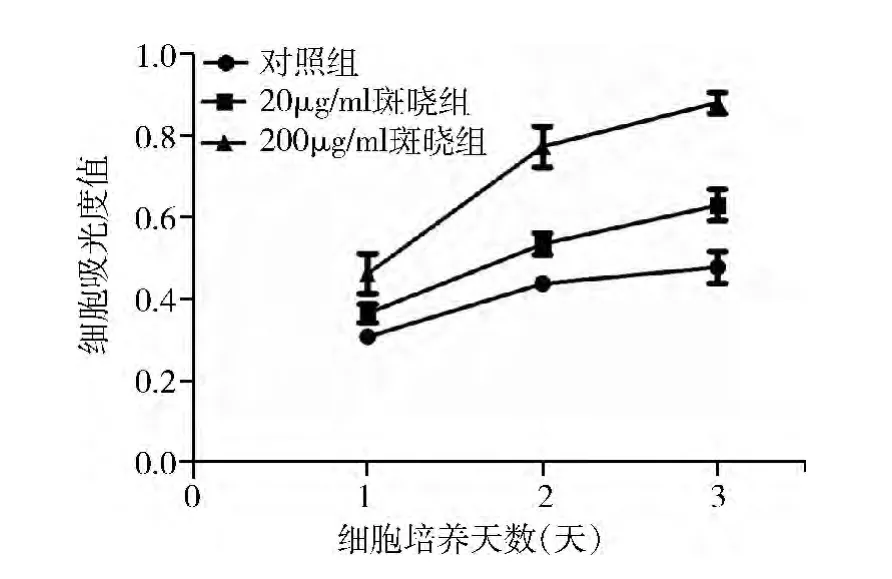
圖1 不同濃度斑曉對EPCs 增殖的影響
2.流式細胞術鑒定CD34/Flk-1 雙陽性細胞:實驗結果表明,斑曉低劑量組(20μg/ml) (4.42% ±1.12%,P <0.05) 和高劑量組( 200μg/ml) ( 13.98%±0. 23%,P <0. 05) 藥物作用72h 后與對照組(2.14% ±0.92%) 相比EPCs 明顯增多( 圖2) 。

圖2 流式細胞術鑒定雙陽性細胞的結果
3. Transwell 實驗檢測EPCs 遷移功能: 結果表明,斑曉低劑量組(20μg/ml) 和高劑量組(200μg/ml)藥物作用24h 后與對照組相比結晶紫染色細胞明顯增加( P <0.05,圖3) 。

圖3 不同濃度斑曉作用于EPCs 后細胞遷移功能明顯變化
4.不同濃度的斑曉可增加EPCs Bcl -2/Bax 比值: Western blot 法實驗結果表明,斑曉低劑量組(20μg/ml) 和高劑量組(200μg/ml) 藥物作用72h 后與對照組相比EPCs 中Bcl -2 蛋白表達水平明顯上升,Bax 蛋白水平下降,Bcl-2/Bax 比值升高( 圖4) 。

圖4 不同濃度斑曉作用于EPCs 48h 后Bcl-2 和Bax 蛋白表達水平
討 論
EPCs 可以存在于體內多種組織中,如骨髓、血液、脂肪組織、血管內膜等[3~5]。研究表明,內皮祖細胞可以由外周血或骨髓中的單個核細胞誘導分化而成,但EPCs 主要起源于骨髓組織中,在其他組織中存在較少[6]。因此,相對來說,骨髓中的EPCs 含量豐富,取材方便,增殖能力更強,較適合作為EPCs 的取材來源。斑曉膠囊中各成分的配伍基礎是漢代名醫張仲景《金匱要略》中瓜蔞薤白白酒湯,近期研究表明其對心肌缺血療效較好[7]。在此著名方劑的基礎上結合現代醫學動脈粥樣硬化治療新進展加入三七。制作工藝上沿襲既往中藥制備的方法。
本研究通過CCK8 實驗發現,同樣在細胞培養第7 天,在藥物作用72h 的情況下,斑曉低劑量和高劑量組與對照組相比可以明顯促進EPCs 的增殖,差異有統計學意義( P <0.05) ,因此把72h 作為時間點進行Transwell 及Western blot 法檢測。EPCs 的表面標記很多,有CD34、VEGFR -2( Flk -1) 、CD45、CD31等多種,鑒定方案多樣,但多選取其中2 ~3 個表面標記作為鑒定依據[8,9]。其中CD34 是未成熟干細胞的表面標志之一,且EPCs 最早是通過CD34 抗體包被的免疫磁珠法從臍帶血中分離獲得,同時公認Flk-1是EPCs 的表面標志之一,故本實驗選擇CD34/Flk -1 雙陽性標記作為流式細胞術鑒定EPCs 的方案[10]。流式鑒定的EPCs 數量與Jiang 等[11]實驗結果相符,但目前尚缺少斑曉制劑對EPCs 的增殖效果的研究,本實驗結果發現斑曉對小鼠骨髓源性EPCs 增殖具有促進作用,其結果與鄺穎頤等[12]所做的三七總皂苷對EPCs 的影響結果相符。Transwell 小室實驗通過多次重復實驗取平均值的方法以降低人工誤差,最終發現,斑曉高、低劑量組與對照組相比可增強EPCs的遷移功能,并呈現明顯的劑量依賴性。本組研究還發現斑曉可提高Bcl-2/Bax 比值,并呈濃度依賴性。推測通過提高Bcl -2/Bax 比值抑制EPCs 凋亡是斑曉刺激EPCs 增殖活化可能的作用機制之一。
目前,斑曉膠囊可以顯著降低血脂水平已在臨床實驗中得到證實,其提出的“痰瘀同治”的治法治則尚缺少有力的西醫實驗研究報道[13]。針對AS 軟斑塊,采用“痰瘀同治”治法治則可快速消退斑塊和使斑塊趨于穩定,其機制可能與改善EPCs 功能修復內皮有關。本研究結果提示,斑曉能夠影響EPCs 的增殖和功能,對EPCs 凋亡過程的抑制作用是其可能的作用機制之一。本組實驗從細胞學機制方面探討了不同濃度斑曉對EPCs 增殖的影響,為今后的臨床應用提供理論依據,其作用的靶點機制尚有待于進一步研究。
1 Churdchomjan W,Kheolamai P,Manochantr S,et al. Comparison of endothelial progenitor cell function in type 2 diabetes with good and poor glycemic control[J].BMC Endoer Dis,2010,10:5
2 吳波,盧正茂,王堯,等.兔骨髓源性血管內皮祖細胞的分離、培養及鑒定[J].中國實驗血液學雜志,2010,18(2) :454 -457
3 Iwaguro H,Yamaguchi J,Kalka C,et al. Endothelial progenitor cell vascular endothelial growth factor gene transfer for vascular regeneration[J]. Circulation,2002,105(6) :732 -738
4 Chan KH,Simpson PJL,Yong AS,et al. The relationship between endothelial progenitor cell populations and epicardial and microvascular coronary disease—A Cellular,Angiographic and Physiologic Study[J].PLoS One,2014,9(4) :e93980
5 Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science,1997,275:964-967
6 Jakosson L,Kreuger J,Holmborn K,et al. Heparan sulfate in trans potentiates VEGFR-mediated angiogenesis[J]. Dev Cell,2006,10(5) : 625 -634
7 周波,陳飛,仲維娜,等. 從NO,NOS 變化探討瓜蔞薤白白酒湯對心肌缺血再灌注損傷的防治作用[J]. 中醫藥學報,2010,38( 3) :36 -39
8 Yang J,Ii M,Kamei N,et al. CD34 cells represent highly functional endothelial progenitor cells in murine bone marrow[J]. PLoS One,2011,6(5) :e20219
9 Friedrich EB,Walenta K,Schadau J,et al. CD 34/CD 1 33/ VEGFR2 endothelial progenitor cell subpopulation with potent vasoregenerative capacities[J].Circ Res,2006,98(3) : e20 -25
10 Fadini GP,Coraeina A,Baesso I,et al. Peripheral blood CD34/KDR endothelial progenitor cells are determinants of subclinical atherosclerosis in a middle aged general population[J]. Stroke,2006,37 ( 9) :2277 -2282
11 Jiang QJ,Ding SF,Wu JX,et al. Norepinephrine stimulates mobilization of endothelial progenitor cells after limb ischemia[J]. PLoS One,2014,9(7) :e101774
12 鄺穎頤,黃經光,彭榮珍,等. 三七總皂苷對血脂異常患者內皮祖細胞數量的影響[J].亞太傳統醫藥,2014,10(16) :90 -91
13 徐堯軍. 痰瘀并治法治療冠心痛心絞痛[J].天津中醫學院學報,1996,3:16

