均相催化O2氧化醇的研究進展(上)
王連月,高 爽
(中國科學院 大連化學物理研究所 潔凈能源國家實驗室,遼寧 大連 116023)
特約述評
均相催化O2氧化醇的研究進展(上)
王連月,高 爽
(中國科學院 大連化學物理研究所 潔凈能源國家實驗室,遼寧 大連 116023)
綜述了以分子氧為氧源的催化氧化醇體系,包括過渡金屬(Cu,Fe,Co,V,Ru,Pd,Au)催化體系、非金屬催化體系(2,2,6,6-四甲基哌啶氮氧自由基)及2,3-二氯-5,6-二氰對苯醌等其他小分子體系。對各催化體系的適用范圍和優缺點進行了分析,闡述了主要催化體系的催化機理,對已有研究成果進行了總結,并在此基礎上對該領域的發展趨勢作了展望。
分子氧;醇;選擇氧化;均相催化
醇選擇性氧化為醛或酮是有機合成中非常重要的官能團轉化反應,無論對基礎研究還是對大規模工業生產都具有十分重要的意義[1]。醛和酮是重要的工業原料、香料及合成藥物中間體,全球每年生產的羰基化合物超過1 Mt,且大多由醇氧化而來[2]。傳統的醇氧化方法是化學計量法,常用氧化劑為鉻試劑(包括Jones試劑、重鉻酸吡啶鎓、氯鉻酸吡啶)[3-7]、錳試劑(氧化錳)[8-9]、釕的氧化物[10-11]、過釕酸四丙胺鹽/N-甲基嗎啉氧化物試劑[12-13]、活化的二甲基亞砜(DMSO)(Swern氧化)[14-15]、高價碘化物(Dess-Martin)[16-17]和Ag2CO3(Fetizon)[18]。但傳統方法存在的缺點是:需要當量甚至過量的氧化劑,反應過程中易產生大量的重金屬污染物;通常在含氯有機溶劑中進行,不僅后處理麻煩,且對環境污染很大;有些強氧化劑難以將反應產物控制在醛的階段,往往使醛進一步深度氧化為酸。從環境保護和原子經濟性的角度來看,上述方法必定會被改進或淘汰,因此開發綠色、高效、高選擇性的醇氧化方法一直是研究熱點。空氣或O2是理想的氧化劑,它們不僅價格便宜,資源豐富,且氧化后的副產物為水。通常情況下O2處于穩定態,O2分子中兩個未成對的單電子一旦被活化,其雙自由基性質會促使形成高反應性及非選擇性的自由基中間體,但中間體的活性往往較高,易發生深度氧化,從而導致產物的選擇性降低。因此,需要開發溫和條件下高選擇性催化O2(空氣)氧化醇體系。
O2與醇難以直接反應,需在催化劑作用下才能有效實現醇的選擇性氧化,故催化劑的選擇很關鍵。目前報道較多的是過渡金屬催化劑和有機分子催化劑。有機分子催化劑主要有兩種:一是穩定的自由基,常用2,2,6,6-四甲基哌啶氮氧自由基(TEMPO);二是N-羥基亞胺,常用N-羥基鄰苯二甲酰亞胺生成的活潑自由基。氮氧自由基可與過渡金屬或非金屬催化劑組成有效的催化體系,能在溫和條件下高選擇性催化醇氧化。
本文主要綜述了以分子氧為氧源的催化氧化醇體系,包括過渡金屬(Cu,Fe,Co,V,Ru,Pd,Au)催化體系、非金屬催化體系(TEMPO)及2,3-二氯-5,6-二氰對苯醌(DDQ)等其他體系。對各催化體系的適用范圍和優缺點進行了分析,闡述了主要催化體系的催化機理,對已有研究成果進行了總結,并在此基礎上對該領域的發展趨勢作了展望。
1 過渡金屬催化體系
1.1 Cu催化體系
早期Cu催化醇氧化反應主要使用的催化劑為單核銅酶(即半乳糖氧化酶)。半乳糖氧化酶可將D-半乳糖和許多伯醇催化氧化為相應的醛,同時將O2還原為H2O2(見式(1))[19]。半乳糖氧化酶的活性中心由一個單獨的Cu(Ⅱ)離子、組氨酸咪唑基的氮、具有硫醚取代基的絡氨酸自由基和一個絡氨酸離子配位組成。半乳糖氧化酶催化氧化伯醇的反應機理見式(2)。
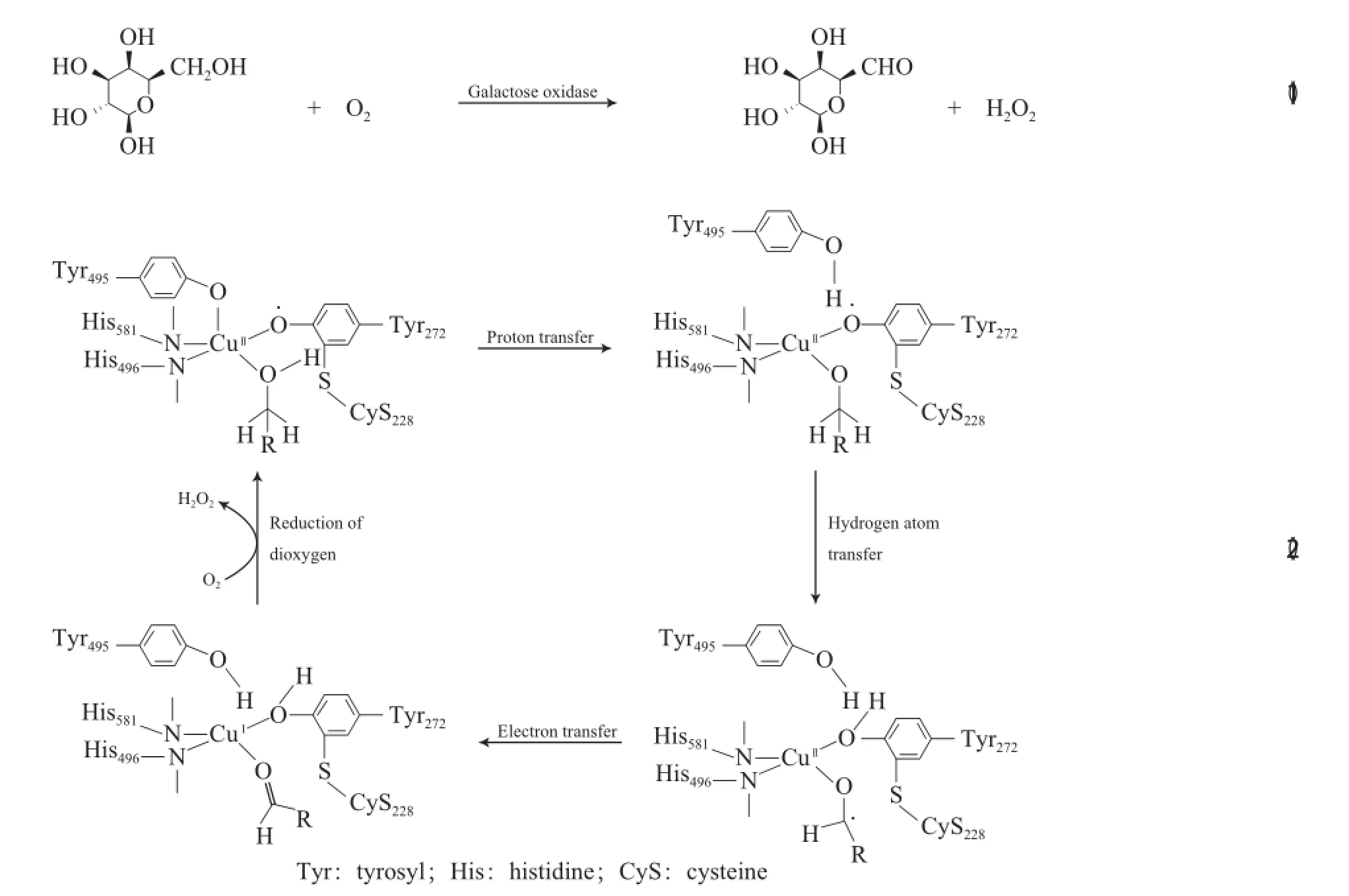
由于對催化反應起關鍵作用的是活性中心部分,因此用小分子銅配合物模擬該酶的反應性引起了許多研究者的興趣,其中,最具代表性的模型化合物是由Stack等合成的[Cu(Ⅱ)BSP](BSP為聯萘正四面配體)配合物[20],[Cu(Ⅱ)BSP]配合物能有效催化O2氧化芐基醇和烯丙醇(見式(3))。
Markó等[21]報道了Cu催化O2氧化醇體系,該體系包含5%(χ)CuCl、5%(χ)1,10-菲啰啉(Phen)、5%(χ)疊氮二羧酸二叔丁酯(DBADH2)、200%(χ)K2CO3、甲苯溶劑(記為CuCl/Phen/DBADH2體系),在空氣或純O2為氧化劑、70~90℃的條件下,CuCl/Phen/DBADH2體系能有效地氧化芐基和烯丙基醇為相應的醛或酮(見式(4)),對含雜原子(N和S)的醇同樣具有很好的氧化效果,但該體系對脂肪醇尤其是脂肪伯醇的反應效果較差。隨后他們用偶氮二甲酸二叔丁酯(DBAD)取代DBADH2[22]得到CuCl/Phen/ DBAD體系,在無氧條件下可有效地氧化各種醇(見式(5)),說明Cu-Phen在體系中起催化作用,當K2CO3用量從200%(χ)降至10%(χ)時,脂肪伯醇的選擇性明顯提高。使用O2為末端氧化劑時,堿的用量較大,為減少堿的用量,通過對無機堿的篩選發現僅K2CO3的效果最好。當CuCl/Phen/DBAD體系中的溶劑改成氟苯時(見式(6))[23],K2CO3的用量可降至25%(χ),該體系可將各種醇(如芐基伯醇、烯丙基伯醇、芐基仲醇、烯丙基仲醇、脂肪仲醇)有效地氧化為相應的醛或酮,但對脂肪伯醇的反應活性仍較低。隨后Markó等在用氟苯為溶劑的CuCl/Phen/DBADH2體系中加入N-甲基咪唑(NMI),有效地實現了脂肪伯醇的氧化且未發現酸的生成(見式(7))[24]。對于用氟苯為溶劑的CuCl/Phen/DBAD體系,在無氧氣和NMI時,脂肪伯醇同樣可定量地轉化為醛,但加入NMI后,反應反而被阻礙。

基于以上研究,Markó等提出了CuCl/Phen/ DBADH2體系催化醇氧化的反應機理(見圖1)。從圖1可看出,首先醇與3種化合物形成活性物種A,通過分子內的氫轉移得到配合物B,接著釋放產物醛并得到配合物C,配合物C迅速被O2捕獲,生成物種D,物種D在加熱下形成氫氧銅物種E,最后通過配體交換和消除水再形成活性物種A。其中,配合物C上有空配位點,盡管配合物C通常能迅速與O2反應,但偶爾會有醇發生競爭配位,形成物種F,物種F經H轉移得到非活性的配合物G。因此,加入NMI后,α位存在空間位阻的醇能被高效地氧化為相應的醛和酮,而對α位無取代基的脂肪伯醇的反應效果較差。
Semmelhack等[25]報道了CuCl/TEMPO(10%(χ)CuCl+10%(χ)TEMPO)體系,該體系在溶劑為二甲基甲酰胺(DMF)、O2鼓泡、室溫的條件下,能有效地氧化活潑伯醇(見式(8)),但對仲醇的氧化速率明顯比伯醇慢。Semmelhack等提出的CuCl/TEMPO 體系催化醇氧化的反應機理見圖2。從圖2可看出,Cu(Ⅱ)通過單電子轉移將TEMPO氧化為氮氧正離子TEMPO+; TEMPO+是氧化醇的真正氧化劑,并生成對應的羰基化合物和TEMPOH;TEMPOH和TEMPO+再迅速反應生成TEMPO;Cu(Ⅰ)在H+的存在下被O2氧化為Cu(Ⅱ),并有水生成,生成的Cu(Ⅱ)重新進入循環。
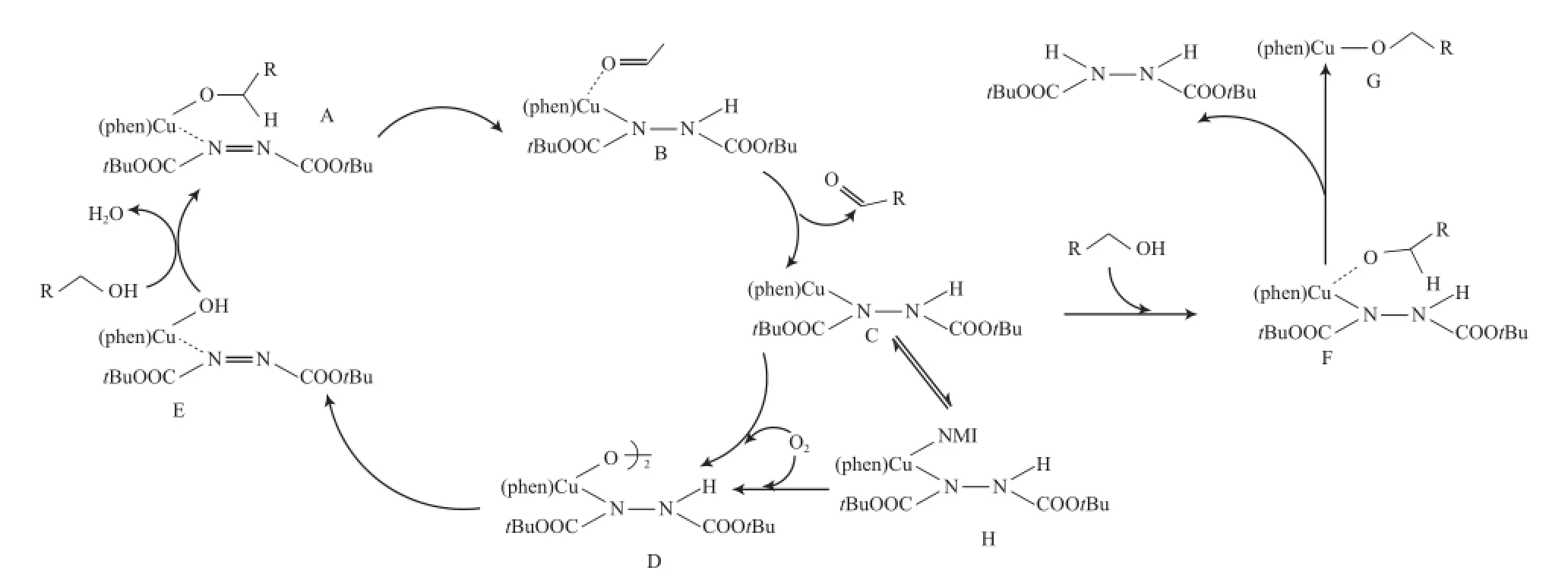
圖1 Markó等提出的CuCl/Phen/DBADH2體系催化醇氧化的機理Fig.1 Mechanism for the aerobic alcohol oxidation catalyzed by CuCl/Phen/DBADH2.

圖2 Semmelhack等提出的CuCl/TEMPO體系催化醇氧化的反應機理[25]Fig.2 Mechanism for the aerobic alcohol oxidation catalyzed by CuCl/TEMPO proposed by Semmelhack[25].
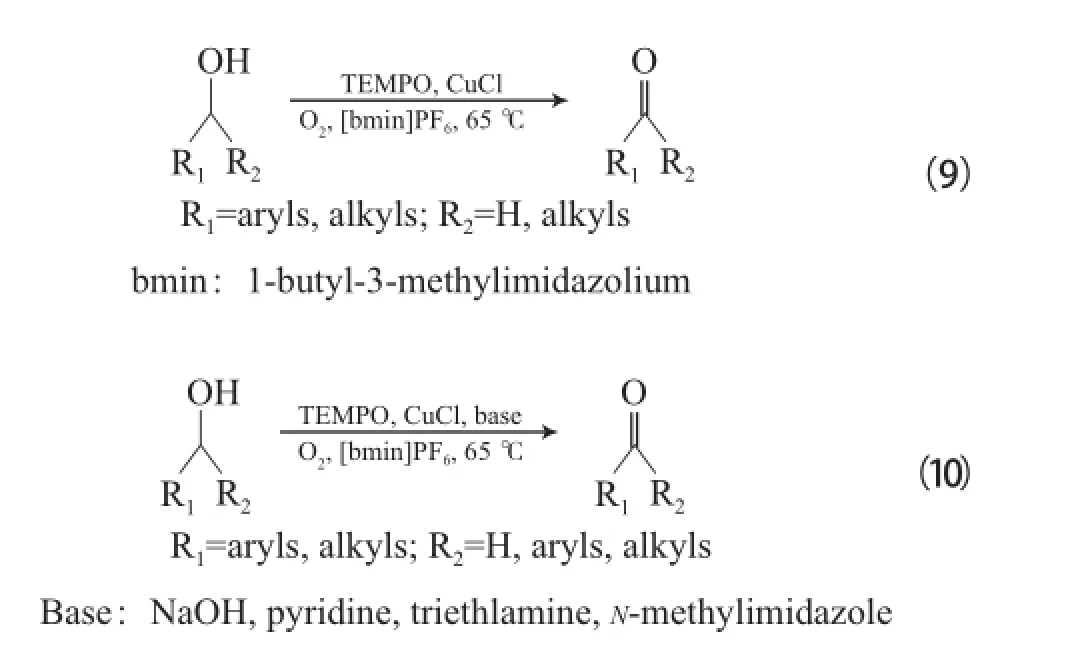
Ansari等[26]采用CuCl/TEMPO體系,以離子液體為溶劑將伯仲醇氧化為相應的醛或酮(見式(9)),離子液體可循環使用,但反應時間較長。
Liu等[27]在以離子液體為溶劑的CuCl/TEMPO體系中加入堿后發現,反應速率明顯得到提高(反應見式(10))。
Dijksman等[28]對CuCl/TEMPO體系催化氧化醇的反應機理研究后認為,反應過程中未發現氮氧正離子TEMPO+的生成。這是因為,TEMPO+作為氧化劑能有效氧化各種醇 ,而該體系對簡單的脂肪醇反應活性較低,而且在該體系的反應條件下,TEMPOH能迅速被O2氧化為TEMPO。因此,他們提出了另外一種反應機理,反應機理見圖3。從圖3可看出,反應機理是以Cu為中心的醇氧化過程:通過單電子轉移,Cu(Ⅰ)被TEMPO氧化為Cu(Ⅱ)-TEMPO物種;接著醇取代TEMPO形成Cu醇鹽和TEMPOH;另一分子的TEMPO與Cu醇鹽配位,通過分子內β-H消除得到產物和TEMPOH;TEMPOH再被O2迅速氧化為TEMPO。
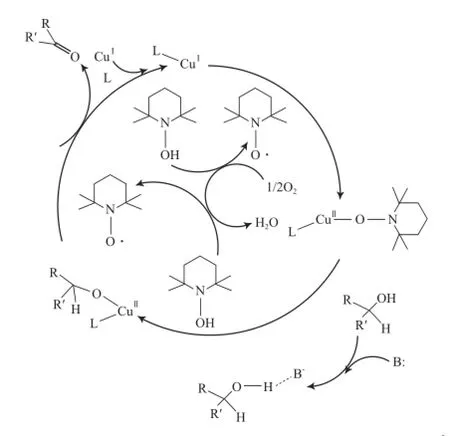
圖3 Sheldon等提出的CuCl/TEMPO體系催化醇氧化的反應機理[28]Fig.3 Sheldon’s mechanism for the aerobic alcohol oxidation catalyzed by CuCl/TEMPO[28].
Gamez等[29]報道了CuBr2(2,2-bpy)/TEMPO/ t-BuOK(bpy為聯吡啶)體系,該體系以乙腈/水為溶劑,室溫下可有效氧化伯醇為相應的醛(見式(11),但對活潑和非 活潑的仲醇均無催化效果。反應機理見圖4。
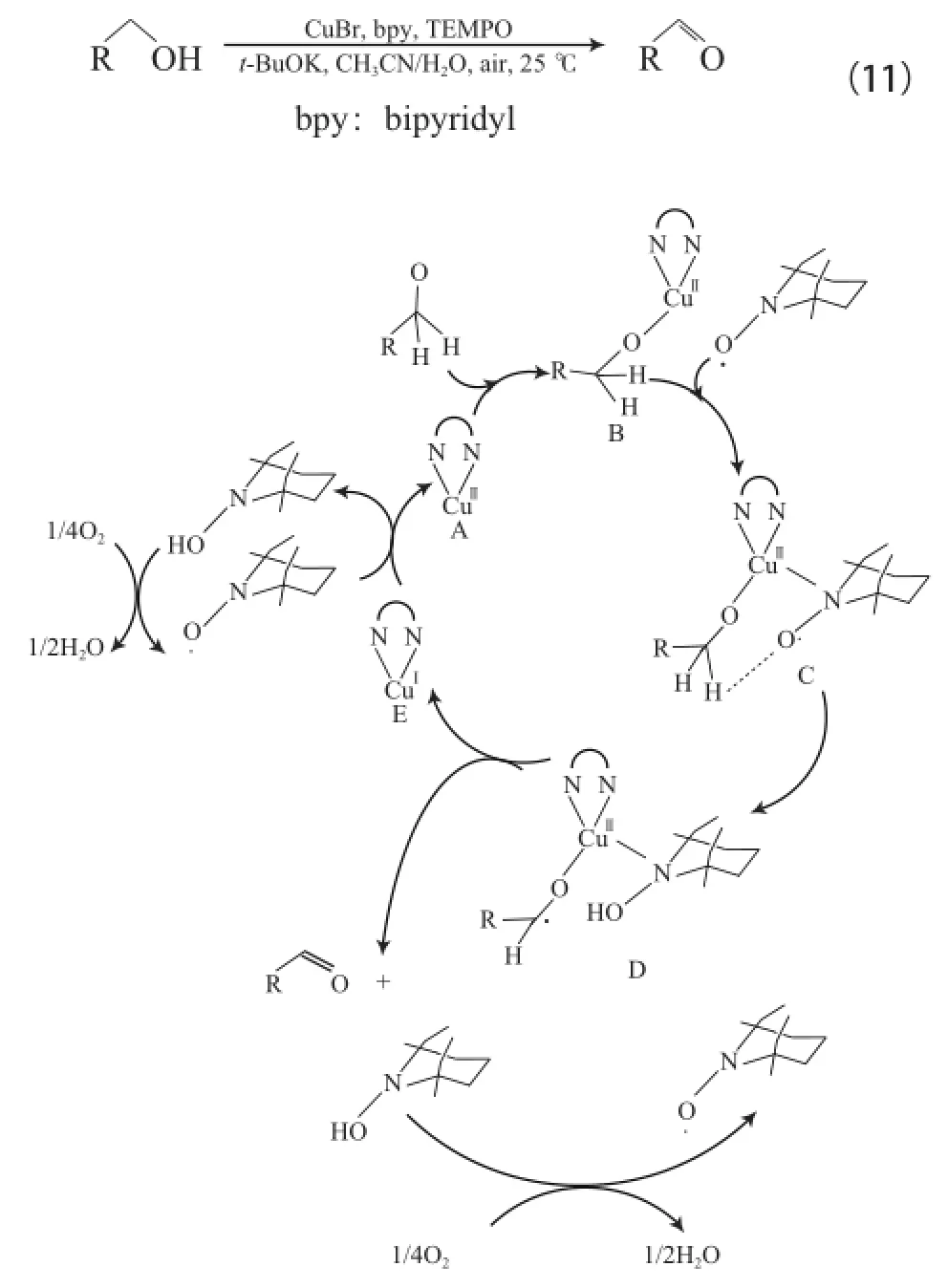
圖4 CuBr2(2,2-bpy)/TEMPO/t-BuOK催化伯醇的氧化機理Fig.4 Proposed mechanism for the oxidation of primary alcohols catalyzed by CuBr2(2,2-bpy)/TEMPO/t-BuOK.
從圖4可看出,TEMPO可能為H的受體。醇鹽與Cu(Ⅱ)配合物A形成烷氧基物種B;TEMPO很有可能與Cu(Ⅱ)離子以η2的方式螯合形成物種C,然后通過β-H轉移到TEMPO得到自由基物種D;再通過分子內單電子轉移得到產物醛、TEMPOH和Cu(Ⅰ)物種E;通過TEMPO的調節,物種E再被氧化為配合物A,TEMPOH則被O2氧化為TEMPO,完成催化循環。仲醇不能被氧化可能是因為甲基空間位阻的存在不利于物種C的形成,伯醇能有效地被氧化還可能是因為另一個β-H穩定了自由基物種D。
Jiang等[30]報道了Cu(ClO4)2/4-二甲氨基吡啶(DMAP)/acetamido-TEMPO三組分體系,在以離子液體[bmpy]PF6為溶劑、室溫、0.1 MPa O2的條件下,可有效地氧化活潑伯醇為醛(見式(12)),且循環5次使用后,反應活性無明顯降低。該體系的反應機理與CuBr2(2,2-bpy)/TEMPO/t-BuOK體系類似,由于存在空間位阻,該體系對仲醇的反應活性低。

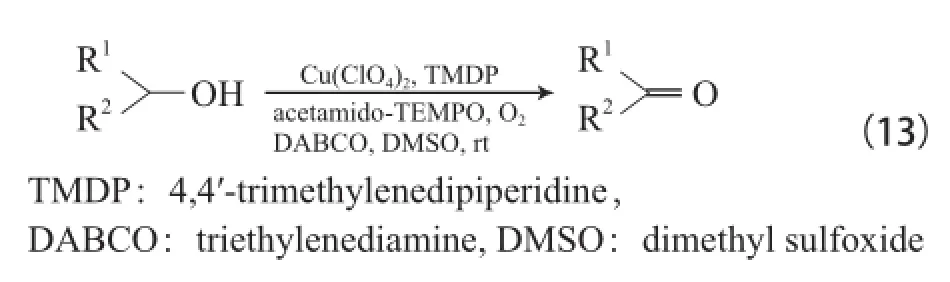
Jiang等[31]還報道了Cu(ClO4)2/4,4-丙基哌啶基哌啶/乙酰胺基-TEMPO/三乙烯二胺(DABCO)四組分體系,在DMSO為溶劑和室溫下能有效氧化各種醇為相應的醛或酮(見式(13)),由于使用強極性DMSO溶劑,該體系可循環使用3次且反應活性無明顯降低。DBACO在該體系中可能有兩個作用:一是作為堿奪取醇羥基上的質子;二是作為弱的含N配體與Cu2+離子配位。該體系與Cu(ClO4)2/DMAP/乙酰胺基-TEMPO和CuBr2(2,2-bpy)/TEMPO/ t-BuOK體系相比,由于加入了DABCO,延長反應時間能有效地氧化仲醇為相應的酮。
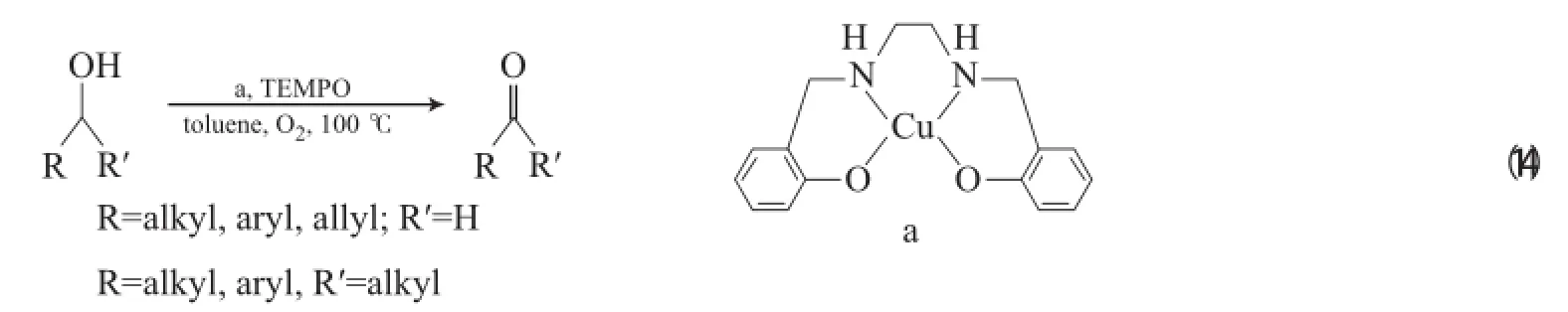
Velusamy等[32]報道了Cu-salen/TEMPO體系,在以甲苯為溶劑、0.1 MPa O2和100℃的條件下,有效地氧化伯醇為相應的醛(見式(14))。由于采用非極性甲苯為溶劑,該體系循環3次后反應活性無明顯降低。其反應機理與CuBr2(2,2-bpy)/TEMPO/t-BuOK體系一樣,對仲醇無反應活性,也可能是因為存在空間位阻。
Kumpulainen等[33]研究Cu-TEMPO體系時發現,加入有機堿1,8-二氮雜二環十一碳-7-烯(DBU)和NMI能顯著提高催化效率,乙腈為溶劑時反應效果最好(見式(15))。Cu-TEMPO-DBU-NMI體系對TEMPO是一級反應,對Cu鹽是二級反應,能高效氧化脂肪伯醇,但對仲醇的氧化性能較低。

Hoover等[34]研究發現,Cu-TEMPO體系在以NMI為堿、乙腈為溶劑時,Cu+鹽的催化效果明顯優于Cu2+鹽,在室溫和空氣氛圍下,能高效高選擇性氧化各種伯醇(包括烯丙基、芐基、脂肪醇)為相應的醛(見式(16)),還能氧化帶其他官能團的醇,特別對二元醇,不需保護即能高選擇性氧化伯醇。

Hoover等[35-36]對(bpy)CuI(OTf)/TEMPO體系的反應機理進行了研究,反應機理見圖5。從圖5可看出,活潑醇和非活潑醇具有不同的決速步驟。活潑醇氧化時,催化劑的氧化過程是決速步驟,催化劑氧化經過雙核Cu2O2中間體;非活潑伯醇氧化時,底物氧化和催化劑氧化影響反應速率。由于脂肪醇的解離常數較大,不容易形成Cu-烷氧化合 物,而且具有強α C—H鍵,均明顯影響產物的形成。O2首先與一個Cu+反應生成Cu2+超氧化物,接著在另一個Cu+中心上形成過氧化物橋聯的雙核銅Cu2O2,Cu2O2被認為能夠氧化TEMPOH為TEMPO,通過H轉移形成CuⅡ—OOH物種和CuⅠ副產物。接著,CuⅡ—OOH與H2O反應得到CuⅡ—OH并釋放H2O2,在一定的反應條件下,H2O2迅速分解為H2O和O2。通過底物與CuⅡ形成Cu-烷氧化合物和TEMPO奪H實現底物氧化。

圖5 CuI/TEMPO催化醇氧化循環過程Fig.5 Catalytic cycle for the aerobic oxidation of alcohols catalyzed by CuI/TEMPO.
Cu-TEMPO體系對仲醇氧化的效果較差,這是因為:仲醇本身空間位阻大,而且在最后一步Cu-烷氧化合物和TEMPO共同與底物作用時,TEMPO的空間位阻較大。為實現仲醇氧化,Steves等[37]將TEMPO換成空間位阻小的氮氧自由基9-氮雜雙環[3.3.1]壬烷-N-氧自由基(ABNO),催化體系5%(χ)Cu(MeCN)4OTf、5%(χ)4,4’-DMeO-2,2’-bpy(DMeO為二甲氧基)、10%(χ)NMI和1%(χ)ABNO組成,可有效氧化各種類型的仲醇,對伯醇也有非常好的氧化效果(見式(17))。

Cu-TEMPO體系多使用聯吡啶類配體,Zhang等[38]研究發現,以L-脯氨酸為配體時,Cu-TEMPO體系也能實現活潑伯仲醇的氧化。催化體系由5%(χ)CuI、5%(χ)L-脯氨酸、5%(χ)TEMPO、100%(χ)tBuOK組成,在DMF為溶劑、室溫和空氣氛圍的條件下,能將仲醇氧化為相應的酮。催化體系由5%(χ)CuBr、5%(χ)L-脯氨酸、5%(χ)TEMPO和100%(χ)Na2CO3組成,在甲醇為溶劑、室溫和空氣氛圍的條件下,能將伯醇氧化為相應的醛。
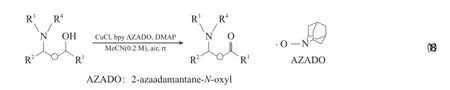
Sasano等[39]采用Cu/2-氮雜金剛烷-N-氧自由基(AZADO)體系有效實現了非保護胺基醇的氧化(見式(18)),進一步證明了空間位阻小的氮氧自由基氧化效果優于TEMPO。當AZADO的用量(χ)為1%~5%時,即可有效氧化伯仲胺基醇。與傳統體系相比,Cu/AZADO催化體系的效果更好,醇的O—H酸性比胺的N—H酸性強,有利于與Cu形成Cu-烷氧物種,進一步實現H原子轉移到氮氧自由基上。
Cu-TEMPO體系多在乙腈或其他有機溶劑中進行,Zhang等[40]研究發現,當溶劑為水時,CuCl/DMAP/TEMPO(或ABNO)體系能在空氣氛圍和室溫條件下實現各種活潑伯仲醇的氧化(見式(19))。
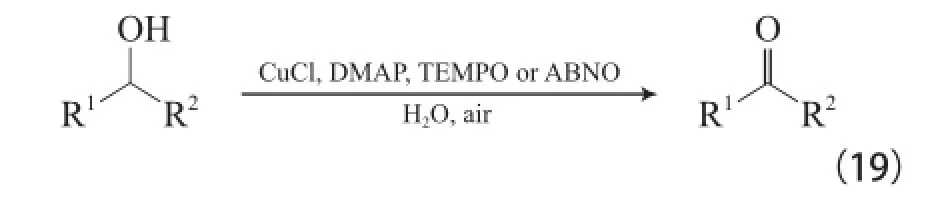
Cu-TEMPO體系的催化活性非常高,尤其對于非活潑醇的氧化,但TEMPO或其他氮氧自由基(如ABNO和AZADO)的價格昂貴、制備復雜。Xu等[41]模擬酪氨酸酶開發了無TEMPO的Cu-N,N-雙(叔丁基)乙烯二胺(DBED)/DMAP體系,該體系能在室溫下實現非活潑脂肪伯醇高選擇性的氧化為醛(見式(20))。兩種體系的底物選擇性不同,當伯仲醇同時存在時,Cu-DBED體系優先氧化活潑仲醇,而Cu-TEMPO體系優先氧化伯醇,說明Cu-DBED體系受底物空間位阻的影響小。
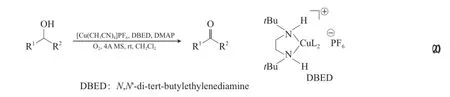
1.2 Fe催化體系
盡管Fe具有很好的氧化還原性,但Fe參與的醇氧化體系較少,主要是Fe/TEMPO體系。不同于Cu/TEMPO體系,Fe/TEMPO體系通常不需加入任何額外的堿或有機配體,即使在1,2-二氯乙烷溶劑中,也能取得很好的催化效果,而Cu/TEMPO體系通常在乙腈溶劑中進行反應。Fe/TEMPO體系可有效催化各種醇,包括含雙鍵、三鍵及雜原子的醇。對于Fe/TEMPO體系催化醇氧化機理的研究很少。鐵鹽催化劑主要是Fe(NO3)3(或添加NaNO2),催化過程中產生的NOx起重要的作用:NO2能氧化TEMPO為TEMPO+,因此體系中需加入硝酸鹽為添加劑;NO2也能協助Fe2+氧化為Fe3+。Fe/TEMPO體系還能順利氧化仲醇,這是因為:該體系生成了TEMPO+氧化劑,且體系中不加額外配體,相對Cu/TEMPO體系的空間位阻小。
Martin等[42]首先報道了Fe催化的醇氧化體系,該體系采 用Fe(NO3)3和FeBr3為催化劑、在乙腈為溶劑、空氣氛圍和室溫條件下能有效地氧化脂肪仲醇和芐基伯醇為相應的酮或醛 (見式(21))。該體系對脂肪伯醇無反應活性,但可選擇性氧化仲醇。

Wang等[43]報道了FeCl3?6H2O/TEMPO/NaNO2體系。該體系在室溫和空氣氛圍下可氧化各種醇為相應的醛或酮,產物選擇性大于99%(見式(22)),在硫醚存在下能選擇性氧化醇,反應機理見圖6。從圖6可看出,FeⅢ-TEMPO為氧化醇的活性物種,可轉化為FeII-TEMPOH,NaNO2分解的NO2再將FeII-TEMPOH氧化為FeⅢ-TEMPO并還原為NO,NO又能迅速被O2氧化為NO2,從而完成催化循環。
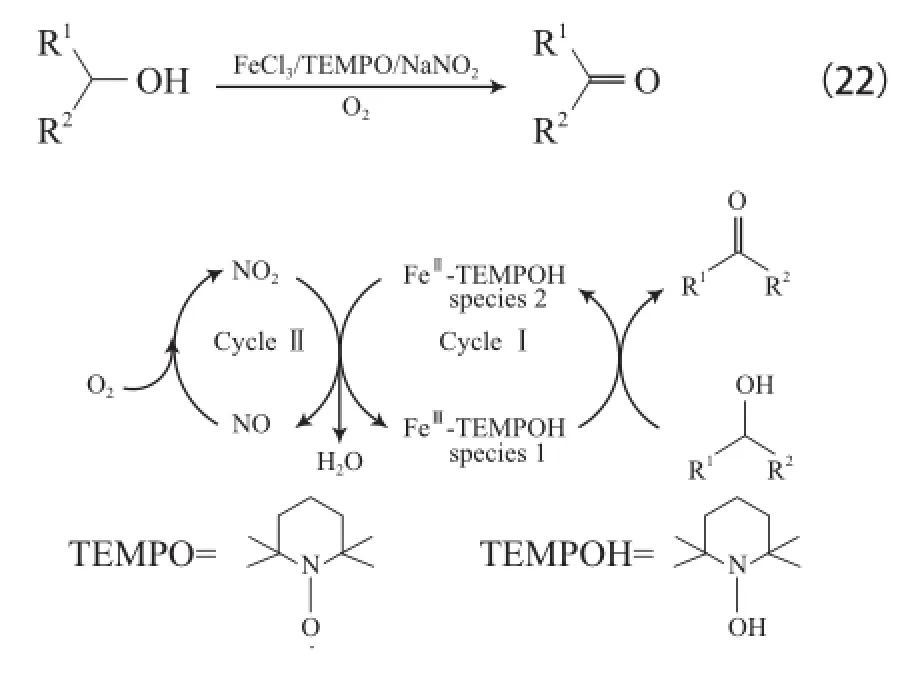
圖6 FeCl3?6H2O/TEMPO/NaNO2體系催化醇氧化的機理Fig.6 Proposed mechanism for the aerobic alcohol oxidation catalyzed by FeCl3?6H2O/TEMPO/NaNO2.
Wang等[44]還報道了Fe(NO3)3/4-OH-TEMPO體系,即用價格便宜的4-OH-TEMPO取代了價格昂貴的TEMPO。該體系在乙腈為溶劑、室溫、空氣條件下可氧化各種醇為相應的醛或酮(見式(23))。該體系的反應機理與FeCl3?6H2O/ TEMPO/NaNO2體系相似,是NO2的來源。

由于FeCl3?6H2O/TEMPO/NaNO2體系對脂肪伯醇的氧化效果較差,Yin等[45]對體系進行改進得到FeCl3/4-acetamido-TEMPO/NaNO2體系,4-acetamido-TEMPO的用量可降至0.1%(x),該體系可氧化各種伯醇(包括脂肪伯醇)為相應的醛(見式(24))。

Miao等[46]研究發現,具有磁性的離子液體[Imim-TEMPO][FeCl4](Imim為咪唑鹽)加入5%(χ)NaNO2和H2O,在0.2 MPa O2和 30~100℃的條件下,可將芐基醇氧化為相應的醛或酮(見式(25)),該體系對含雜原子(N,O,S)的芳香醇同樣具有很好的氧化效果。但該體系不能氧化脂肪醇,故該體系的反應機理不同于FeCl3?6H2O/ TEMPO/NaNO2體系。EPR表征結果顯示,該體系在反應過程中原位產生了自由基物種。ESI-MS表征結果顯示,反應過程中Fe的價態發生了變化,經歷了由[Imim-TEMPO][FeCl4]和NaNO2電子傳遞的過程。
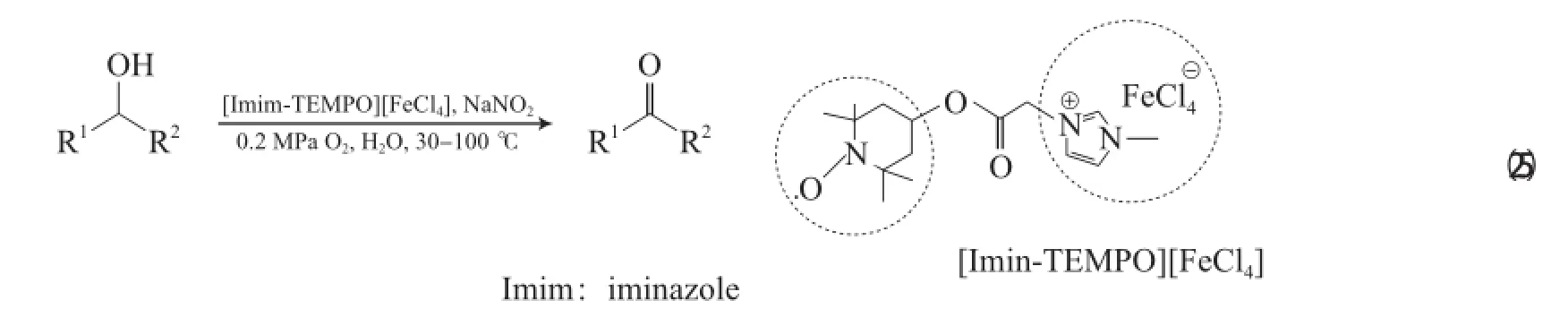
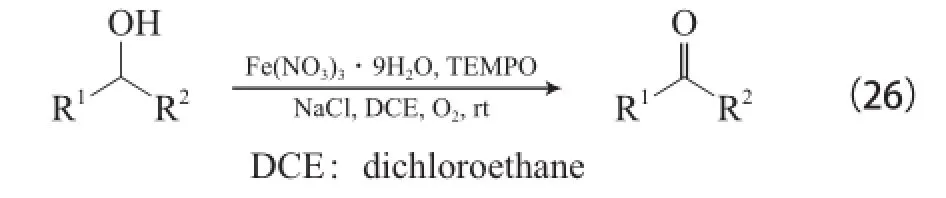
Ma等[47-49]報道了Fe(NO3)3?9H2O/TEMPO/ NaCl體系,該體系以二氯乙烷為溶劑,在O2和室溫的條件下能氧化脂肪伯仲醇、芐基伯仲醇和烯丙基醇為相應的醛或酮(見式(26)),該體系還可用于炔丙基醇和聯烯醇的氧化,反應效果較好。
本課題組[50]首次報道了不加Fe(NO3)3或NaNO2,而加入SiO2的FeCl3?6H2O/TEMPO體系。該體系能催化O2(或空氣)將醇選擇性氧化為相應的醛或酮(見式27)。研究結果表明,SiO2不但可加快反應速率,還可提高產物選擇性。這可能是因為,底物和催化劑吸附在Si—OH表面形成了特殊反應區域。采用Uv-vis光譜法研究了該體系的反應過程,表征結果顯示,FeⅢ-TEMPO配合物可能是反應的活性中間體。催化體系由8%(χ)FeCl3?6H2O、2%~5%(χ)TEMPO、0.2 g SiO2組成,在0.5 MPa O2和80℃的條件下,產物的最高收率為99%。在優化的條件下,含雙鍵的肉桂醇的反應轉化率大于99%,肉桂醛收率80%。對于脂肪仲醇,增加FeCl3?6H2O和TEMPO的用量,產物酮的收率可達67%~90%。利用空氣代替純O2時,在相同的催化劑用量和反應溫度下,延長反應時間也可得到很好的反應效果,產物的最高收率能達到95%。

但該體系不能氧化脂肪伯醇。隨后,本課題組[51]通過化學方法用烷基化試劑對SBA-15分子篩進行修飾,然后通過化學反應把TEMPO鍵合到SBA-15分子篩上得到SBA-15-TEMPO。將SBA-15-TEMPO結合FeCl3?6H2O及助催化劑NaNO2組成了三組分體系用于催化O2氧化醇反應。當SBA-15-TEMPO用量(χ)為0.1%~1%時,能有效地氧化脂肪仲醇和芳香伯仲醇為相應的醛和酮。含N雜原子的醇也能被氧化為相應的醛。但對脂肪伯醇和環己醇的催化效果較差。如采用空氣代替純O2時,在相同的催化劑用量和反應溫度下,延長反應時間也可得到很好的反應效果。氧化苯甲醇時,SBA-15-TEMPO用量降至0.01%(χ)時反應仍可完成,轉化率大于99%,苯甲醛收率為97.7%。SBA-15-TEMPO可循環使用13次,反應活性略降低。由于FeCl3?6H2O在甲苯中不溶解,SBA-15-TEMPO和FeCl3?6H2O兩組分同時循環使用,循環4次,反應活性無明顯降低。
[1]Hudlicky M.Oxidations in Organic Chemistry[M].Washington DC:American Chemical Society,1990:35-76.
[2]Zhan Bizeng,Thompson A.Recent Developments in the Aerobic Oxidation of Alcohols[J].Tetrahedron,2004,60(13):2917-2935.
[3]Holum J R.Study of the Chromium(Ⅵ) Oxide-Pyridine Complex[J].J Org Chem,1961,26:4814-4816.
[4]Lee D G,Spitzer U A.Aqueous Dichromate Oxidation of Primary Alcohols[J].J Org Chem,1970,35(10):3589-3590.
[5]Cainelli G,Cardillo G.Chromium Oxidants in Organic Chemistry[M].Berlin:Springer,1984.
[6]Ley S V,Madin A.Comprehensive Organic Synthesis[M]// Trost B M,Fleming I,Ley S V,Eds.Pergamon:Oxford,1991,7:251-289.
[7]Corey E J,Suggs J W.Pyridinium Chlorochromate:Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds[J].Tetrahedron Lett,1975(31):2647-2650.
[8]Regen S L,Koteel C.Activation Through Impregnation:Permanganate-Coated Solid Supports[J].J Am Chem Soc,1977,99(11):3837-3838.
[9]Menger F M,Lee C.Synthetically Useful Oxidations at Solid Sodium Permanganate Surfaces[J].Tetrahedron Lett,1981,22(18):1655-1656.
[10]Berkowitz L M,Rylander P N.Use of Ruthenium Tetroxide as a Multi-Purpose Oxidant[J].J Am Chem Soc,1958,80:6682-6684.
[11]Griffith W P.Ruthenium Oxo Complexes as Organic Oxidants[J].Chem Soc Rev,1992,21(3):179-185.
[12]Griffith W P,Ley S V,Whitcombe G P,et al.Preparation and Use of Tetrabutylammonium Perruthenate (TBAP Reagent) and Tetrapropylammonium Perruthenate (TPAP Reagent) as New Catalytic Oxidants for Alcohols[J].J Chem Soc,Chem Commun,1987(21):1625-1627.
[13]Ley S V,Norman J,Griffith W P,et al.Tetrapropylammonium Perruthenate,Pr4N+RuO4-TPAP:A Catalytic Oxidant for Organic Synthesis[J].Synthesis,1994(7):639-666.
[14]Albright J D,Goldman L.Dimethyl Sulfoxide-Acid Anhydride Mixtures.New Reagents for Oxidation of Alcohols[J].J Am Chem Soc,1965,87(18):4214-4216.
[15]Pfitzner K E,Moffatt J G.Sulfoxide-Carbodiimide Reactions:Ⅰ.A Facile Oxidation of Alcohols[J].J Am Chem Soc,1965,87(24):5661-5670.
[16]Dess D B,Martin J C.Readily Accessible 12-I-5 Oxidant for the Conversion of Primary and Secondary Alcohols to Aldehydes and Ketones[J].J Org Chem,1983,48(22):4155-4156.
[17]Dohi T.Development of Environmentally Benign Oxidations Using Hypervalent Iodine (Ⅲ) Reagents[J].Yakugaku zasshi:J Pharm Soc Jpn,2006,126(9):757-766.
[18]Li Tsung Tee,Wu Yulin,Walsgrove T C.A Facile Total Synthesis of Racemic Aklavinonet[J].Tetrahedron,1984,40(22):4701-4710.
[19]Whittaker J W.Metal Ions in Biological Systems[M]//Sigel H,Sigel A,Eds.New York:Marcel Dekker,1994:315-360.
[20]Wang Yadong,DuBois J L,Hedman B,et al.Catalytic Galactose Oxidase Models:Biomimetic Cu(Ⅱ)-Phenoxyl-Radical Reactivity[J].Science,1998,279(5350):537-540.
[21]Markó I E,Giles P R,Tsukazaki M,et al.Copper-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones:An Efficient Aerobic Alternative[J].Science,1996,274(5295):2044-2046.
[22]Markó I E,Tsukazaki M,Giles P R,et al.Anaerobic Copper-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones[J].Angew Chem Int Ed,1997,36(20):2208-2210.
[23]Markó I E,Gautier A,Chelle-Regnaut I,et al.Efficient and Practical Catalytic Oxidation of Alcohols Using Molecular Oxygen[J].J Org Chem,1998,63(22):7576-7577.
[24]Markó I E,Gautier A,Dumeunier R,et al.Efficient,Copper-Catalyzed,Aerobic Oxidation of Primary Alcohols[J].Angew Chem Int Ed,2004,43(12):1588-1591.
[25]Semmelhack M F,Schmid C R,Cortes D A,et al.Oxidation of Alcohols to Aldehydes with Oxygen and Cupric Ion,Mediated by Nitrosonium Ion[J].J Am Chem Soc,1984,106(11):3374-3376.
[26]Ansari I A,Gree R.TEMPO-Catalyzed Aerobic Oxidation of Alcohols to Aldehydes and Ketones in Ionic Liquid[bmim][PF6][J].Org Lett,2002,4(9):1507-1509.
[27]Liu Lin,Ji Liuyan,Wei Yunyang.Based-Promoted Aerobic Oxidation of Alcohols to Corresponding Aldehydes or Ketones Catalyzed by CuCl/TEMPO[J].Catal Commun,2008,9(6):1379-1382.
[28]Dijksman A,Arends I W C E,Sheldon R A.Cu(Ⅱ)-Nitroxyl Radicals as Catalytic Galactose Oxidase Mimics[J].Org Biomol Chem,2003,1(18):3232-3237.
[29]Gamez P,Arends I W C E,Reedijk J,et al.Copper(Ⅱ)-Catalysed Aerobic Oxidation of Primary Alcohols to Aldehydes[J].Chem Commun,2003(19):2414-2415.
[30]Jiang Nan,Ragauskas A J.Copper (Ⅱ)-Catalyzed Aerobic Oxidation of Primary Alcohols to Aldehydes in Ionic Liquid[bmpy]PF6[J].Org Lett,2005,7(17):3689-3692.
[31]Jiang Nan,Ragauskas A J.Cu (Ⅱ)-Catalyzed Selective Aerobic Oxidation of Alcohols Under Mild Conditions[J].J Org Chem,2006,71(18):7087-7090.
[32]Velusamy S,Srinivasan A,Punniyamurthy T.Copper (Ⅱ)Catalyzed Selective Oxidation of Primary Alcohols to Aldehydes with Atmospheric Oxygen[J].Tetrahedron Lett,2006,47(6):923-926.
[33]Kumpulainen E T T,Koskinen A M P.Catalytic Activity Dependency on Catalyst Components in Aerobic Copper-TEMPO Oxidation[J].Chem Eur J,2009,15(41):10901-10911.
[34]Hoover J M,Stahl S S.Highly Practical Copper (Ⅰ)/TEMPO Catalyst System for Chemoselective Aerobic Oxidation of Primary Alcohols[J].J Am Chem Soc,2011,133(42):16901-16910.
[35]Hoover J M,Ryland B L,Stahl S S.Mechanism of Copper(Ⅰ)/TEMPO-Catalyzed Aerobic Alcohol Oxidation[J].J Am Chem Soc,2013,135(6):2357-2367.
[36]Hoover J M,Ryland B L,Stahl S S.Copper/TEMPO-Catalyzed Aerobic Alcohol Oxidation:Mechanistic Assessment of Different Catalyst Systems[J].ACS Catal,2013,3(11):2599-2605.
[37]Steves J E,Stahl S S.Copper(Ⅰ)/ABNO-Catalyzed Aerobic Alcohol Oxidation:Alleviating Steric and Electronic Constraints of Cu/TEMPO Catalyst Systems[J].J Am Chem Soc,2013,135(42):15742-15745.
[38]Zhang Guofu,Han Xingwang,Luan Yuxin,et al.L-Proline:An Efficient N,O-Bidentate Ligand for Copper-Catalyzed Aerobic Oxidation of Primary and Secondary Benzylic Alcohols at Room Temperature[J].Chem Commun,2013,49(72):7908-7910
[39]Sasano Y,Nagasawa S,Yamazaki M,et al.Highly Chemoselective Aerobic Oxidation of Amino Alcohols into Amino Carbonyl Compounds[J].Angew Chem Int Ed,2014,53(12):3236-3240.
[40]Zhang Guoqi,Yang Chengxiong,Liu E,et al.Mild,Green Copper/4-Dimethylaminopyridine Catalysed Aerobic Oxidation of Alcohols Mediated by Nitroxyl Radicals in Water[J].RSC Adv,2014,4(106):61907-61911.
[41]Xu Boran,Lumb J P,Arndtsen B A.A TEMPO-Free Copper-Catalyzed Aerobic Oxidation of Alcohols[J].Angew Chem Int Ed,2015,56(14):4208-4211.
[42]Martin S E,Suarez D E.Catalytic aerobic oxidation of Alcohols by Fe(NO3)3-FeBr3[J].Tetrahedron Lett,2002,43(25):4475-4479.
[43]Wang Naiwei,Liu Renhua,Chen Jiping,et al.NaNO2-Activated,Iron-TEMPO Catalyst System for Aerobic Alcohol Oxidation Under Mild Conditions[J].Chem Commun,2005(42):5322-5324.
[44]Wang Xinliang,Liang Xinmiao.Aerobic Oxidation of Alcohols to Carbonyl Compounds Catalyzed by Fe(NO3)3/4-OH-TEMPO Under Mild Conditions[J].催化學報,2008,29(9):935-939.
[45]Yin Weili,Chu Changhu,Lu Qiongqiong,et al.Iron Chloride/4-Acetamido-TEMPO/Sodium Nitrite-Catalyzed Aerobic Oxidation of Primary Alcohols to the Aldehydes[J].Adv Synth Catal,2010,352(1):113-118.
[46]Miao Chenxia,Wang Jinquan,Yu Bing,et al.Synthesis of Bimagnetic Ionic Liquid and Application for Selective Aerobic Oxidation of Aromatic Alcohols Under Mild Conditions[J].Chem Commun,2011,47(9):2697-2699.
[47]Ma Shengming,Liu Jinxian,Li Suhua,et al.Development of a General and Practical Iron Nitrate/TEMPO Catalyzed Aerobic Oxidation of Alcohols to Aldehydes/Ketones:Catalysis with Table Salt[J].Adv Synth Catal,2011,353(6):1005-1017.
[48]Liu Jinxian,Ma Shengming.Iron-Catalyzed Aerobic Oxidation of Allylic Alcohols:The Issue of C-C Bond Isomerization[J].Org Lett,2013,15(20):5150-5153.
[49]Liu Jinxian,Ma Shengming.Aerobic Oxidation of Indole Carbinols Using Fe(NO3)3?9H2O/TEMPO/NaCl as Catalysts[J].Org Biomol Chem,2013,11(25):4186-4193.
[50]Wang Lianyue,Li Jun,Lü Ying,et al.Selective Aerobic Oxidation of Alcohols Catalyzed by Iron Chloride Hexahydrate/ TEMPO in the Presence of Silica Gel[J].Appl Organomet Chem,2012,26(1):37-43.
[51]Wang Lianyue,Li Jun,Zhao Xiaoping,et al.An Efficient and Scalable Room Temperature Aerobic Alcohol Oxidation Catalyzed by Iron Chloride Hexahydrate/Mesoporous Silica Supported TEMPO[J].Tetrahedron,2013,69(30):6041-6045.
(待續)
(編輯 鄧曉音)
Advances in Homogeneous Catalytic Oxidation of Alcohols by Molecular Oxygen
Wang Lianyue,Gao Shuang
(Dalian National Laboratory for Clean Energy,Dalian Institute of Chinese Physics,Chinese Academy of Science,Dalian Liaoning 116023,China)
Advances in the selective alcohol oxidation with molecular oxygen catalyzed by homogeneous catalyst systems,namely homogeneous transition metal(Cu,Fe,Co,V,Ru,Pd,Au) catalytic systems,non-metal catalytic system(2,2,6,6-tetramethyl-piperidyl-1-oxy) and small organic molecule catalytic systems(2,3-dichloro-5,6-dicyano-1,4-benzoquinone),to aldehydes or ketones were reviewed.The application,advantages and disadvantages of the catalytic systems were discussed.The possible catalytic mechanisms of the main catalytic systems were focused on.Based on the existing researches,the development trends in this field were also forecasted.
molecular oxygen;alcohol;selective oxidation;homogeneous catalysis
1000-8144(2015)11-1277-11
TQ 203.5
A
2015-03-30;[修改稿日期]2015-08-23。
王連月(1984—),男,山東省聊城市人,博士,助理研究員,電話 0411-84379726,電郵 lianyuewang@dicp.ac.cn。聯系人:高爽,電話 0411-84379248,電郵 sgao@dicp.ac.cn。
國家自然科學基金資助項目(21403219)。

