5-雜氮-2′-脫氧胞苷上調CK13表達并抑制人肺鱗癌YTMLC-9細胞增殖
姚 芳,張 鵬,王元國
(天津醫科大學總醫院心胸外科,天津300052)
論著
5-雜氮-2′-脫氧胞苷上調CK13表達并抑制人肺鱗癌YTMLC-9細胞增殖
姚 芳,張 鵬,王元國
(天津醫科大學總醫院心胸外科,天津300052)
目的:探討DNA甲基轉移酶抑制劑5-雜氮2′-脫氧胞苷(5-aza-2′-deoxycytidine)對人肺鱗癌YTMLC-9細胞株增殖的影響及對細胞角蛋白13(CK13)表達和CK13基因甲基化的影響。方法:采用四甲基偶氮唑藍(MTT)法檢測不同濃度(1、2、5、10,20、40 μmol/L)5-aza-2′-deoxycytidine處理1~4 d后的5-aza-2′-deoxycytidine對人肺鱗癌YTMLC-9細胞株生長的影響;采用半定量PCR及Western blot檢測5 μmol/L的5-aza-2′-deoxycytidine作用YTMLC-9 1~4 d CK13的表達;采用甲基化PCR檢測不同濃度(1、2、5、10 μmol/L)5-aza-2′-deoxycytidine處理48 h后CK13甲基化和非甲基化的變化。結果:5-aza-2′-deoxycytidine對人肺鱗癌YTMLC-9細胞株的生長具有明顯地抑制作用,當用藥濃度高于20 μmol/L后產生明顯的細胞毒性;5-aza-2′-deoxycytidine能夠上調CK13基因表達,呈時間依賴性。結論:5-aza-2′-deoxycytidine抑制人肺鱗癌YTMLC-9細胞的生長,抑制作用呈濃度、時間依賴性。5-aza-2′-deoxycytidine可以使CK13重新表達。其生物學效應可能與CK13啟動子甲基化狀態改變有關。
5-aza-2′-deoxycytidine;YTMLC-9;細胞增殖;DNA甲基化;CK13
肺癌是最為常見的惡性腫瘤,近50年來世界上很多國家的肺癌發病率和死亡率一直呈上升趨勢。據我國居民死因調查,肺癌死亡率20年間增加近1.5倍,在惡性腫瘤中增長最快。肺癌發生涉及遺傳學及表觀遺傳學,近年來表觀遺傳學改變在腫瘤中的作用受到廣泛重視,表觀遺傳學的研究對象是基因表達在時間和空間上的調控問題,其中最主要的兩個研究內容是甲基化和組蛋白修飾,抑癌基因啟動子甲基化參與的基因轉錄調控,己成為目前分子生物學領域研究基因表達調控的熱點。DNA甲基化可以影響抑癌基因表達,但并不改變DNA本身的序列和基因產物,因此這種改變可逆。運用DNA甲基轉移酶(DNA methyltransferase,DNMT)抑制劑5-雜氮2′-脫氧胞苷(5-aza-2′-deoxycytidine)通過DNA去甲基化作用可使多種CpG島過甲基化的抑癌基因重新表達,從而恢復抑癌功能[1-2]。CK13基因是黏膜非角化復層鱗狀上皮終末分化的標志,可作為細胞惡性程度的標志。近年來,對CK13基因在鱗狀細胞癌中的研究日益趨多,現有資料證明CK13基因與多種疾病的發生發展密切相關[3-6],CK13表達減低與其基因轉錄起始點上游CpG島過甲基化有關[7]。本研究用甲基轉移酶抑制劑5-雜氮2′-脫氧胞苷處理人肺鱗癌細胞系YTMLC-9,觀察其對肺癌細胞生長增殖的影響及對CK13基因表達的影響,探討其影響腫瘤細胞生物活性的機制。
1 材料與方法
1.1 材料 人肺鱗癌YTMLC-9細胞株由本實驗室保存,RPMI 1640培養基和胎牛血清購自美國Gibico公司,5-aza-2′-deoxycytidine購自美國Sigma公司,噻唑藍(MTT)購自美國Sigma公司,二甲基亞砜(DMSO)購自美國Amresco公司,無菌6孔板、96孔培養板購自丹麥Corning公司;提取RNA的Trizol、La Taq酶、2×GC Buffer、dNTP mixture、6× Loading Buffer等購自大連寶生物工程有限公司(Takara),DNA Marker DL2000、DNA提取試劑盒購自北京Tiangen生物技術有限公司,引物(北京奧科生物技術有限公司),CK13基因鼠抗人IgG單克隆抗體(美國Abcam公司),β-actin基因鼠抗人IgG抗體(北京博奧森公司),辣根酶標記山羊抗鼠IgG(北京中杉金橋公司),DNA重亞硫酸鹽修飾試劑盒購自美國Epigentek生物公司。
1.2 設備 醫用潔凈工作臺(美國Baker公司),水套式二氧化碳培養箱(美國Thermo Forma公司),空氣搖床(美國Thermo Forma公司);多功能酶標儀(美國Molecular Devices公司),PCR擴增儀(杭州晶格科學儀器公司;光學顯微鏡購自德國萊卡公司。
1.3 細胞培養及藥物處理
1.3.1 細胞培養 人肺鱗癌細胞株YTMLC-9常規培養于含10%胎牛血清的RPMI 1640培養液(pH 7.4)中,在37℃、5%CO2、充分濕度條件下的培養箱中培養,細胞呈貼壁生長,每2~3 d傳代1次。傳代時用含EDTA的胰酶37℃消化3~5 min,選用對數生長期細胞用于實驗。
1.3.2 試劑配置 5-aza-2′-deoxycytidine用DMSO溶解配成濃度為2.0×105μmol/L的儲存液,-20℃保存,使用時用PRMI 1640培養液稀釋為工作液。MTT溶于PBS中,過濾除菌,濃度為5 mg/mL,避光冷藏。
1.4 MTT法檢測細胞生長情況 采用5-aza-2′-deoxycytidine對人肺鱗癌細胞株YTMLC-9的生長抑制率進行測定。將對數生長期細胞以1×104個/孔的密度接種于無菌96孔培養板,每孔體積為180 μL。過夜貼壁后,每孔各自加入 5-aza-2′-deoxycytidine使終濃度為1、2、5、10、20、40 μmol/L,以不加藥物為陰性對照組,終體積200 μL。共6組,每種濃度設3個復孔,于37℃、5%CO2條件下培養處理24、48、72、96 h后每孔加入5 g/L的MTT,繼續培養4 h后,吸去培養基,每孔加入DMSO 80 μL,震蕩10 min,使紫藍色結晶完全溶解,用酶標儀以570 nm為波長測吸光度值。細胞生長抑制率=(對照組吸光值-實驗組吸光值)/對照組吸光值×100%,以上實驗重復3次。以細胞生長抑制率(%)為縱坐標,作用時間為橫坐標,繪制生長曲線。
1.5 半定量RT-PCR檢測CK13表達 將對數生長期細胞以2×105個/孔的密度接種于無菌6孔培養板。過夜貼壁后,每孔各自加入5-aza-2′-deoxycytidine使終濃度為5 μmol/L,以不加藥物為陰性對照組,每天換藥,分別培養24、48、72、96 h后提取RNA,檢測RNA質量及濃度后,逆轉錄成cDNA,按照說明書進行。以cDNA為模板,分別以如下引物進行PCR擴增。CK13的引物序列(擴增產物為124 bp):上游5′-GTGACTGGCACCTGAAG CA-3′,下游5′-AGGATGACCCGGTTGTTTT-3′;內參GAPDH的引物序列(擴增產物為152 bp):上游:5′-GAAGGTGAAGGTCGGAGTC-3′,下游:5′-GGGTGGAATCATATTGGAAC-3′。PCR反應體系:10×PCR buffer 2.5 μL;dNTP(2.5 μmol/L)2 μL;上游引物(10 μmol/L)1 μL;下游引物(10 μmol/L)1 μL;cDNA 1 μL;Easy Taq 0.125 μL;加ddH2O至25 μL。于PCR儀上進行PCR擴增,PCR反應條件:預變性94℃3 min,變性94℃30 s,退火56℃30 s,延伸72℃30 s,35個循環;終止72℃10 min。取5 μL的PCR擴增產物與1 μL 6×Loading Buffer混合均勻后在含溴乙錠的1.5%瓊脂糖凝膠200 V電壓電泳10 min分離,紫外凝膠成像系統觀察分析結果。
1.6 Western blot檢測CK13蛋白表達 將對數生長期細胞以2×105個/孔的密度接種于無菌6孔培養板。過夜貼壁后,每孔各自加入5-aza-2′-deoxycytidine使終濃度為5 μmol/L,以不加藥物為陰性對照組,每天換藥,分別培養24、48、72、96 h后收集細胞,提取蛋白,BCA法測蛋白濃度,SDS-PAGE凝膠電泳分離細胞總蛋白,將蛋白通過電轉移印跡到NC膜上,5%脫脂奶粉/TBST液封閉;蛋白上樣量分別為30 g,CK13工作濃度為1∶1 000,β-actin工作液濃度為1∶1 000,二抗工作濃度為1∶10 000,ECL試劑發光,X線膠片曝光、顯影、定影,將條帶掃描后灰度分析。
1.7 MSP檢測CK13甲基化
1.7.1 細胞培養、藥物作用及基因組DNA的提取與檢測 將對數生長期細胞以2×105個/孔的密度接種于無菌6孔培養板。過夜貼壁后,每孔各自加入 5-aza-2′-deoxycytidine使終濃度為1、2、5、10 μmol/L,以不加藥物為陰性對照組,每天換藥,培養72 h后進行提取基因組DNA(gDNA),按照說明書進行,同時提取健康志愿者外周血淋巴細胞DNA作為陽性對照,用紫外分光光度計測定gDNA的濃度和純度,凝膠電泳質檢,檢測gDNA完整性。外周血淋巴細胞DNA首先經甲基化酶處理:模板DNA 5 μg,10×buffer 4 μL,50×SAM 2 μL,SssI甲基化酶4 μL,去離子水補至40 μL,37℃水浴6 h。經SssI甲基轉移酶處理的DNA作為甲基化陽性對照,未經該酶處理的DNA作為陰性對照,之后進行重亞硫酸鹽修飾,用于MSP檢測。
1.7.2 gDNA重亞硫酸鹽修飾 操作步驟嚴格按照美國Epigentek生物公司的gDNA重亞硫酸鹽修飾試劑盒推薦方案進行,將得到的gDNA用于下一步實驗或分裝凍存于-20℃備用。
1.7.3 甲基化特異性PCR(MSP)檢測CK13基因啟動子區甲基化狀態 引物設計:本研究甲基化和非甲基化兩對引物設計序列見表1。
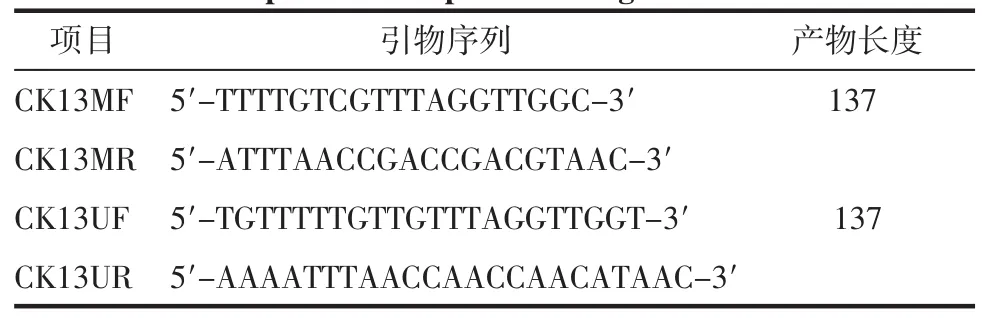
表1 CK13引物序列及產物長度Tab 1 The PCR primers and products lengths
以重亞硫酸氫鹽修飾的DNA為模板,分別以甲基化和非甲基化引物進行PCR擴增。PCR反應體系:2×GC buffer 12.5 μL;dNTP(2.5 μmol/L)2 μL;上游引物(10 μmol/L)1 μL;下游引物(10 μmol/L)1 μL;Template(修飾后gDNA)2 μL;LA Taq 0.3 μL;加ddH2O至25 μL。于PCR儀上進行PCR擴增,PCR反應條件:預變性95℃10 min,變性94℃30 s,退火68℃(非甲基化60℃)45 s,延伸72℃60 s,40個循環;終止72℃6 min。
1.7.4 PCR結果的判讀 取5 μL的PCR擴增產物與1 μL 6×Loading Buffer混合均勻后在含溴乙錠的1.5%瓊脂糖凝膠200 V電壓電泳10 min分離,紫外凝膠成像系統觀察分析結果。用甲基化特異性引物擴增出特異性產物表明存在DNA甲基化,僅非甲基化特異性引物擴增出特異性產物者表明不存在DNA甲基化,若同時出現擴增產物則考慮DNA部分甲基化,凝膠成像系統成像。
2 結果
2.1 5-aza-2′-deoxycytidine對YTMLC-9細胞增殖的影響 MTT檢測發現5-aza-2′-deoxycytidine對人肺鱗癌細胞株YTMLC-9細胞增殖的抑制作用呈濃度(1~10 μmol/L)依賴性(P<0.05);呈時間依賴性(24~96 h)(P<0.05),見圖1。但20 μmol/L 5-aza-2′-deoxycytidine作用的細胞產生細胞毒性,40 μmol/L濃度組細胞毒性明顯增強。
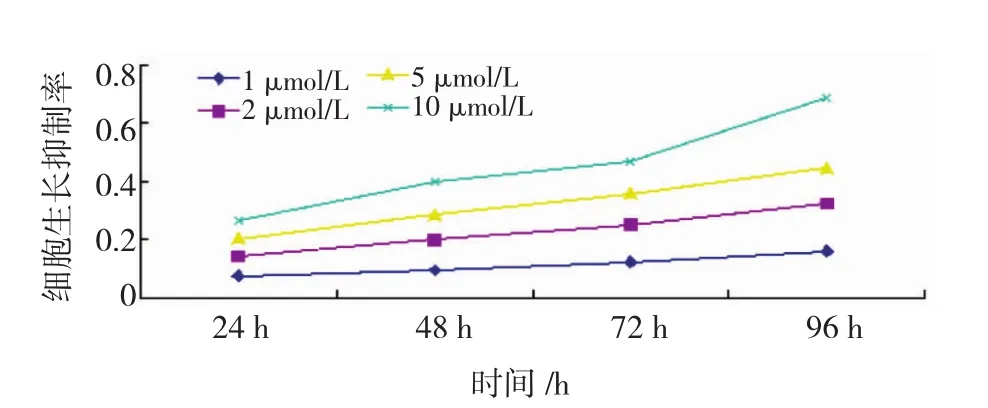
圖1 MTT法測定YTMLC-9在不同5-aza-2′-deoxycytidine濃度下的96 h細胞生長抑制率Fig 1 MTT cell proliferation assay in YTMLC-9 cell line
2.2 5-aza-2′-deoxycytidine對 YTMLC-9細胞CK13的mRNA表達的影響 細胞PCR電泳結果用 5 μmol/L的 5-aza-2′-deoxycytidine處理YTMLC-9細胞,經圖像處理分析統計,GAPDH灰度值為參照,所有藥物組與對照組比較CK13 mRNA表達均增高,且隨著作用時間增加,CK13 mRNA表達水平上升,用藥24、48、72、96 h組較對照組上升百分比分別為 26.5%、68.7%、86.7%、209.6%(P<0.05)[上升百分比=(實驗組值-對照組值)/對照組值)×100%],見圖2、3。

圖2 5-aza-2′-deoxycytidine不同時間YTMLC-9細胞CK13的mRNA表達水平Fig 2 Changes of CK13 mRNA levels in YTMLC-9 cell line
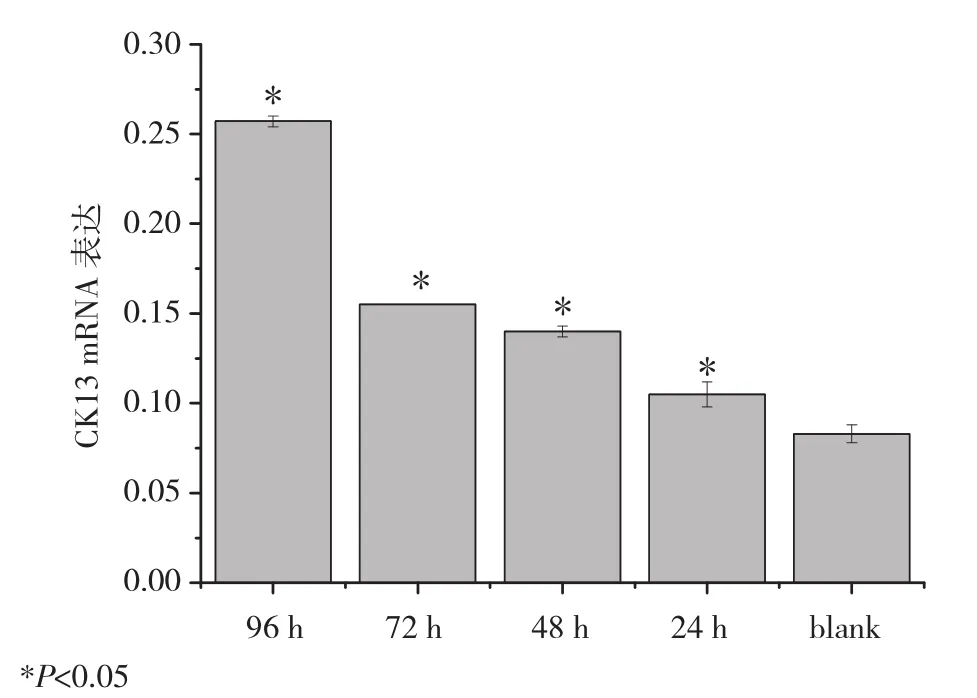
圖3 5-aza-2′-deoxycytidine不同時間YTMLC-9細胞CK13的mRNA表達水平Fig 3 Changes of CK13 mRNA levels in YTMLC-9 cell line
2.3 5-aza-2′-deoxycytidine對 YTMLC-9細胞CK13蛋白表達的影響 用5 μmol/L的5-aza-2′-deoxycytidine處理YTMLC-9細胞,經圖像處理分析統計,β-actin灰度值為參照,所有藥物組與對照組比較CK13蛋白表達均增高,且隨著用藥時間增加,CK13蛋白表達水平上升,用藥24、48、72、96 h組較對照組上升百分比分別為 109.3%、301.3%、397.3%、478.7%(P<0.05)[上升百分比=(實驗組值-對照組值)/對照組值)×100%],見圖4、5。
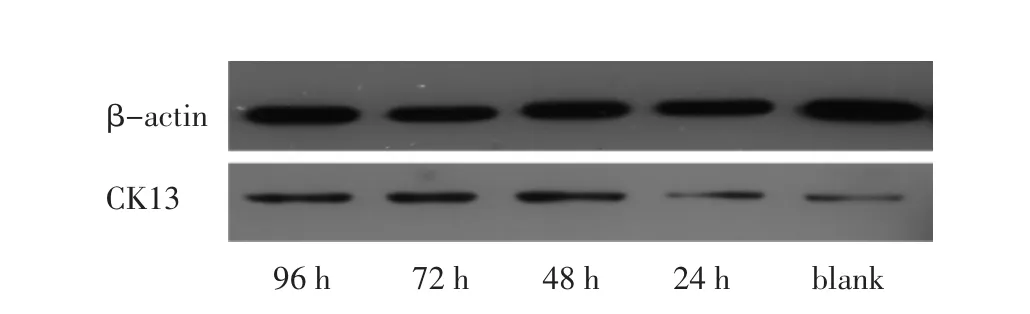
圖4 5-aza-2′-deoxycytidine不同時間YTMLC-9細胞CK13的蛋白表達水平Fig 4 Changes of CK13 protein levels in YTMLC-9 cell line
2.4 5-aza-2′-deoxycytidine對 YTMLC-9細胞CK13基因甲基化的影響 用1~10 μmol/L的5-aza-2′-deoxycytidine處理YTMLC-9細胞,隨著用藥濃度的增加,CK13發生去甲基化,甲基化逐漸減少,非甲基化逐漸增多,與對照組比較差異具有統計學意義(P<0.05),但10 μmol/L的5-aza-2′-deoxycytidine仍不能使CK13完全去甲基化,見圖6。
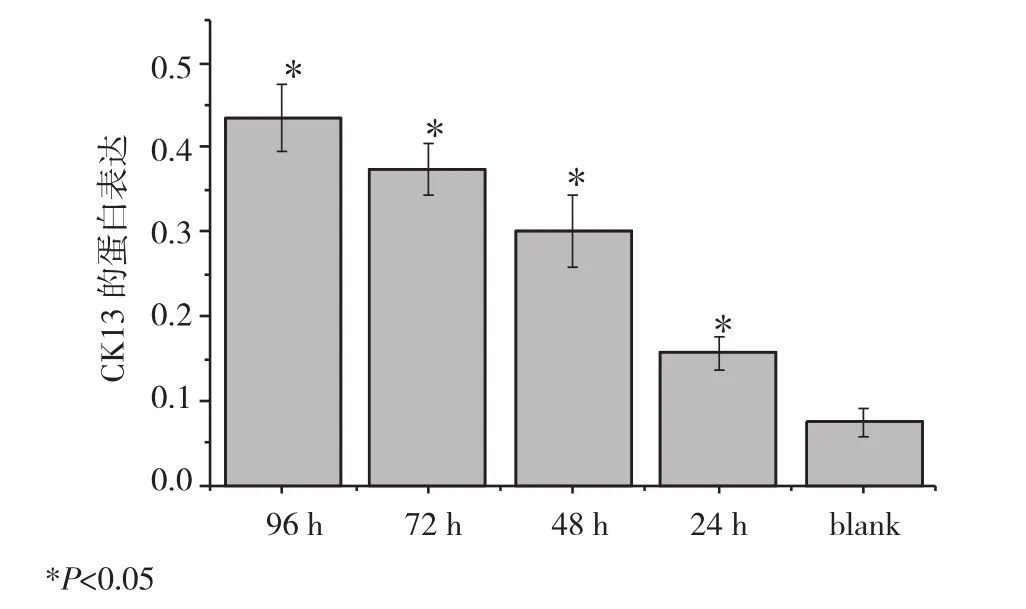
圖5 5-aza-2′-deoxycytidine不同時間YTMLC-9細胞CK13的蛋白表達水平Fig 5 Changes of CK13 protein levels in YTMLC-9 cell line
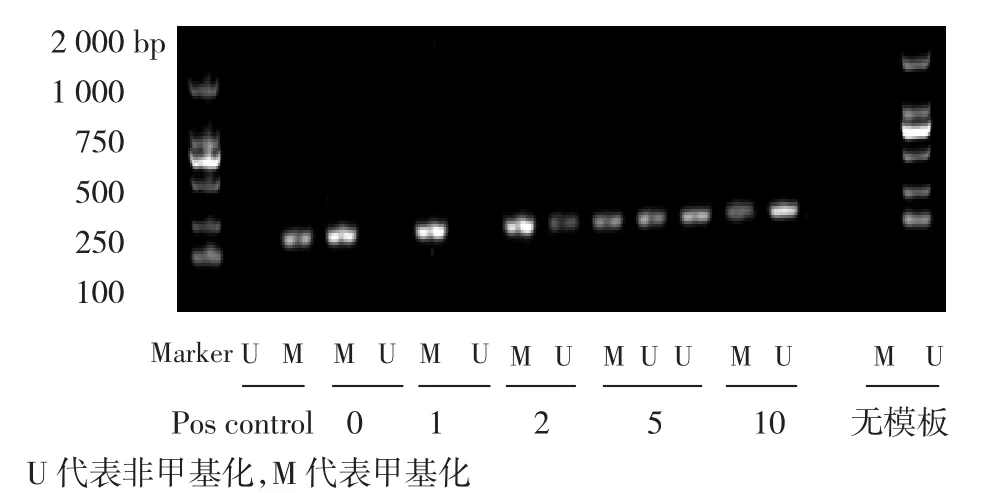
圖6 5-aza-2′-deoxycytidine對YTMLC-9細胞CK13基因甲基化的影響Fig 6 Changes of the methylation level of CK13 in YTMLC-9 cell line
3 討論
基因組的不穩定通常會引起遺傳物質改變,引發多種疾病,尤其是腫瘤和癌癥。細胞采用多種機制來保證DNA復制的真實性。DNA甲基化在DNA復制起始、錯配修復以及轉座子的失活等過程中對維持遺傳信息的穩定性發揮著重要作用[8-9]。DNA甲基化對基因的抑制活性是多方面導致的,DNA甲基化可能直接影響一些轉錄因子的結合活性或DNA甲基化結合蛋白抑制了轉錄因子的結合。在細胞中有些轉錄因子的特異結合位點中有CpG位點,這些位點發生甲基化的時候,就降低了轉錄因子與啟動子的結合效率,從而減低基因的轉錄率。在多種癌細胞中有抑癌基因的過度甲基化,而這種過度甲基化與細胞內高水平的DNMT是一致的。DNMT抑制劑能使因CpG島過甲基化而失活的抑癌基因重新表達,進而抑制腫瘤細胞生長增殖。
DNA去甲基化治療已被證實在骨髓增生異常綜合征(MDS)、白血病AML、CML的治療中取得較好療效。Liu等[2]發現5-aza-2′-deoxycytidine能呈時間和劑量依賴性抑制T淋巴細胞白血病細胞系Molt4細胞的增殖,并能誘導細胞凋亡,使細胞阻滯于G0/G1期。0.50 μmol/L地西他濱處理72 h后,Molt4細胞LTF基因啟動子甲基化率較低,mRNA和蛋白表達增加,caspase 3、caspase 9凋亡蛋白表達增加[10]。Zhang[11]報道了1例難治性AML(58%原始細胞)患者用5-aza-2′-deoxycytidine預處理后成功進行造血干細胞移植。Kadia等[12]研究發現5-aza-2′-deoxycytidine能夠改善AML患者的預后。Hwang等[13]發現SPINT2具有腫瘤抑制活性,其功能可能與抑制細胞外調節信號HGF有關。在黑色素瘤中SPINT2沉默,而5-aza-2′-deoxycytidine處理后可以使SPINT2恢復轉錄活性。Zych等[1]研究發現5-aza-2′-deoxycytidine可以減少脂肪細胞增殖及分化,導致PPARG、FABP4下調,GATA2上調。但在不同組織中5-aza-2′-deoxycytidine作用不同。Pandey等[14-15]研究發現,在光動力療法(PDT)治療環境下,多種腫瘤模型中應用5-aza-2′-deoxycytidine可以釋放多種腫瘤相關抗原(TAA)。免疫系統可以識別由腫瘤表面MHC I類分子呈遞的TAA,然后CTLs通過穿孔素和顆粒酶破壞腫瘤細胞。因此5-aza-2′-deoxycytidine潛在地增強免疫系統而抗腫瘤從而延長生存期。雖然5-aza-2′-deoxycytidine可作用于血液系統腫瘤,但由于5-aza-2′-deoxycytidine的細胞毒性及復甲基化,在實體腫瘤中的作用卻令人失望[16]。
研究顯示CK13基因與多種鱗癌的發生發展密切相關,在口腔癌、鼻咽癌、食管癌、乳腺癌、肺癌、宮頸癌、皮膚癌等失表達,腫瘤抑制活性降低。CK13基因陽性表達率與鱗癌的組織分化程度相關,其表達隨腫瘤分化程度下降而下降,并且隨原發腫瘤的增大及向周圍的侵襲而表達逐步減少,證明該基因可能參與了腫瘤組織由高到低分化的演進過程[17-23]。研究顯示,在癌細胞中,CK13的失活可能是通過CpG啟動子的過度甲基化來實現的。Winter等[7]發現CK13的組織特異性表達及在上皮性腫瘤中的異常表達與CK13基因轉錄起始點上游的CpG甲基化密切相關,CpG低甲基化導致CK13基因表達,CpG島高甲基化導致CK13基因失活。因此5-aza-2′-deoxycytidine的生物學活性可能與CK13存在密切關系。
本研究中,筆者探討了5-aza-2′-deoxycytidine對肺癌細胞增殖的影響。數據顯示,5-aza-2′-deoxycytidine在較低濃度1 μmol/L時就抑制細胞生長,在10 μmol/L作用時,細胞就不再生長并凋亡,但是更高濃度的藥物就會產生細胞毒性。以往研究顯示0.1 μmol/L或0.5 μmol/L 5-aza-2′-deoxycytidine可以使宮頸癌細胞T24去甲基化并且有很低的毒性,提高濃度后藥物會集合到復制的DNA中產生細胞毒性但是不抑制DNA甲基化。Liu等[2]研究發現5-aza-2′-deoxycytidine促進HXO-RB44細胞凋亡,并使細胞周期停滯在G0/G1期,MSP檢測顯示5-aza-2′-deoxycytidine作用濃度在0.5~5 μmol/L時,RASSF1A DNA非甲基化增加,甲基化減少,并呈劑量依賴性。在5 μmol/L藥物濃度作用HXORB44第4天,RASSF1A完全去甲基化,并且在第4天至第7天,RASSF1A表達明顯增加。Kantarjian等[24]認為低劑量的5-aza-2′-deoxycytidine可以去甲基化,使基因重新表達,而不是最大耐受劑量。但研究者相信5-aza-2′-deoxycytidine通過使凋亡誘導基因的去甲基化重新恢復活性而產生抑癌作用,目標主要在于復表達的基因或信號通路[25]。筆者研究也顯示5-aza-2′-deoxycytidine具有去甲基化作用,使抑癌基因CK13重新表達,并且呈時間依賴性。5 μmol/L的5-aza-2′-deoxycytidine可以有效抑制CK13基因啟動子甲基化。隨著濃度的提高,CK13基因啟動子去甲基化明顯增加,但不能完全去甲基化。考慮藥物作用時間也是基因啟動子去甲基化的一個影響因素或者存在復甲基化。當藥物濃度增高至產生細胞毒性時CK13并未完全去甲基化,此時藥物不再對CK13的去甲基化有明顯作用。數據表明由5-aza-2′-deoxycytidine誘導的CK13基因啟動子的去甲基化及重新表達對于細胞生長抑制、凋亡具有重要作用。
該研究顯示5-aza-2′-deoxycytidine可以抑制肺癌細胞生長,促進細胞凋亡,其作用可能與其使CK13去甲基化,重新表達有關。臨床上,只有產生細胞毒劑量或最大耐受劑量的 5-aza-2′-deoxycytidine才能抗白血病、骨髓多發性硬化癥,并且在治療Ⅰ、Ⅱ期的實性腫瘤過程中就產生大量的副作用[26]。5-aza-2′-deoxycytidine等更多的去甲基化藥物對于治療肺癌等腫瘤的生物活性機制及可行性需要更多探索。
[1] Zych J,Stimamiglio M A,Senegaglia A C,et al.The epigenetic modifiers 5-aza-2′-deoxycytidine and trichostatin A influence adipocyte differentiation in human mesenchymal stem cells[J].Braz J Med Biol Res,2013,46(5):405
[2] Liu R,Zhang X H,Zhang K,et al.5-Aza-2''-deoxycytidine inhibits retinoblastoma cell by reactivating epigenetically silenced RASSF1A gene[J].Int J Ophthalmol,2014,7(1):51
[3] Wang J,Lai Q,Pan H,et al.Evaluation of specific marker CK13 andCK10/13 combined with APM staining for the diagnosis of amniotic fluid embolism and aspiration[J].Forensic Sci Int,2014,238:108
[4] Rivarola de Gutierrez E,Innocenti A C,Cippitelli M J,et al. Determination of cytokeratins 1,13 and 14 in oral lichen planus[J]. Med Oral Patol Oral Cir Bucal,2014,19(4):e359
[5] Nobusawa A,Sano T,Negishi A,et al.Immunohistochemical staining patterns of cytokeratins 13,14,and 17 in oral epithelial dysplasia including orthokeratotic dysplasia[J].Pathol Int,2014,64 (1):20
[6]丁凱,毛志福,孫作永.食管鱗癌中細胞角蛋白13的表達及臨床意義[J].疑難病雜志,2010,9(10):746
[7] Winter H,Rentrop M,Nischt R,et al.Tissue-specific expression of murine keratin CK 13 in internal stratified squamous epithelia and its aberrant expression during two-stage mouse skin eareinogenesis is associated with the methylation slate of a distinct CpG site in the remote 5-flanking region of the gene[J].Differentiation,1990, 43(2):105
[8] Su Y,Xu H,Xu Y,et al.Azacytidine inhibits the proliferation of human promyelocytic leukemia cells (HL60)by demethylation of MGMT,DAPK and p16 genes[J].Hematology,2012,17(1):41
[9] Momparler R L,C?té S,Momparler L F,et al.Epigenetic therapy of acute myeloid leukemia using 5-aza-2'-deoxycytidine(decitabine) in combination with inhibitorsofhistone methylation and deacetylation[J].Clin Epigenetics,2014,6(1):19
[10]Liu J,Huang C,Cheng H,et al.Effects of decitabine against acute T lymphoblastic leukemia cell line Molt4[J].Zhonghua Xue Ye Xue Za Zhi,2015,36(3):230
[11]Zhang C,Chen X H,Liu J,et al.Decitabine as a conditioning regimen in haploidentical stem cell transplantation for refractory acute myeloid leukaemia[J].J Clin Pharm Ther,2015,40(3):336
[12]Kadia T M,Thomas X G,Dmoszynska A,et al.Decitabine improves outcomes in older patients with acute myeloid leukemia(AML)and higher blast counts[J].Am J Hematol,2015,90(7):E139
[13]Hwang S,Kim H E,Min M,et al.Epigenetic silencing of SPINT2 promotes cancer cell motility via HGF-MET pathway activation in melanoma[J].J Invest Dermatol,2015,135(9):2283
[14]Pandey A,Kurup A,Shrivastava A,et al.Cancer testes antigens in breastCancer:biologicalrole,regulation,and therapeutic applicability[J].Int Rev Immunol,2012,31(5):302
[15]Wachowska M,Gabrysiak M,Muchowicz A,et al.5-Aza-2'-deoxycytidine potentiates antitumour immune response induced by photodynamic therapy[J].Eur J Cancer,2014,50(7):1370
[16]Graham M R,Ryan P,Baker J S,et al.Counterfeiting in performance-and image-enhancing drugs[J].Drug Test Anal,2009, 1(3):135
[17]Takashima M,Kawachi H,Yamaguchi T,et al.Reduced expression of cytokeratin 4 and 13 is a valuable marker for histologic grading of esophageal squamous intraepithelial neoplasia[J].J Med Dent Sci, 2012,59(1):17
[18]Huang Y,Li P,Xu Y,et al.The expression of CK4,CK13 in hypopharyngealsquamouscellcarcinomousand itsclinical significance[J].J Clin Otothiolaryngol Head Neck Surg,2014,28 (12):874
[19]Nobusawa A,Sano T,Negishi A,et al.Immunohistochemical staining patterns of cytokeratins 13,14,and 17 in oral epithelial dysplasia including orthokeratotic dysplasia[J].Pathol Int,2014,64 (1):20
[20]Wang J,Lai Q,Pan H,et al.Evaluation of specific marker CK13 and CK10/13 combined with APM staining for the diagnosis of amniotic fluid embolism and aspiration[J].Forensic Sci Int,2014,238:108
[21]Rivarola de Gutierrez E,Innocenti A C,Cippitelli M J,et al. Determination of cytokeratins 1,13 and 14 in oral lichen planus[J]. Med Oral Patol Oral Cir Bucal,2014,19(4):e359
[22]Nobusawa A,Sano T,Negishi A,et al.Immunohistochemical staining patterns of cytokeratins 13,14,and 17 in oral epithelial dysplasia including orthokeratotic dysplasia[J].Pathol Int,2014,64 (1):20
[23]Yamashina M,Sato K,Tonogi M,et al.Evaluation of superficial oral squamous cell malignancy based on morphometry and immunoexpression of cytokeratin 13 and cytokeratin 17[J].Acta Cytol,2014,58(1):67
[24]Kantarjian H M,O’brien S,Huang X,et al.Survival advantage with decitabine versus intensive chemotherapy in patients with higher risk myelodysplastic syndrome:comparison with historical experience[J].Cancer,2007,109(6):1133
[25]Shakya R,Gonda T,Quante M,et al.Hypomethylating therapy in an aggressive stroma-rich model of pancreatic carcinoma[J].Cancer Res,2013,73(2):885
[26]Takahashi Y,Kimura S,Okano M.Pharmacological profiles and clinical roles of 5-azacitidine(Vidaza(?)for injection 100 mg)for the treatment of myelodysplastic syndrome (MDS)[J].Nihon Yakurigaku Zasshi,2012,140(5):235
(2015-04-13收稿)
5-Aza-2′-deoxycytidine inhibits human lung squamous carcinoma YTMLC-9 cell by epigenetically silenced CK13 gene in vitro
YAO Fang,ZHANG Peng,WANG Yuan-guo
(Department of Cardiothoracic Surgery,General Hospital,Tianjin Medical University,Tianjin 300052,China)
Objective:To explore the effect of the DNA methyltransferase inhibitor 5-aza-2′-deoxycytidine on human lung squamouscarcinoma YTMLC-9 cell lines and the methylation of CK13.Methods:Human lung squamous-carcinoma YTMLC-9 cell lines were treated for 1 to 4 days by 5-aza-2′-deoxycytidine with 1,2,5,10,20,40 μmol/L,respectively.Consequently,the inhibition rate of the cells were detected by MTT assay,and morphological pattern were observed.CK13 mRNA and protein levels were measured by semiquantitative RT-PCR and Western blot,respectively,after cells were treated with 5 μmol/L 5-aza-2′-deoxycytidine for one to four days. The methylation level of CK13 were detected by methylation-specific polymerase chain reaction(MSP).Results:MTT results showed that the proliferation ability of YTMLC-9 cells was inhibited by 5-aza-2′-deoxycytidine from 1 μmol/L to 10 μmol/L.Furthermore, concentration-dependent and time-dependent manner were shown by(P<0.05).But higher concentration drug derived cells especially under 40 μmol/L,were with higher cytoxicity;CK13 expression was reactivated at mRNA and protein level.Incubation time and dose of 5-aza-2′-deoxycytidine also functioned were discovered as factors for the demethylation status of CK13 promoter DNA and CK13 expression.The methylation of CK13 gene promoter was down-regulated by 5-aza-2′-deoxycytidine in a concentration-dependent manner.Conclusion:The proliferation ability of YTMLC-9 cells can be inhibited by 5-aza-2′-deoxycytidine in a concentration-dependent and time-dependent manner.CK13 expression can be reactivated in cells incubated with 5-aza-2′-deoxycytidine.These may associate with the downregulation of CK13 gene promoter methylation.
5-aza-2′-deoxycytidine;human lung squamous-carcinoma YTMLC-9;cell proliferation;DNA methylation;CK13
R734.2
A
1006-8147(2015)06-0474-06
姚芳(1989-),女,碩士在讀,研究方向:胸心外科;E-mail: yaofang198902@163.com。

