清熱消炎顆粒解熱作用及對血清中TNF-α、IL-1β、IL-6和PGE2影響的初步研究
龐淑婉,李 宏,穆 軼,杜 芃,李 娟,房志仲
(1.天津醫科大學第二醫院藥學部,天津 300211;2.天津醫科大學藥學院藥劑學教研室,天津市臨床藥物關鍵技術重點實驗室,天津 300070)
論著
清熱消炎顆粒解熱作用及對血清中TNF-α、IL-1β、IL-6和PGE2影響的初步研究
龐淑婉1,李 宏1,穆 軼1,杜 芃1,李 娟1,房志仲2
(1.天津醫科大學第二醫院藥學部,天津 300211;2.天津醫科大學藥學院藥劑學教研室,天津市臨床藥物關鍵技術重點實驗室,天津 300070)
目的:觀察清熱消炎顆粒對內毒素致發熱大耳白兔的解熱作用及對血清中TNF-α、IL-1β、IL-6、前列腺素(PGE2)表達水平的影響,探討清熱消炎顆粒的解熱機制。方法:體溫合格的大耳白兔36只隨機分為6組,分別為對照組,模型組,阿司匹林組,清熱消炎顆粒低、中、高劑量組。一次灌胃給予藥物(阿司匹林、清熱消炎顆粒)后大耳白兔耳緣靜脈注射內毒素溶液制備發熱模型。監測給藥前、內毒素注射后1、2、3、4 h體溫。內毒素注射4 h后,測定血清TNF-α、IL-1β、IL-6、PGE2水平。結果:清熱消炎顆粒中、高劑量組,在內毒素注射后1、2、3、4 h直腸溫度升高值均顯著低于模型組(P<0.05或P<0.01)。而低劑量組與模型組比較,直腸溫度無顯著性差異。內毒素致熱后4 h,模型組大耳白兔血清TNF-α、IL-1β、IL-6、PGE2水平較對照組顯著升高(P<0.01);與模型組比較,清熱消炎顆粒高劑量組TNF-α、IL-1β、IL-6、PGE2水平均顯著降低(P<0.05)。結論:中、高劑量清熱消炎顆粒有明顯解熱作用,低劑量藥物無顯著降溫作用。清熱消炎顆粒高劑量組可明顯降低內毒素致熱大耳白兔血液的內生致熱原TNF-α、IL-1β、IL-6及PGE2。
清熱消炎顆粒;內毒素;TNF-α;IL-1β;IL-6;PGE2;兔
發熱是臨床上多種疾病的常見癥狀,按發熱的發病機制,可將發熱分為致熱源性發熱與非致熱源性發熱,其中前者較為常見。細菌、病毒、真菌等都屬于外源性致熱原,外源性致熱原還包括炎癥滲出物、無菌性壞死組織、抗原抗體復合物等,它們多為大分子物質,特別是細菌內毒素分子量非常大,不能通過血腦屏障直接作用于體溫調節中樞,而是通過激活血液中的中性粒細胞、嗜酸性粒細胞和單
核-吞噬細胞系統,使其產生并釋放內源性致熱源,內源性致熱源主要包括白介素(IL-1、IL-6)、腫瘤壞死因子(TNF)和干擾素等多種細胞因子[1]。清熱消炎顆粒為中藥制劑,具有清熱解毒、疏風解表、涼血消炎的功效。本實驗旨在觀察清熱消炎顆粒對內毒素致大耳白兔的解熱作用及其對血清TNF-α、IL-1β、IL-6、前列腺素(PGE2)表達水平的影響,探討清熱消炎顆粒的解熱機制。
1 材料與方法
1.1 材料
1.1.1 動物 大耳白兔,普通級,動物質量合格證編號:11401400000271,購于北京隆安實驗動物養殖中心,許可證號:SCXK(京)2014-0002。
1.1.2 主要試劑與藥品 生理鹽水(山東華魯制藥有限公司,批號:D13092303);清熱消炎顆粒(5 g/袋,天津醫科大學藥劑學教研室制備,批號:20140501);阿司匹林泡騰片(阿斯利康制藥有限公司:批號1403169);內毒素(Sigma公司,批號:109k4075);TNF-α、IL-1、IL-6和PGE2放免測試試劑盒(北京華英生物技術所);其他試劑均為市售分析純。
1.1.3 儀器 MC-612型電子數字式溫度計(歐姆龍有限公司),TC30KHA型電子天平(常熟市雙杰測試儀器廠),ML203/02電子天平(梅特勒托利多儀器有限公司),KQ-50B超聲波清洗器(昆山市超聲儀器有限公司),γ-911全自動放免計數儀(中國科技大學實業總公司)。
1.2 方法
1.2.1 分組 給藥前連續3 d每天3次測量大耳白兔體溫,使大耳白兔習慣肛溫測定操作。實驗當天按照《中國藥品檢驗標準操作規范》挑選正常體溫(38.0~39.6℃)的大耳白兔36只隨機分為對照組、模型組、阿司匹林組、清熱消炎顆粒低劑量組、清熱消炎顆粒中劑量組、清熱消炎顆粒高劑量組,每組6只[2]。
1.2.2 發熱模型的建立及給藥 實驗當天各組大耳白兔分別測量給藥前、內毒素注射后1、2、3、4 h體溫并予記錄。測量各組大耳白兔基礎體溫后,各給藥組均按50 mL/kg以灌胃方式一次給予相應藥物,各給藥組以去離子水稀釋藥物,阿司匹林組(0.1 g/mL,1 mL/kg),清熱消炎顆粒低劑量組(6.75g/mL,1mL/kg,相當成人臨床用量5倍)、清熱消炎顆粒中劑量組(13.5 g/mL,1 mL/kg,相當成人臨床用量10倍)、清熱消炎顆粒高劑量組(27 g/mL,1 mL/kg,相當成人臨床用量20倍)。模型組和對照組分別按50 mL/kg灌胃給予相同容積去離子水。各組灌胃給藥后,除對照組外,其余各組大耳白兔立即耳緣靜脈注射內毒素溶液250 ng/kg(用無熱原生理鹽水稀釋內毒素,250 ng/mL,1 mL/kg)。造模后各時間點模型組與對照組比較體溫顯著性升高(P<0.05),說明造模成功。內毒素注射4 h后,立即心臟采血,離心分離血清(3 000 r/min,10 min),按照放射免疫藥盒說明書測定各組血清TNF-α、IL-1、IL-6、PGE2水平[2]。
2 結果
2.1 清熱消炎顆粒解熱作用 各組注射內毒素后兔直腸溫度持續升高,其中注射后1、2、3、4 h其直腸溫度升高值顯著高于對照組(P<0.05或P<0.01),說明造模成功;阿司匹林組和清熱消炎顆粒中、高劑量組在注射內毒素后1、2、3、4 h直腸溫度升高值均顯著低于模型組(P<0.05或P<0.01),而低劑量組與模型組比較,直腸溫度無顯著性差異。結果提示中、高劑量清熱消炎顆粒和阿司匹林泡騰片均有明顯解熱作用,低劑量組無顯著降溫作用。見表1。
表1 清熱消炎顆粒解熱作用實驗結果(±s,n=6)Tab 1 Test results for antipyretic effect of Qingrexiaoyan particles±s,n=6)
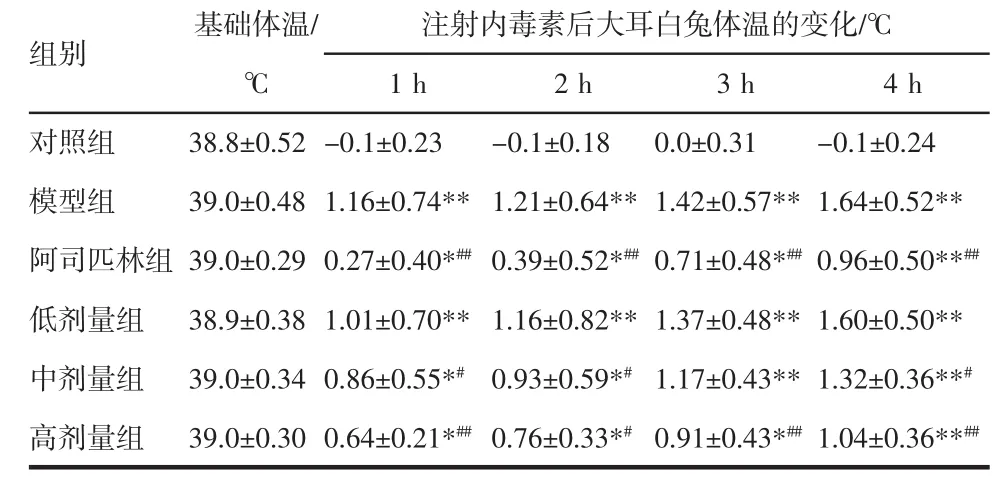
表1 清熱消炎顆粒解熱作用實驗結果(±s,n=6)Tab 1 Test results for antipyretic effect of Qingrexiaoyan particles±s,n=6)
與對照組比較:*P<0.05,**P<0.01;與模型組比較:#P<0.05,##P<0.01
組別 基礎體溫/ 注射內毒素后大耳白兔體溫的變化/℃℃ 1 h 2 h 3 h 4 h對照組 38.8±0.52-0.1±0.23 -0.1±0.18 0.0±0.31 -0.1±0.24模型組 39.0±0.48 1.16±0.74**1.21±0.64**1.42±0.57**1.64±0.52**阿司匹林組 39.0±0.29 0.27±0.40*##0.39±0.52*##0.71±0.48*##0.96±0.50**##低劑量組 38.9±0.38 1.01±0.70**1.16±0.82**1.37±0.48**1.60±0.50**中劑量組 39.0±0.34 0.86±0.55*#0.93±0.59*#1.17±0.43**1.32±0.36**#高劑量組 39.0±0.30 0.64±0.21*##0.76±0.33*#0.91±0.43*##1.04±0.36**##
2.2 清熱消炎顆粒對內毒素發熱兔血清TNF-α、IL-1β、IL-6及PGE2的影響 內毒素致熱后4 h,模型組大耳白兔血清TNF-α、IL-1β、IL-6及PGE2水平較對照組顯著升高(P<0.01);與模型組比較阿司匹林組和清熱消炎顆粒高劑量組TNF-α、IL-1β、IL-6、PGE2水平均顯著降低(P<0.05或P<0.01),結果顯示阿司匹林和高劑量清熱消炎顆粒可明顯降低內毒素致熱大耳白兔血液的內生致熱原TNF-α、IL-1β、IL-6及PGE2。見表2。
表2 清熱消炎顆粒對TNF-α、IL-1β、IL-6及PGE2的影響±s,n=6)Tab 2 Influence of Qingrexiaoyan particles on TNF-α,IL-1β, IL-6,PGE2(±s,n=6)
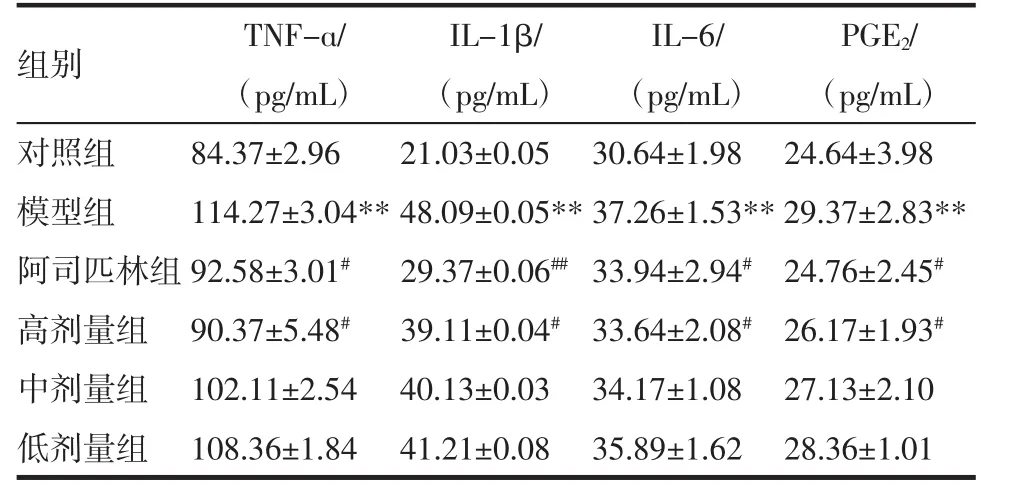
表2 清熱消炎顆粒對TNF-α、IL-1β、IL-6及PGE2的影響±s,n=6)Tab 2 Influence of Qingrexiaoyan particles on TNF-α,IL-1β, IL-6,PGE2(±s,n=6)
與對照組比較:*P<0.05;**P<0.01;與模型組比較:#P<0.05;##P<0.01
組別 TNF-ɑ/ IL-1β/ IL-6/ PGE2/(pg/mL) (pg/mL) (pg/mL) (pg/mL)對照組 84.37±2.96 21.03±0.05 30.64±1.98 24.64±3.98模型組 114.27±3.04**48.09±0.05**37.26±1.53**29.37±2.83**阿司匹林組92.58±3.01#29.37±0.06##33.94±2.94#24.76±2.45#高劑量組 90.37±5.48#39.11±0.04#33.64±2.08#26.17±1.93#中劑量組 102.11±2.54 40.13±0.03 34.17±1.08 27.13±2.10低劑量組 108.36±1.84 41.21±0.08 35.89±1.62 28.36±1.01
3 討論
清熱消炎顆粒主要由連翹、柴胡、板藍根等中藥組成,具有清熱解毒、疏風解表、涼血消炎的功效。現代醫學關于清熱解毒功效的闡釋目前主要集中于以下兩點:一是抗細菌內毒素作用;二是抗病原微生物作用,尤其是抗內毒素活性為該類中藥的重要特性。中醫藥治療外感高熱具有一定優勢,療效穩定,不易反復,且有較好改善癥狀的作用。板藍根對細菌、內毒素和炎性細胞因子有一定的拮抗和抑制作用,中藥新劑型的開發方便了中藥在臨床的應用,便于臨床推廣應用,同時應進一步探討純中藥制劑退熱機制,為臨床治療進一步提供理論依據[3]。現代藥理研究證明,板藍根對多種革蘭陽性菌、陰性菌及流感病毒有抑制作用,有明顯的解熱效果。連翹抗菌的主要成分為連翹酚及揮發油,對金黃色葡萄球菌有很強的抑制作用,對其他致病菌、流感病毒及鉤端螺旋體也均有一定抑制作用,可解熱、抗炎[4]。已有研究顯示,柴胡注射液對LPS發熱模型大鼠有較好的解熱作用,其解熱效果可能與其抑制外周IL-1β、PGE2增加和下丘腦cAMP、PGE2釋放有關[5]。
TNF-α、IL-1β和IL-6是公認的可誘導發熱的重要炎性介質[6]。TNF-α是重要的內生致熱原之一,實驗證實干酵母致熱大鼠血清中TNF-α水平與體溫呈線性升高,經藥物干預后,體溫下降,且血清中TNF-α水平降低。IL-1β是目前較為公認的內生致熱原:研究證明,大鼠側腦室注射IL-1β能使體溫明顯升高,并使下丘腦升溫介質PGE2和cAMP釋放增多。包括TNF-α、IL-1β在內的EP能夠刺激多種細胞的花生四烯酸代謝,通過環氧化酶代謝途徑,使前列腺素(PG)生成增多。其中能夠引起體溫調定點升高的主要物質是PGE2,目前大多學者認為PGE2可能是致熱原引起發熱的主要介質[5]。左澤平等[7]研究發現,柴胡注射液抑制體外下丘腦神經細胞釋放PGE2,進一步證實了柴胡注射液的解熱作用可能與其抑制發熱中樞PGE2釋放有關。板藍根在體內外均能抑制炎癥介質(TNF-α,IL-6,IL-8,NO等)合成與釋放,阻滯其級聯反應,有利于控制過度的炎性反應,從而有效地控制病情,降低病死率[3]。
本研究發現,模型組血清IL-1β、TNF-α和IL-6水平均較對照組顯著升高(P<0.01),表明三者協同參與內毒素性發熱機制。清熱消炎顆粒高劑量組IL-1β、TNF-α和IL-6水平均顯著低于模型組(P<0.05),清熱消炎顆粒中劑量和低劑量組IL-1β、TNF-α和IL-6水平與模型組比較,差異均無統計學意義(P<0.05)。實驗表明,清熱消炎顆粒中、高劑量均有解熱作用,高劑量組的退熱療效及降低IL-1β、IL-6和TNF-α的作用最優。清熱消炎顆粒不僅有解熱功能,其部分機制可能與調控細胞因子網絡有關。
[1]孫衛民,王惠琴.細胞因子研究方法學[M].北京:人民衛生出版社,1999:587-587
[2]魏偉,吳希美,李元建.藥理實驗方法學[M].第4版.北京:人民衛生出版社,2010:64-65
[3] 方建國,劉云海,王文清,等.板藍根清熱解毒實質研究[J].中草藥,2008,39(3):321
[4] 李雪苓,韓寧林,徐桂琴,等.重連口服液對內毒素致熱新西蘭兔解熱作用及對血清TNF-α、IL-1β、IL-6表達水平的影響[J].安徽中醫藥大學學報,2014,33(5):63
[5] 左澤平,王志斌,高陽,等.柴胡注射液對LPS發熱大鼠解熱機制的研究[J].中藥藥理與臨床,2012,28(4):57
[6] Soares D M,Figueiredo M J,Martins J M,et al.A crucial role for IL-6 in the CNS of rats during fever induced by the injection of live E.coli[J].Med Microbiol Immunol,2012,201(1):47
[7] 左澤平,王志斌,高陽,等.柴胡注射液體外抑制PGE2釋放的生物活性測定法[J].中國中藥雜志,2013,38(22):3957
(2015-01-20收稿)
Preliminary study on the antipyretic effect of Qingrexiaoyan particles and its influence on TNF-α,IL-1β, IL-6,PGE2in serum
PANG Shu-wan1,LI Hong1,MU Yi1,DU Peng1,LI Juan1,FANG Zhi-zhong2
(1.Department of Pharmacy,The Second Hospital,Tianjin Medical University,Tianjin 300211,China;2.Department of Pharmacy, College of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics(Theranostics),Tianjin 300070,China)
Objective:To observe the antipyretic effect of Qingrexiaoyan particles on the pyrexial rabbits induced by endotoxin,and the influence on expression levels of TNF-α,IL-1β,IL-6,PGE2and further explore the antipyretic mechanism of Qingrexiaoyan particles.Methods:Thirty six rabbits with normal temperature were randomly divided into six groups:control group,model group,aspirin group, Qingrexiaoyan particles low dose group,middle dose group and high dose group.The fever models were induced by injecting endotoxin into the ear vein of rabbits after a lavage for drugs.Temperature was monitored separately before the administration and after the endotoxin injection 1,2,3,4 h.After endotoxin injection 4 h,the serum TNF-α,IL-1β,IL-6,PGE2levels were assayed.Results:Rectal temperature of Qingrexiaoyan particles middle dose group and high dose group increased continuously after the endotoxin injection,1,2,3,4 h after injection,rectal temperature were significantly lower than the model group(P<0.05或P<0.01).No significant difference was found between low-dose group and model group.After endotoxin injection 4 h,the serum TNF-α,IL-1β,IL-6,PGE2levels of model group were higher than the control group(P<0.01);compared with the model group,the TNF-α,IL-1β,IL-6,PGE2levels of high Qingrexiaoyanning particles dose group were significantly lower(P<0.05).Conclusion:The results show that Qingrexiaoyan particles middle dose group and high dose group have marked antipyretic effect but the low dose group has no such effect.The high-dose group of Qingrexiaoyan particles can significantly reduce the endogenous pyrogen of endotoxin-induced fever rabbits,such as TNF-α,IL-1β,IL-6 and PGE2.
Qingrexiaoyan particles;endotoxin;TNF-α;IL-1β;IL-6;PGE2;rabbit
R96
A
1006-8147(2015)06-0488-03
龐淑婉(1981-),女,主管藥師,碩士在讀,研究方向:臨床藥學;通信作者:房志仲,E-mail:fangzhizhong@tijmu.edu.cn。

