注射用頭孢噻肟鈉無菌檢驗的方法學確認
朱蓓芬
(上海新亞藥業有限公司,上海 201203)
0 引言
注射用頭孢噻肟鈉適用于敏感細菌所致的肺炎及其他下呼吸道感染、尿路感染、腦膜炎、敗血癥、腹腔感染、盆腔感染、皮膚軟組織感染、生殖道感染、骨和關節感染等。根據《中華人民共和國藥典》(2010年版)要求,需對其進行無菌檢驗。
新版GMP(2010年修訂)第223條規定,符合下列情形之一的,應當對檢驗方法進行驗證:(1)采用新的檢驗方法;(2)檢驗方法需變更的;(3)采用《中華人民共和國藥典》及其他法定標準未收載的檢驗方法;(4)法規規定的其他需要驗證的檢驗方法。
同時,《中華人民共和國藥典》(2010年版)要求,當建立產品的無菌檢查法時,應進行方法的驗證,以證明所采用的方法適用于該產品的無菌檢查。若該產品的組分或原檢驗條件發生改變時,應重新驗證檢查方法。
因此,當樣品檢驗條件或檢驗方法等發生改變時,必須對樣品進行無菌檢驗的方法驗證試驗。該驗證試驗主要針對該產品在該檢驗條件下的抑細菌、抑真菌活性及所用的無菌檢查法的可靠性進行驗證,以確認供試品在該檢查量、檢查條件下無抑菌活性或其抑菌活性已被充分消除到可以忽略不計。依據《中華人民共和國藥典》(2010年版)附錄(ⅪH)“無菌檢查法”,通過驗證試驗對該產品的檢查方法的可靠性及其結果的準確性予以確認。
1 試驗所用儀器、試藥、試劑、培養基與菌株
1.1 試驗所用儀器
集菌儀:HTY-601型,杭州泰林生物技術設備有限公司;一次性全封閉集菌培養器:NKF330型,杭州泰林生物技術設備有限公司;生物安全柜:B-2型,上海基匯生物科技有限公司;垂直流超凈工作臺:ZHJH-C2112B型,上海智城分析儀器制造有限公司;電熱恒溫培養箱:HHB11-600型,上海躍進醫療器械廠;脈動真空蒸汽滅菌柜:YXQ-MG-206Ⅱ型/YXQ-MG-206型/YXQ-MG-208型,江蘇張家港市華菱醫療設備制造有限公司;分析天平:FA1604S,上海天平儀器廠。
1.2 試驗所用試藥
注射用頭孢噻肟鈉:1.5 g,上海新亞藥業有限公司。
1.3 試驗所用試劑
蛋白胨(生化試劑):上海盛思生化科技有限公司;青霉素酶:蘇州金色譜生物技術有限公司;氯化鈉(分析純):宜興市達華化工有限公司;聚山梨酯-80(分析純):上海申宇醫藥化工有限公司。
1.4 試驗所用培養基
試驗所用培養基均來自北京三藥科技開發公司。硫乙醇酸鹽流體培養基(生化試劑);改良馬丁培養基(生化試劑);營養瓊脂培養基(生化試劑);改良馬丁瓊脂培養基(生化試劑)。
1.5 試驗所用菌株
試驗所用菌株均來自上海東方藥品科技實業有限公司。
金黃色葡萄球菌:CMCC(B)26003;大腸埃希菌:CMCC(B)44102;枯草芽孢桿菌:CMCC(B)63501;生孢梭菌:CMCC(B)64941;白色念珠菌:CMCC(F)98001;黑曲霉:CMCC(F)98003。(1)分裝于25 mm×150 mm小試管中,每管裝量9 m L,管口塞上硅膠塞;(2)分裝于500m L鹽水瓶中,每瓶裝量250m L或500m L,瓶口塞硅膠塞,加鋁蓋,用自動軋蓋機軋蓋,2~25℃保存。
2.1.1.3 含0.05%(V/V)聚山梨酯-80的0.9%無菌氯化鈉溶液(吐溫鹽水)
稱取氯化鈉9 g,加0.5m L聚山梨酯-80,加純化水1 000m L,加熱攪拌溶解。分裝于25mm×150mm小試管中,每管裝量9m L,管口塞上硅膠塞,2~25℃保存。
2.1.2 稀釋劑(試液)、沖洗劑(試液)的滅菌與使用范圍
稀釋劑(試液)、沖洗劑(試液)的滅菌與使用范圍如表1所示。
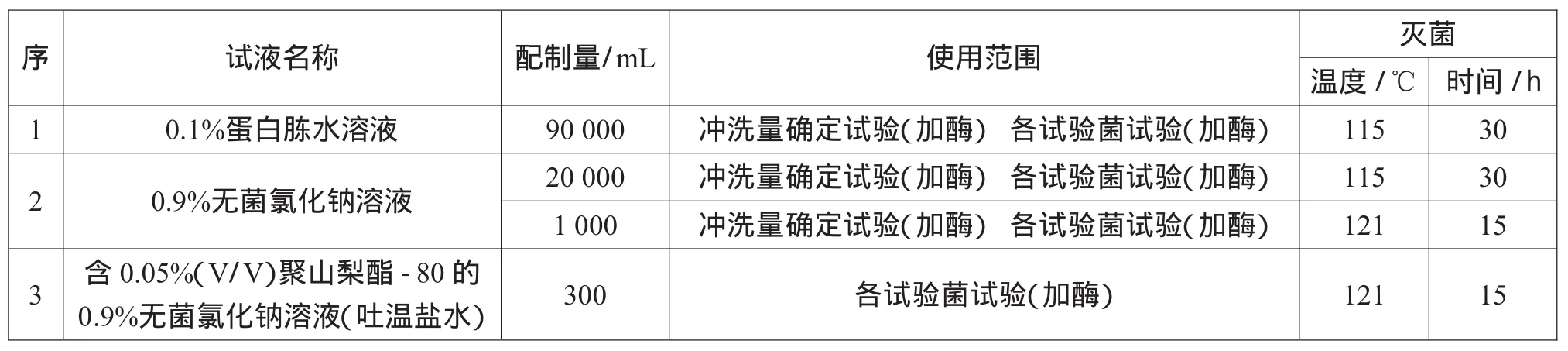
表1 稀釋劑(試液)、沖洗劑(試液)的滅菌與使用范圍
2 確認方法
2.1 稀釋劑(試液)、沖洗劑(試液)確認
2.1.1 稀釋劑(試液)、沖洗劑(試液)的配制
2.1.1.1 0.1%蛋白胨水溶液
稱取蛋白胨1.0 g,置1 000 m L搪瓷杯中,加純化水至1 000m L,微溫溶解,過濾。用6mol/L氫氧化鈉溶液調節pH,pH為6.9~7.2。分裝至500m L鹽水瓶中,分裝量500m L/瓶,瓶口塞硅膠塞,加鋁蓋,用自動軋蓋機軋蓋,2~25℃避光保存。
2.1.1.2 0.9%無菌氯化鈉溶液
稱取氯化鈉9 g,加純化水1 000m L,攪拌溶解。
2.2 培養基確認
2.2.1 培養基的配制
2.2.1.1 硫乙醇酸鹽流體培養基
稱取硫乙醇酸鹽培養基干粉29 g,加入純化水1 000m L,加熱攪拌至沸,使其溶解均勻。用2mol/L鹽酸或6 mol/L氫氧化鈉溶液調節pH,使滅菌后pH為6.9~7.3。100m L鹽水瓶分裝量100m L/瓶,250 m L鹽水瓶分裝量200 m L/瓶,瓶口塞硅膠塞,加鋁蓋,用自動軋蓋機軋蓋,2~25℃避光保存。
2.2.1.2 改良馬丁培養基
稱取改良馬丁培養基干粉28.5 g,加入純化水1 000m L,加熱攪拌至沸,使溶解均勻。用2mol/L鹽酸或6mol/L氫氧化鈉溶液調節pH,使滅菌后pH為6.2~6.6。100m L鹽水瓶分裝量100m L/瓶,瓶口塞硅膠塞,加鋁蓋,用自動軋蓋機軋蓋,2~25℃避光保存。
2.2.1.3 營養瓊脂培養基
稱取營養瓊脂干粉32 g,加入純化水1 000m L,加熱攪拌至沸,使其溶解均勻。用2 mol/L鹽酸或6mol/L氫氧化鈉溶液調節pH值,使滅菌后pH值為7.0~7.4。
滅菌雙碟分裝量20m L/只,冷卻凝固后,翻轉移至30~35℃恒溫培養箱中培養48 h,檢查無菌即可使用,2~25℃避光保存。
2.2.1.4 改良馬丁瓊脂培養基
稱取改良馬丁瓊脂干粉42g,加入純化水1000m L,加熱攪拌使其至沸,使其溶解均勻。用2 mol/L鹽酸或6 mol/L氫氧化鈉溶液調節pH值,使滅菌后pH值為6.2~6.6。
滅菌雙碟分裝量20m L/只,冷卻凝固后,翻轉移至23~28℃恒溫培養箱中培養72 h,檢查無菌即可使用,2~25℃避光保存。
2.2.2 培養基的滅菌與使用范圍
培養基的滅菌與使用范圍如表2所示。成1m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.1.2 大腸埃希菌
接種大腸埃希菌的新鮮培養物1環至9m L 0.9%氯化鈉溶液中,用0.9%氯化鈉溶液制成1 m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.1.3 枯草芽孢桿菌
枯草芽孢桿菌的新鮮培養物用9m L 0.9%無菌氯化鈉溶液洗脫,用0.9%氯化鈉溶液制成1m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.1.4 生孢梭菌
生孢梭菌的新鮮培養物用0.9%氯化鈉溶液制成1m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.1.5 白色念珠菌
白色念珠菌的新鮮培養物用9m L 0.9%無菌氯化鈉溶液洗脫,用0.9%氯化鈉溶液制成1 m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.1.6 黑曲霉
黑曲霉用含0.05%(V/V)聚山梨酯-80的0.9%無菌氯化鈉溶液洗脫,制成黑曲霉孢子液,用9m L含0.05%(V/V)聚山梨酯-80的0.9%無菌氯化鈉溶液制成1m L含10~100 cfu的菌懸液,2~8℃保存。
2.3.2 活菌計數

表2 培養基的滅菌與使用范圍
2.3 菌液制備的確認
2.3.1 菌液制備方法
2.3.1.1 金黃色葡萄球菌
接種金黃色葡萄球菌的新鮮培養物1環至9 m L 0.9%氯化鈉溶液中,用0.9%氯化鈉溶液制
打開薄膜過濾器蓋子,加入50m L 0.1%蛋白胨水溶液,加入1m L含<100 cfu的金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、生孢梭菌、白色念珠菌、黑曲霉的菌液,旋緊薄膜過濾器的蓋子,打開抽濾泵過濾,待液體完全抽干后,擰開薄膜,用鑷子拿掉墊圈并取出薄膜。金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、生孢梭菌菌面朝上貼于營養瓊脂培養基,白色念珠菌、黑曲霉菌面朝上貼于改良馬丁瓊脂培養基,將培養皿蓋蓋好。將金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、生孢梭菌的培養皿倒置于30~35℃培養箱中培養24 h,將白色念珠菌、黑曲霉的培養皿倒置于23~28℃培養箱中培養48 h,計數。
2.4 沖洗量的確定(加酶試驗)
取注射用頭孢噻肟鈉30瓶,取全量,溶解于500m L 0.9%氯化鈉溶液中作為供試液(供試品含量為0.09 g/m L)。取供試液50m L(相當于供試品4.5 g,符合藥典規定的檢驗量0.15 g/瓶×30瓶)至3張薄膜,過濾后,用1 500m L、2 000m L兩個沖洗量的0.1%蛋白胨水溶液沖洗濾膜(單張薄膜沖洗量為500 m L、667m L),將沖洗液抽干,用針筒抽取青霉素酶6m L至300m L硫乙醇酸鹽流體培養基中,用雙芯針頭取300m L硫乙醇酸鹽流體培養基后,將軟管剪斷,用針筒抽取1m L含10~100 cfu試驗菌加入全封閉集菌培養器中,軟管套于空氣濾器開口上,放入30~35℃培養箱培養,每天觀察培養結果。觀察培養結果詳細記錄從略。
2.5 無菌試驗(加酶)
2.5.1 酶驗證試驗組
取注射用頭孢噻肟鈉30瓶,取全量,溶解于500 m L 0.9%氯化鈉溶液中作為供試液(供試品含量為0.09 g/m L)。
取供試液50m L(相當于供試品4.5 g,符合藥典規定的檢驗量0.15 g/瓶×30瓶)至3張薄膜,過濾后,單張薄膜用667m L 0.1%蛋白胨水溶液沖洗濾膜,將沖洗液抽干,用針筒抽取青霉素酶4 m L至200 m L硫乙醇酸鹽流體培養基、抽取2 m L至100 m L改良馬丁培養基中,用雙芯針頭取200 m L硫乙醇酸鹽流體培養基、100m L改良馬丁培養基后,將軟管剪斷,用針筒抽取1m L含10~100 cfu試驗菌加入全封閉集菌培養器中,軟管套于空氣濾器開口上,放入培養箱培養5 d,每天觀察培養結果。
2.5.2 酶驗證稀釋劑對照組
用500m L 0.9%氯化鈉和2 000m L 0.1%蛋白胨水溶液沖洗濾膜,將沖洗液抽干,用針筒抽取青霉素酶4m L至200 m L硫乙醇酸鹽流體培養基、抽取2m L至100m L改良馬丁培養基中,用雙芯針頭取200m L硫乙醇酸鹽流體培養基、100m L改良馬丁培養基后,將軟管剪斷,用針筒抽取1 m L含10~100 cfu試驗菌加入全封閉集菌培養器中,軟管套于空氣濾器開口上,放入培養箱培養5 d,每天觀察培養結果。
2.5.3 酶驗證菌液組
將10~100 cfu試驗菌直接加入硫乙醇酸鹽流體培養基或者改良馬丁培養基中,培養5 d,觀察結果。
2.5.4 培養方法
培養方法如表3所示。
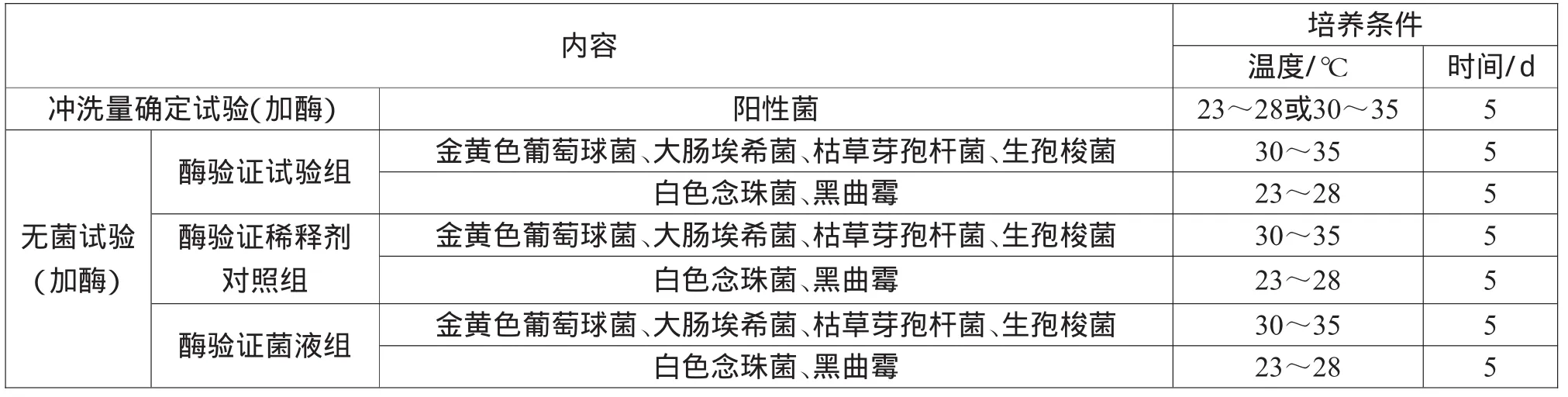
表3 培養方法
2.5.5 觀察記錄
注射用頭孢噻肟鈉(1.5 g)無菌試驗(加酶)原始記錄從略。
3 確認結果與總結
3.1 確認結果
3.1.1 沖洗量確定試驗(加酶)
沖洗量確定試驗操作方法進行兩次獨立的平行試驗。兩次試驗中:單張膜為667m L 0.1%蛋白胨水溶液的沖洗量,能使陽性菌生長良好;單張膜為500 m L 0.1%蛋白胨水溶液的沖洗量,陽性菌生長緩慢。因此,選用單張膜為667m L 0.1%蛋白胨水溶液的沖洗量作為各試驗菌試驗的沖洗量。
3.1.2 無菌試驗(加酶)
無菌試驗操作方法分3組進行兩次獨立的平行試驗。其中,酶驗證試驗組:所有試驗菌均生長良好;酶驗證稀釋劑對照組:所有試驗菌均生長良好;酶驗證菌液組:所有試驗菌均生長良好。因此,檢驗方法成立,可按該方法對供試品進行無菌檢查。
3.2總結
(1)該方法確認結果可行,確認過程符合《中華人民共和國藥典》(2010版)與新版GMP要求。
(2)注射用頭孢噻肟鈉無菌檢驗方法可制訂如下:取注射用頭孢噻肟鈉30瓶,取全量,溶解于500 m L 0.9%氯化鈉溶液中作為供試液(供試品含量為0.09 g/m L)。取供試液50 m L(相當于供試品4.5 g,符合藥典規定的檢驗量0.15 g/瓶×30瓶)至3張薄膜,過濾后,單張薄膜用667m L 0.1%蛋白胨水溶液沖洗濾膜,將沖洗液抽干,用針筒抽取青霉素酶4 m L至200 m L硫乙醇酸鹽流體培養基、抽取2 m L至100m L改良馬丁培養基中,然后用夾子夾住其中一根軟管,用雙芯針頭取200m L硫乙醇酸鹽流體培養基至其中兩個全封閉集菌培養器中,再用夾子夾住另兩根軟管,用雙芯針頭取100m L改良馬丁培養基至另一個集菌培養器中,然后將集菌培養器上軟管剪斷,其中一個裝有硫乙醇酸鹽流體培養基和另一個裝有改良馬丁培養基的集菌培養器,軟管套于全封閉集菌培養器的空氣過濾口上,置培養房中培養14 d,觀察結果。另一個裝硫乙醇酸鹽流體培養基的集菌培養器中注入10~100 cfu大腸埃希菌作為陽性對照。
[1]國家藥典委員會.中華人民共和國藥典(2010版)[S].北京:中國醫藥科技出版社,2010.
[2]國家食品藥品監督管理局藥品認證管理中心.藥品GMP指南:質量控制實驗室與物料系統[M].北京:中國醫藥科技出版社,2011.
[3]藥品生產質量管理規范(2010年修訂)[S],2011.

