離子濃度大小比較的教學策略及教學題組設計
管建華
(江蘇省如東高級中學 江蘇 如東 226400)
一、教學背景
離子濃度大小比較問題是高考的“熱點”之一。決定離子濃度大小的因素很多,比如溶解度、物質的量濃度、電離、水解程度、化學反應等。該類題考查知識點多,靈活性、綜合性較強,有較好的區分度,可有效地考查考生對強弱電解質、電離平衡、水的電離、溶液的pH、鹽類水解等基本概念的掌握程度及對這些知識的綜合運用能力。在教學過程中, 如果教師不能提綱挈領,抓住解決問題的關鍵,學生就會如霧里看花,錯誤率高。所以,離子濃度大小比較問題一直是教學的重點和難點。
二、教學策略
1.構建思維基點
(1)電離理論
①強電解質完全電離,弱電解質部分電離,弱電解質電離消耗的電解質及產生的微粒都是少量的,同時注意考慮水的電離的存在。例如NH3·H2O 溶液中微粒濃度大小關系是c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
②多元弱酸的電離是分步的,其主要是第一級電離(第一步電離程度遠大于第二步)。如在H2CO3溶液中:H2CO3、HCO3-、CO32-、H+的濃度大小關系是c(H2CO3)>c(H+)>c(HCO3-)>c(CO32-)。
(2)水解理論
①弱電解質離子的水解損失是微量的(相互促進水解除外),但由于水的電離,故水解后酸性溶液中c(H+)或堿性溶液中c(OH-)總是大于水解產生的弱電解質溶液的濃度。如NH4Cl 溶液中:NH4+、Cl-、NH3·H2O、H+的濃度大小關系是c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)。
②多元弱酸酸根離子的水解是分步進行的,其主要是第一步水解, 如在Na2CO3溶液中:CO32-、HCO3-、H2CO3、OH-的濃度大小關系應是c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)。
2.把握三種守恒
(1)電荷守恒規律
電解質溶液中,無論存在多少種離子,溶液都是呈電中性,即陰離子所帶負電荷總數一定等于陽離子所帶正電荷總數。如Na2CO3溶液中存在著Na+、H+、HCO3-、CO32-、OH-,存在如下關系:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。
(2)物料守恒規律
電解質溶液中,由于某些離子能夠水解,離子種類增多,但元素總是守恒的。如Na2CO3溶液中CO32-、HCO3-都能水解, 故C 元素以CO32-、HCO3-、H2CO3三種形式存在,它們之間有如下守恒關系:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]。
(3)質子守恒規律
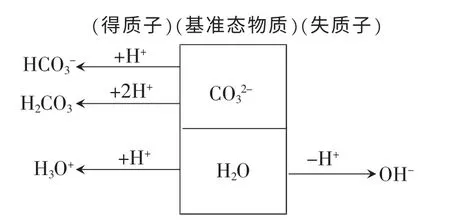
由圖可得Na2CO3水溶液中質子守恒式可表示為:c(H3O+)+2c(H2CO3)+c(HCO3-)=c(OH-)或c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)。質子守恒的關系式也可以由電荷守恒式與物料守恒式推導得到。試題中出現的特殊守恒關系的判斷往往借助電荷守恒與物料守恒的推導。
3.掌握分析方法
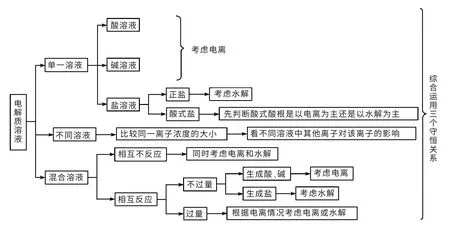
三、教學題組設計
新行為主義心理學創始人斯金納認為,教學成功的關鍵就是精確地分析強化效果并設計特定的強化關聯。其程序教學法要求:把教學材料科學的分解成循序漸進而又有機相互聯系的程序性小問題,以便學生總是能積極反應,及時反饋學習成果。筆者對高考及模考試題進行系統解構,縱觀全局,對離子濃度大小比較問題進行關聯整理、分析比較,按照一定的邏輯順序,設計如下分類教學題組。
1.單一溶質溶液中離子濃度大小的比較
對于單一溶質溶液中離子濃度大小判斷,首先確定是酸、堿或者鹽溶液,如果是酸、堿溶液,只需要考慮酸、堿的電離及水的電離;如果是鹽溶液,首先考慮鹽完全電離(絕大多數鹽是強電解質),然后再考慮弱離子的水解,如果是酸式鹽,還要考慮酸式根離子的電離和水解。
[例題1](2004年江蘇高考第17 題)草酸是二元弱酸,草酸氫鉀溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列關系正確的是 ( )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
[解析]A.根據電荷守恒c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),A 錯誤;B.根據物料守恒c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1 mol·L-1,B 項錯誤;C.因為草酸氫鉀呈酸性,所以HC2O4-電離程度大于水解程度,故c(C2O42-)>c(H2C2O4),C 項正確;D.依據物料守恒,D 項正確。
值得注意的是,弱酸酸式鹽溶液中離子濃度大小比較往往有分歧,如NaHCO3溶液,常見的觀點有兩種:1.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),觀點1認為水電離產生了H+,所以c(H+)>c(CO32-),事實上因為HCO3-水解大于電離,溶液顯堿性,溶液中H+被OH-中和,故一般情況下c(CO32-)>c(H+),以上結論也可由H2CO3的一級、二級電離平衡常數推導得出,所以觀點2 更符合事實。建議在中學教學中此類問題應該回避,不能誤導學生。
2.不同溶液中同一離子濃度大小的比較
首先要分析不同溶液中溶質是強電解質還是弱電解質,相同濃度的溶液中,通常強電解質電離出離子濃度大于弱電解質,然后同類型進行比較,再觀察不同溶液中其它離子對該離子濃度大小的影響,是促進電離(或水解),還是抑制電離(或水解)。
[例題2]在相同物質的量濃度的下列溶液中:
①NH4Cl ②NH4HSO4
③CH3COONH4④NH3·H2O
c(NH4+)由大到小的順序為__________。若再補充等濃度的兩種溶液⑤(NH4)2SO4⑥(NH4)2Fe(SO4)2結果為_________________________。
[解析]NH4Cl、NH4HSO4和CH3COONH4均為強電解質溶液完全電離,而NH3·H2O 為弱電解質,少部分電離出NH4+,所以④中c(NH4+)最小。①②③中存在NH4+的水解平衡:NH4++H2O?NH3·H2O+H+, ②中H+抑制NH4+的水解,所以②中c(NH4+)較大;③中CH3COO-與NH4+相互促進水解,所以③中c(NH4+)相對較小,答案為②①③④。
(NH4)2SO4和(NH4)2Fe(SO4)2的組成中所含NH4+數目為①②③的兩倍,所以其同濃度鹽溶液中c(NH4+)大于①②③中c(NH4+)。(NH4)2Fe(SO4)2中的兩種陽離子NH4+和Fe2+相互抑制水解,從而(NH4)2Fe(SO4)2中c(NH4+)大于⑤中c(NH4+),答案為⑥⑤②①③④。
3.兩種溶液混合后不同離子濃度大小的比較
首先要分析混合過程中是否發生化學反應,若發生反應,則要進行過量判斷, 然后考慮物質在水溶液中的電離及可能存在的電離平衡、水解平衡以及抑制水解等問題,同時要注意混合后溶液體積的變化。
(1)酸堿中和型
①恰好中和型:給定的酸堿是等物質的量的反應(注意與常溫下酸堿pH 之和等于14 的情況區別),反應結束后一定是生成正鹽和水,故可把此類問題轉化成是正鹽溶液中離子濃度比較問題來解決。
②pH 等于7 型:酸堿中和反應(注意與恰好中和型區別)結束后一定是c(H+)=c(OH-),故分析此類問題從兩方面入手:考慮從電荷守恒入手求得其它離子等量關系;判斷pH 等于7 時,酸堿到底誰過量。
③反應過量型: 先判斷反應后混合溶液的組成,再考慮溶質(產物及過量物質)電離或水解的情況。
[例題3](2014年廣東高考第12 題)常溫下,0.2mol·L-1的一元酸HA 與等濃度的NaOH 溶液等體積混合后,所得溶液中部分微粒組分及濃度如下圖所示,下列說法正確的是 ( )
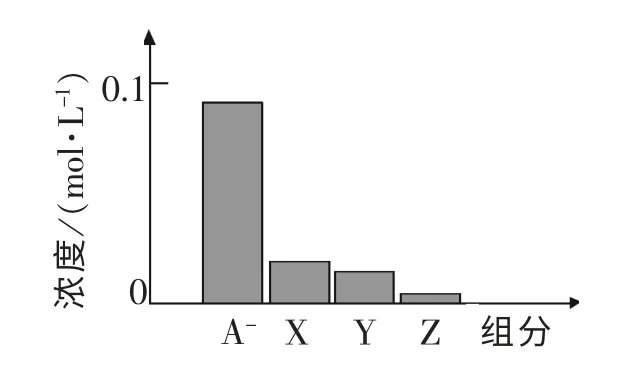
A.HA 為強酸
B.該混合液pH=7
C.圖中X 表示HA,Y 表示OH-,Z 表示H+
D.該混合溶液中:c(A-)+c(Y)=c(Na+)
[解析]A.一元酸HA 與等濃度的NaOH 溶液等體積混合后,兩者恰反應,溶液中只有溶質NaA 且濃度為0.1 mol·L-1(注意混合后溶液體積變為兩倍)。由圖中A-離子濃度小于0.1mol·L-1,說明A-離子發生了水解,從而可知HA 是弱酸,故A 錯誤;B.水解顯堿性pH>7,B 錯誤;C.溶液中除Na+,其它離子大小為c(A-)>c(OH-)>c(HA)>c(H+)可知C 錯誤;D.由物料守恒知D 正確。
[例題4](2015年泰州二模第15 題) 常溫下,一元酸HA 溶液和NaOH 溶液等體積混合(忽略體積變化),實驗數據如下表:
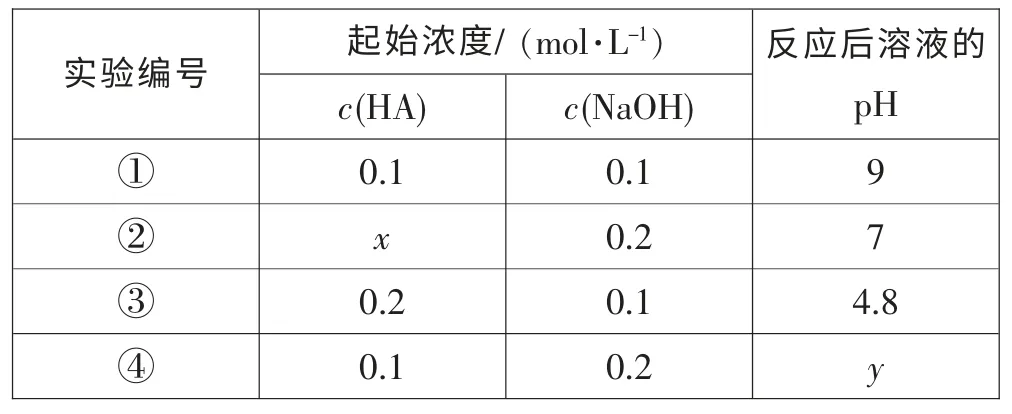
實驗編號 起始濃度/ (mol·L-1) 反應后溶液的pH c(HA) c(NaOH)①0.1 0.1 9②x 0.2 7 0.2 0.1 4.8④0.1 0.2 y③
下列判斷正確的是 ( )
B.實驗②反應后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-)
C.實驗③反應后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-)
D.實驗④反應后的溶液中:c(OH-)-c(H+)-c(HA)=0.05 mol·L-1
[解析]A.①中剛好生成NaA,A-水解方程式為A-+H2O?HA+OH-,c(HA)≈c(OH-)=Kw/c(H+)=Kw/10-9mol·L-1,A 正確;B.由③知,反應后溶液為c(HA)∶c(NaA)=1∶1,溶液的pH=4.8,顯酸性,所以HA 的電離大于A-的水解,則有c(A-)>c(Na+)>c(HA),而②中c(HA)小于0.2 mol·L-1,則c(HA)<c(NaA),所以c(Na+)>c (HA),B 錯誤;C.電荷守恒有:c (Na+)+c (H+)=c(OH-)+c(A-),而c(Na+)>c(HA),所以c(HA)+c(H+)<c(OH-)+c(A-),C 錯誤;D.反應后的溶液為c(NaOH)∶c(NaA)=1∶1,由物料守恒:c(Na+)=2c(A-)+2c(HA),結合電荷守恒方程式,消去c(Na+),得c(A-)+2c(HA)+c(H+)=c(OH-),由A 元素的物料守恒:c(A-)+c(HA)=0.1/2=0.05 mol·L-1,再消去c(A-),得c(OH-)-c(H+)-c(HA)=c(A-)+c(HA)=0.05 mol·L-1,D 正確。
(2)鹽與酸(堿、鹽)混合型
先判斷反應后混合溶液的組成,再考慮溶質(產物及過量物質)電離或水解的情況。當酸(堿)的電離大于鹽溶液中弱離子水解時,此時主要考慮電離對離子濃度造成的影響;反之可認為主要考慮離子水解對離子濃度造成的影響。
[例題5](2014年江蘇高考第14 題)25℃時,下列有關溶液中微粒的物質的量濃度關系正確的是
A.0.1mol/LCH3COONa 與0.1mol/LHCl 溶液等體積混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl 與0.1mol/L 氨水等體積混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3與0.1mol/L NaHCO3溶液等體積混合
D.0.1mol/LNa2C2O4與0.1mol/LHCl 溶液等體積混合(H2C2O4為二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
[解 析]A.0.1mol/L CH3COONa 與0.1mol/L HCl等體積恰好反應混合生成醋酸和氯化鈉,醋酸電離溶液顯酸性,則c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A正確;B.0.1mol/L NH4Cl 與0.1mol/L 氨水等體積混合(pH>7),這說明溶液顯堿性,因此氨水的電離程度大于銨根的水解程度,則c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),B 錯 誤;C.0.1mol/L Na2CO3與0.1mol/L NaHCO3溶液等體積混合,根據物料守恒可知正 確;D.0.1mol/L Na2C2O4與0.1mol/L HCl 溶液等體積混合(H2C2O4為二元弱酸),二者恰好反應生成草酸氫鈉和氯化鈉,則根據電荷守恒可知溶液中2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),D 不正確,答案為AC。
[例 題6](2012年 江蘇高考第15題)25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一組醋酸和醋酸鈉混合溶液,溶液中c(CH3COOH)、c(CH3COO-)與pH 值的關系如圖所示。下列有關離子濃度關系敘述正確的是 ( )
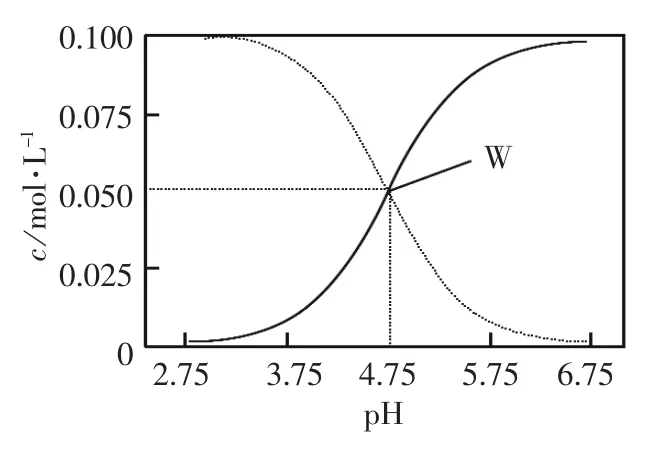
A.pH=5.5 溶液中:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 點表示溶液中:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH=3.5 溶液中:
c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W 點所表示溶液中通入0.05mol HCl 氣體(溶液體積變化可忽略):c(H+)=c(CH3COOH)+c(OH-)
[解析]A.pH=5.5 比4.75 大, 從曲線來看CH3COOH的電離在增大,CH3COO-的水解在減小,不可能出c(CH3COOH)>c(CH3COO-);B.W 點表示溶液中,根據電荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)正確;C.pH=3.5 溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把題干中的c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1代入即可;D.向W 點所表示溶液中通入0.05mol HCl 氣體,原有平衡被打破,建立起了新的平衡。溶液中電荷守恒關系為:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒關系為2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1,不可能得出上述結論。所以綜合上述B、C 正確。
四、教學反思
中學化學中有較多識記類知識,比如元素化合物知識,可以憑借記憶、經驗思維解決問題。而離子濃度大小比較屬于基本理論范疇,解決此類問題需要較強的邏輯思維能力,要立足三個思維基點:電離、水解和守恒(電荷守恒、物料守恒及質子守恒),分清電離、水解的主次關系,仔細審題,注意題干中的關鍵信息,同時要靈活運用多種解題方法,如:淘汰法、定理問題定性比(先判斷堿酸性)、整體思維法等。反思該教學題組設計,目標明確、重點突出、分類合理、模型簡明、內涵完整,學生在課堂上能作出積極回應,取得較好的教學效果。
[1]梁雙霞.離子濃度大小比較的技巧與方法[J].中學生數理化(高考版),2012,(Z2):59-60
[2]王領軍.溶液中離子濃度大小比較[J].化學教育,2006,(9):53-54

