國內小容量注射劑立式洗瓶機的清洗工藝及其改進
沈鳴之
(上海理工大學,上海200093)
0 引言
隨著國內制藥行業的發展,目前用于生產小容量注射劑的立式洗瓶機(以下簡稱為洗瓶機)已大規模普及。由于目前國內的立式洗瓶機是在德國BOSCH公司與B+S公司的回轉式洗瓶機的基礎上改制而成,因此目前除沿用最初的清洗安瓿瓶的工藝流程外,已根據國內情況演變出另兩種清洗流程。清洗工藝流程根據機型運動方式的不同,應用于不同的藥品包材,但國內存在因商業宣傳而誤導藥品生產企業選型的現象,使得藥品生產企業在訂立URS時有些盲目。筆者認為,應根據藥品生產企業自身的工藝與產品需求,正確地選擇洗瓶機清洗工藝與所適用的機型。
由于國內針對洗瓶機清洗工藝的行業標準與規范較為零散,本文對應需滿足的工藝參數進行了羅列,并說明了洗瓶機在調試環節中的驗證要點,希望設備生產廠家在此基礎上,不斷提高自身的企業規范與標準。
本文還重點介紹了目前國內部分廠家正在積極研發的硅化工藝裝置,研發此項目需制造硅化工藝實驗平臺,筆者認為需弄清此工藝中所涉及的相關參數后,再制造工業應用級別的硅化工藝裝置。
1 洗瓶機現有清洗工藝流程
1.1 BOSCH清洗工藝流程
BOSCH清洗工藝流程(循環水—循環水—潔凈壓縮空氣—注射用水—潔凈壓縮空氣—潔凈壓縮空氣),如圖1所示。
(1)超聲波清洗:藥瓶進入超聲波水池后,利用超聲波空化作用將藥瓶上附著的微粒振松;
(2)循環水內外沖洗:對藥瓶內外的附著微粒進行第一次粗洗;
(3)循環水內沖洗:對藥瓶內附著微粒進行第二次粗洗;
(4)潔凈壓縮空氣內沖洗:吹干上一步殘留在藥瓶內的循環水;
(5)注射用水內沖洗:對藥瓶內附著微粒進行精洗;
(6)潔凈壓縮空氣內沖洗:吹干殘留在藥瓶內的注射用水;
(7)潔凈壓縮空氣內外沖洗:吹干殘留在藥瓶內的注射用水。
1.2 A型清洗工藝流程
經過演變后的A型清洗工藝流程(循環水—潔凈壓縮空氣—降級水—潔凈壓縮空氣—注射用水—潔凈壓縮空氣),如圖2所示。
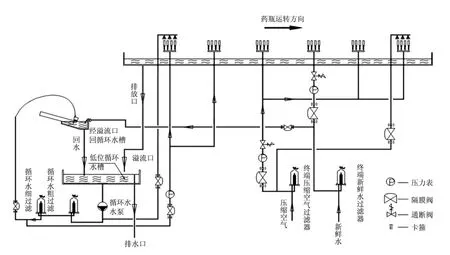
圖1 BOSCH基本清洗工藝流程
(1)超聲波清洗;
(2)循環水內外沖洗;
(3)潔凈壓縮空氣內沖洗;
(4)注射用水降級水內沖洗;
(5)潔凈壓縮空氣內沖洗;
(6)注射用水內沖洗;
(7)潔凈壓縮空氣內外沖洗。
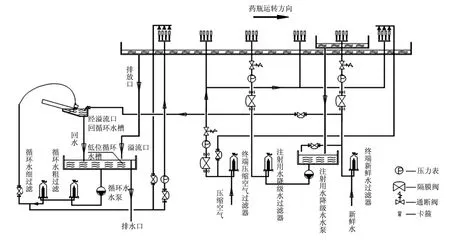
圖2 A型清洗工藝流程
1.3 B型清洗工藝流程
另一種演變后的B型清洗工藝流程(循環水—潔凈壓縮空氣—循環水—潔凈壓縮空氣—注射用水—潔凈壓縮空氣),如圖3所示。
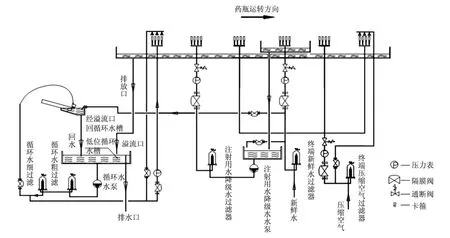
圖3 B型清洗工藝流程
(1)超聲波清洗;
(2)循環水內外沖洗;
(3)注射用水降級水內沖洗;
(4)潔凈壓縮空氣內沖洗;
(5)注射用水內沖洗;
(6)潔凈壓縮空氣內沖洗;
(7)潔凈壓縮空氣內外沖洗。
1.4 3種清洗工藝流程的來源、適用范圍與理論依據
經相關資料研究后發現,A型清洗工藝流程仿照的是德國B+S公司的FAW1120型回轉式洗瓶機(圖4),該機型相較BOSCH連續運動機型的特點是噴針針架間歇性運動,噴針只需進行上下運動,而無需循環擺動。
在實際生產中若使用此工藝流程搭配連續運動機型的傳動結構會遇到兩個問題:其一,會發現安瓿瓶或小口徑的抗生素瓶清洗完成后,瓶內的水殘留量很難達標,出現這一問題的原因是噴針針架的連續運動未給予藥瓶內的殘留液體足夠的時間流出,且最后只有一道吹氣迫水工藝,更加劇了這一情況的發生。其二,針架在高速運動過程中,若注射用水回水盤設計過小,可能造成注射用水收集過少;若注射用水回水盤設計過大,則可能造成注射用水降級水的混入。

圖4 FAW1120型回轉式洗瓶機
根據以上分析可以得出:A型清洗工藝流程搭配的洗瓶機機型應是間歇運動型,適用于處理口徑較大的抗生素瓶等藥瓶容器。
B型清洗工藝流程是為了解決A型清洗工藝流程搭配連續運動機型后瓶內水殘留量很難達標這一問題而改進的。清洗工藝流程的最后兩道工序都改為了對藥瓶進行潔凈壓縮空氣內沖洗,增強了吹氣迫水的功效。另一問題的解決辦法是在實際生產過程中降低設備的速度,從而對針架進行減速,避免清洗介質混入注射用水回水盤中。據此得出:B型清洗工藝流程搭配的洗瓶機機型可以是連續運動型,適用于處理大多數的安瓿瓶與抗生素瓶。
研發與應用一個新型的工藝流程,無非是因為先前的工藝流程在某些方面不能滿足現有市場中客戶的需求、行業規范與國家標準,或者出于規避侵犯專利的目的等因素。B+S公司設計A型清洗工藝流程的目的在于:當前市場中連續運動型洗瓶機不能完全滿足清洗所有規格尺寸的抗生素瓶的需求。當清洗容積超過30mL的抗生素瓶時,既要合理減少清洗藥瓶的時間,增加處理藥瓶的產量,又要保證藥瓶的清洗效果。B+S公司便使用了間歇運動型結構的洗瓶機,保證了足夠的時間用于清洗不同容積大小的藥瓶。另外,使用3種潔凈度逐次增加的清洗介質(循環水、注射用水降級水、注射用水)比使用兩種潔凈度逐次增加的清洗介質(循環水、注射用水)更能保證藥瓶的清洗效果。
2 洗瓶機清洗流程應滿足的工藝參數與驗證
2.1 清洗流程應滿足的工藝參數
2.1.1 洗瓶速度符合產量要求
根據設備選型的不同與所清洗的包材規格尺寸的差異,洗瓶速度有非常大的區別。因此在驗證洗瓶速度時,應先確定以上兩個條件,并以擴大20%的實際產量來選型設備,以預留部分產能。
2.1.2 藥瓶破損率
抗生素瓶:清洗機在額定速度運轉狀態下,統計15min內的破損瓶總數與進瓶總數,按下式計算:
破損率(%)=(破損瓶總數/進瓶總數)×100%
安瓿瓶:清洗機負載工作時,隨機連續統計15min內的進瓶總數和出瓶總數,按下式計算:破瓶率(%)=[(進瓶數-出瓶數)/進瓶數]×100%
2.1.3 可見異物的檢測
安瓿瓶:按《中華人民共和國藥典》(2010版)二部中附錄ⅨH“可見異物檢查法”進行檢定。抗生素瓶:在清洗機出瓶口隨機抽取100個樣瓶,向瓶內注入注射用水,按《中華人民共和國藥典》(2005版)二部ⅨH“可見異物檢查法”的燈檢法進行檢測。
2.1.4 不溶性微粒
《中華人民共和國藥典》(2010版)二部附錄ⅨC“不溶性微粒檢查法”;《中國藥品檢驗標準操作規范》(2010版)第249頁“不溶性微粒檢查法”。
2.1.5 滅菌性試驗
符合《中華人民共和國藥典》(2010版)ⅪJ“微生物限度檢查法”要求,作為清洗挑戰性試驗。
2.1.6 殘留水量的檢測
標準:洗瓶機空瓶內不掛水珠。
在此需要說明的是,本節中2.1.2、2.1.3、2.1.4均摘錄自JBT20092—2007抗生素瓶立式超聲波洗瓶機與JB/T20002.2—2011安瓿超聲波清洗機中的條款。根據無菌生產工藝的流程,第5項檢測放在藥瓶經過滅菌烘箱后比較適宜,并以此作為最終標準。若藥瓶生產廠家條件允許,可提高檢測要求。第6項檢測由于缺少能夠進行定量分析的檢測設備,目前基本采用的是生產現場目測定性檢測。
2.2 洗瓶機調試時的驗證要點
在設備生產廠家中,由于缺少標準化的潔凈廠房與所需檢測儀器,造成不能直接檢測熱原或細菌內毒素等物化指標。因此,改為檢測設備所能達到的工藝參數為主。《制藥工藝驗證實施手冊》所列出的洗瓶機驗證(包括但不限于)的項目是:
2.2.1 清洗時間的確認
基于不同的藥瓶規格,洗瓶機的清洗時間是不同的。在調試驗證時,一定要驗證隨機主規格的藥瓶清洗時間。合理的清洗時間能夠保證藥瓶達到預期的清洗效果,減少可見異物與不溶性微粒,且瓶內沒有殘存水。
2.2.2 空氣壓力和水壓力的確認
空氣壓力和水壓力是保證洗瓶機清洗工藝達到預期的基本參數。如果壓力達不到標準,噴射的水流不能有效去除藥瓶內的可見異物與不溶性微粒,噴射的氣流不能清除瓶內的殘存水。配合PLC控制系統的使用,在空氣壓力和水壓力過低或過高時具有報警、停機等功能。
在此過程中所記錄的流體壓力數據可與所模擬的數據進行對照,完善模擬參數接近實驗數據,或優化管路設備達到理想模擬狀態。最終,確認管路系統的實際效果達到設計要求,完成閉環驗證。
2.2.3 水溫的確認
由于藥廠自身管路的設置,不同清洗介質的水溫是有所差異的。洗瓶機清洗工藝中所使用的軟管能夠承受的溫度不超過80℃,針對溫度過高的注射用水與純化水,藥廠需配備降溫設備。洗瓶機水槽內水溫應控制在50~60℃,這一要求針對的是洗瓶機中的循環水,此水溫可有效配合超聲波的空化效應。在調試階段對水溫的驗證確認,其實質是查看在此水溫下,設備的運行情況,所用零件材質是否達到要求,調節水溫的控制系統是否運行正常具有報警、停機等功能。
2.2.4 循環次數
這里的循環次數是指清洗工藝所用到的清洗介質與清洗流程是否符合藥廠生產商在URS(用戶需求說明)中提到的要求。
2.2.5 可見異物、不溶性微粒、熱原或細菌內毒素的確認
目前,對可見異物、不溶性微粒的檢測,設備生產廠家使用人眼目測居多。由于缺少標準化的潔凈廠房與所需檢測儀器,即使檢測了這些物化指標,也僅能將此類數據作為參考。當設備放入藥廠生產商的標準化潔凈廠房后,經過消毒除菌,需再次驗證。
3 卡式瓶的硅化
3.1 卡式瓶的硅化站系統
近年來一種新型的包材卡式瓶(筆式注射器用硼硅玻璃套管)在高附加值的藥品領域被用來替代安瓿用作藥液包材。
安瓿瓶清洗工藝流程與卡式瓶清洗工藝流程的區別在于卡式瓶需使用醫用硅油對內壁做硅化處理,目的是使后續壓入瓶內的膠塞具有良好的滑動性。工業生產型硅化站(圖5)在立式洗瓶機的模塊化設計中屬附加裝置,是近期國內立式洗瓶機生產廠家更新洗瓶機清洗工藝的一大重點項目。
考慮到目前國內的機械制造水平,硅化站系統搭配的洗瓶機機型必須是間歇運動型,藥瓶在硅化工位靜止不動,噴射針架只做上下運動,不跟隨擺動,只有這樣才能保證噴射效果的穩定。
目前,已有國外針對卡式瓶硅化工藝的研究,其方式是搭建實驗平臺(圖6)進行比較性實驗,而后選取最好的參數用于工業化生產,因此實驗平臺的搭建至關重要。反觀國內主要以整機搭建完成后調試為主,這一情況必然導致在調試過程中,針對每一臺機器反復地摸索實驗參數,而不是在實驗平臺中搞清這些參數并根據卡式瓶規格的不同將工藝參數設置在控制模塊中。

圖5 工業生產型硅化站

圖6 硅化站實驗平臺

表1 國外硅化站實驗平臺的系統組成

表2 硅化站所涉及的實驗參數
下面將介紹國外硅化站實驗平臺的系統組成與需要注意的工藝參數。
國外硅化站實驗平臺的系統組成如表1所示,硅化站所涉及的實驗參數如表2所示。
值得注意的一點是,在實驗中發現提高硅油的溫度、減少硅油的使用量后,依然能夠保證硅油涂層的均勻性,這一特點在工業生產中十分重要。硅油涂層不均勻如圖7所示,硅油涂層均勻如圖8所示。

圖7 硅油涂層不均勻

圖8 硅油涂層均勻
3.2 卡式瓶硅化效果的驗證
當完成卡式瓶硅化后,怎樣證明其工藝的有效性將是考驗設備制造廠商的一大難點。由于國內設備廠商主要關注整機的制造,而較少顧忌工藝的驗證,因此,很少使用實驗數據來證明工藝的有效性,在與國外同類設備廠商投標競爭時便處于下風。
卡式瓶的硅化工藝就是一個典型例子。卡式瓶的硅化工藝主要是為了增加膠塞在瓶內的滑動性,驗證滑動性就等同于驗證硅化工藝。其具體方式是設計一套推送膠塞進入卡式瓶內的力學測試裝置,該裝置可逐步提高推力,當膠塞被推動時便不再施力,所得數據自動記錄為“推力-位移”圖。得到一系列圖表后,通過與人工推送同批次實驗品中膠塞的力值比較或是觸覺比較,最終選擇合適的實驗批次并確定工藝參數,至此才算完成卡式瓶硅化工藝的開發與驗證。
4 結語
本文首先總結了目前國內立式洗瓶機清洗工藝的現狀,分析比較了兩種應用較廣的清洗工藝流程,明確提出了正確選擇洗瓶機清洗工藝與所適用的機型可以保證藥瓶的潔凈度與清洗效果,尤其對于藥品生產廠家在進行GMP認證時十分重要。
其次,對在設計環節工程師應遵守的基本國家標準與行業規范中的條款進行了羅列,并介紹了設備調試環節的驗證要點,把這些運用到實際生產中后,所獲得的測試驗證數據將幫助藥機設備生產廠檢驗設備功能,制定企業自身的標準規范。
最后,介紹了未來洗瓶機清洗工藝所涉及到的硅化工藝裝置,目前國內部分廠家正在積極研發,需要注意的是此裝置涉及了機械零件、電氣部件、軟件控制系統與硬件的集成,涉及面較廣,且相關技術公開較少。若研發此項目需制造硅化工藝實驗平臺,弄清此工藝中所涉及的相關參數后,再制造工業應用級別的硅化工藝裝置。
[1]JB/T20092—2007 抗生素瓶立式超聲波清洗機[S].
[2]JB/T20002.2—2011 安瓿超聲波清洗機[S].
[3]何國強.制藥工藝驗證實施手冊[M].北京:化學工業出版社,2012.
[4]Edwin Chan,Aaron Hubbard,Samir Sane,et al.Syringe Siliconization Process Investigation and Optimization[J].PDA J Pharm Sci Tech,2012(66).

