耐甲氧西林金黃色葡萄球菌MecA基因的實時熒光定量PCR方法學評價*
歐紅玲,陳鳳華,王 巖,張巧云,王欣茹
(第二炮兵總醫院檢驗科,北京 100088)
?
·論 著·
耐甲氧西林金黃色葡萄球菌MecA基因的實時熒光定量PCR方法學評價*
歐紅玲,陳鳳華,王 巖,張巧云,王欣茹△
(第二炮兵總醫院檢驗科,北京 100088)
目的 評估實時熒光定量聚合酶鏈反應(FQ-PCR)檢測臨床標本中耐甲氧西林金黃色葡萄球菌(MRSA)MecA耐藥基因的價值。方法 選擇該院2013年6~12月125份臨床標本,包括血液40份,痰液52份,創面分泌物33份進行FQ-PCR檢測和細菌鑒定,分析結果符合率,以檢測FQ-PCR的靈敏度及特異性。結果 FQ-PCR的靈敏度為0.159 pg/μL,檢測經細菌培養鑒定的菌株,特異性達到100%,與臨床標本結果符合率為97.6%。結論 FQ-PCR檢測MRSA的MecA基因更加方便、快速,且靈敏度和特異性等性能指標均比較理想,與細菌鑒定結果符合率較高,適合臨床廣泛應用。
耐甲氧西林金黃色葡萄球菌; MecA基因; 實時熒光定量聚合酶鏈反應; 微生物鑒定
耐甲氧西林金黃色葡萄球菌(MRSA)感染的流行是一個嚴重的臨床醫學及公共衛生問題。自1961年首次發現MRSA以來[1],MRSA分離率逐年增高,已成為醫院感染重要的革蘭陽性細菌。MecA基因在MRSA耐藥中起決定性作用,MecA基因與MRSA有很強的相關性,是判斷MRSA的“金標準”。美國臨床和實驗室標準化協會(CLSI)推薦用于MRSA耐藥的檢測方法有紙片擴散法和瓊脂篩選法、肉湯和瓊脂稀釋法。這些檢測方法耗時長,均需要在33~35 ℃條件下孵育24 h[2-5]。本文旨在對實時熒光定量聚合酶鏈反應(FQ-PCR)檢測MecA基因進行方法學評價,并評價其與微生物鑒定的復合率,為臨床更好地應用提供實驗依據。
1 材料與方法
1.1 菌株來源 收集本院2013年6~12月臨床標本125份,其中痰液52份,血液40份,創面分泌物33份。痰液標本均為晨痰,咳痰前先用清水反復漱口,用力咳出呼吸道深部痰液,直接吐入無菌痰盒。共分離菌株39株,其中MRSA 21株,非MRSA 18株(包括其他葡萄球菌屬、腸球菌屬、鏈球菌屬以及革蘭陰性菌等)。
1.2 細菌復蘇 將-80 ℃低溫保存的菌種置于室溫下解凍,按無菌操作原則將菌種轉入無菌肉湯中復蘇增菌,放置于37 ℃孵育箱18~24 h后轉種到血平皿37 ℃孵育18~24 h,長出單個菌落備用。
1.3 細菌鑒定和藥敏分析 用Vitek Compact全自動微生物鑒定儀進行細菌鑒定。用頭孢西丁紙片擴散法檢測MRSA菌株,實驗操作和判斷標準均參照2013年CLSI文件標準[5]。將金黃色葡萄球菌用無菌生理鹽水配制成0.5麥氏濁度單位的菌懸液,無菌棉簽蘸取菌液均勻涂布于M-H瓊脂表面,將每片30 g頭孢西丁紙片貼于其上,36 ℃溫育16~18 h后測量抑菌環直徑。結果判斷:抑菌環直徑小于或等于21 mm為耐藥。
1.4 主要儀器和試劑 FQ-PCR儀(SLAN-96P),高速離心機(Thermo Pico17),干式恒溫儀(GL-1800,海門其林貝爾儀器制造公司),MRSA耐藥基因檢測試劑盒(FQ-PCR法,上海之江生物科技有限公司),TIANamp Bacteria DNA Kit 細菌基因組DNA提取試劑盒(離心柱型)。
1.5 FQ-PCR擴增
1.5.1 模板的制備 臨床標本模版DNA的制備。(1)痰液。取痰液加入4倍體積的4%NaOH,搖勻,室溫下放置30 min液化,取0.5 mL樣品至1.5 mL離心管中,再加入0.5 mL 4%NaOH室溫放置10 min后13 000 r/min離心5 min。沉淀加無菌生理鹽水1 mL打勻,13 000 r/min離心5 min;再重復洗滌1次。棄上清液,沉淀中直接加入50 μL DNA提取液充分混勻,沸水浴10 min(誤差不超過1 min)。13 000 r/min離心5 min,取上清4 μL做PCR。(2)血液。取2 mL抗凝血,靜置待自然分層,吸取上層(血漿層)及中層(Buffy coat層),13 000 r/min離心5 min,棄上清液,沉淀中直接加入100 μL DNA提取液充分混勻,沸水浴10 min。13 000 r/min離心5 min,取上清4 μL做PCR。(3)創面分泌物。標本中加入無菌生理鹽水1 mL,13 000 r/min離心2 min,棄上清液,沉淀中直接加入100 μL DNA提取液充分混勻,沸水浴10 min。13 000 r/min離心5 min,取上清液4 μL做PCR。臨床菌株模版DNA的制備,按TIANGEN TIANamp Bacteria DNA Kit 細菌基因組DNA提取試劑盒(離心柱型)提取細菌DNA,對于較難破壁的革蘭陽性菌,加入溶菌酶進行破壁后,再按說明書進行DNA提取。
1.5.2 PCR擴增 (1)FQ-PCR:按照MRSA耐藥基因檢測試劑盒說明書配成40 μL反應體系:金黃色葡萄球菌核酸FQ-PCR檢測混合液35.6 μL,酶(Taq+UNG)0.4 μL,模板4 μL。參數設置:37 ℃變性2 min;94 ℃ 2 min;循環1次,再按93 ℃ 15 s,60 ℃ 60 s,循環40次;單點熒光檢測在60 ℃,反應體系40 μL。該試劑盒可同時檢測標本中Nuc基因和MecA基因。其中Nuc基因為金黃色葡萄球菌的特異性基因。(2)普通PCR法:反應體系25 μL,參數設置:94 ℃ 3 min;再按94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s循環40次;72 ℃ 5 min。瓊脂糖凝膠電泳分析擴增產物。
1.5.3 MRSA FQ-PCR實驗結果判斷 見表1。
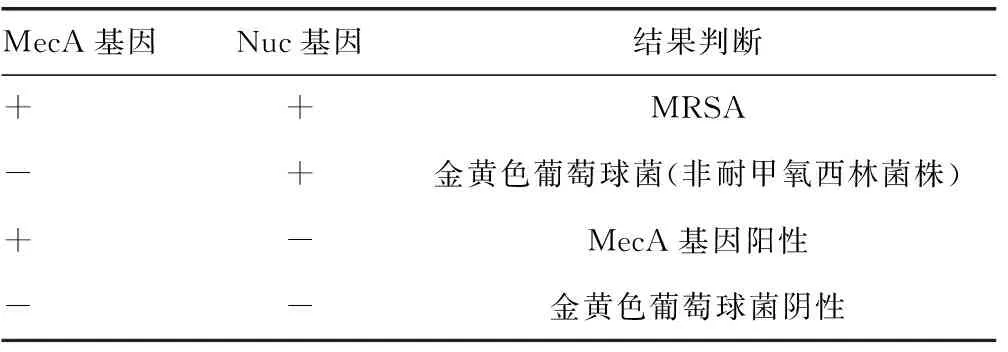
表1 MRSA FQ-PCR不同實驗結果判斷
注:+表示陽性,-表示陰性。
1.5.4 結果判斷 對125份臨床標本同時進行FQ-PCR、普通PCR檢測和微生物鑒定,統計3種方法的符合率。
2 結 果
2.1 靈敏度 將Vitek Compact全自動微生物鑒定儀鑒定的MRSA臨床菌株,進行細菌DNA提取,模版DNA用去離子水10倍比例稀釋成15.9 ng/μL、1.59 ng/μL、159 pg/μL、15.9 pg/μL、1.59 pg/μL、0.159 pg/μL、0.015 9 pg/μL系列濃度。結果表明,FQ-PCR的靈敏度為0.159 pg/μL,普通PCR的靈敏度為15.9 pg/μL,FQ-PCR比普通PCR靈敏度高100倍(圖1和圖2)。
2.2 特異性 21株Vitek Compact全自動微生物鑒定儀鑒定的MRSA菌株經FQ-PCR檢測均為陽性,18株經鑒定的非MRSA菌株經FQ-PCR檢測為陰性,其中嗜麥芽假單胞菌和表皮葡萄球菌檢測到MecA基因,但Nuc基因均為陰性,所以均判定為陰性。結果表明,FQ-PCR檢測MRSA特異性為100%。見表2。

1為15.9 ng/μL;2為1.59 ng/μL;3為159 pg/μL;4為15.9 pg/μL;5為1.59 pg/μL;6為0.159 pg/μL;7為0.015 9 pg/μL。
圖1 普通PCR MecA基因檢測結果
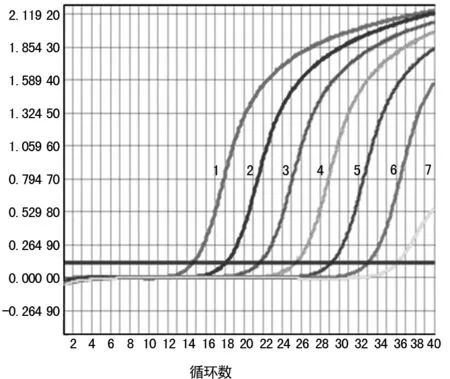
1為15.9 ng/μL;2為1.59 ng/μL;3為159 pg/μL;4為15.9 pg/μL;5為1.59 pg/μL;6為0.159 pg/μL;7為0.015 9 pg/μL。

圖2 FQ-PCR MecA基因檢測結果表2 39株細菌的MecA基因FQ-PCR檢測結果
注:+表示陽性,-表示陰性。
2.3 重復性 對提取的15.9 ng/μL和1.59 pg/μL高低兩種濃度的MRSA菌株DNA模板進行重復性擴增實驗,測定結果進行分析。15.9 ng/μL和1.59 pg/μL平均循環閾值(Ct)和變異系數(CV)分別為14.65和29.20、1.39%和2.97%,CV均小于5.00%,顯示具有良好的重復性。
2.4 臨床標本結果分析
2.4.1 40份血液標本經FQ-PCR和微生物鑒定,其中2份為MRSA;1份MecA基因陽性,Nuc基因陰性,結果判斷為MecA基因攜帶者。與微生物鑒定符合率100%。
2.4.2 52份痰液經FQ-PCR、普通PCR和細菌鑒定,檢出陽性標本結果相符的共36份,陰性結果相符的14份;其中2份FQ-PCR和普通PCR檢出MecA基因及Nuc基因陰性,而微生物鑒定均為陽性;1份FQ-PCR MRSA陽性,而普通PCR和微生物鑒定為陰性,與微生物鑒定符合率94%。
2.4.3 33份創面分泌物,檢出陽性標本結果相符的共4份,陰性結果相符的29份。與微生物鑒定符合率100%。
3 討 論
MRSA是引起醫院相關性和社區相關性感染的重要致病菌之一,自發現以來,其分離率不斷上升,已成為醫院相關性感染最重要的革蘭陽性菌。近年來世界各地不斷報道危及生命的社區獲得性MRSA感染,防治形勢極為嚴峻。MRSA對抗菌藥物的耐藥性日趨嚴重,且對多種抗菌藥物耐藥,因此MRSA 引起的醫院感染一旦發生,常難以控制。隨著MRSA分離率的不斷上升,快速、準確、及時檢測MRSA對臨床選用合適的抗菌藥物及控制MRSA傳播均具有重要意義[6]。MecA基因在MRSA耐藥中起決定性作用,它編碼的青霉素結合蛋白2a(PBP2a)與β內酰胺類抗菌藥物的親和力極低,使抗菌藥物不能阻礙細胞壁肽聚糖層合成,從而產生耐藥性[7]。因此,MecA基因已作為MRSA的分子學標志[8]。
目前,MRSA的檢測臨床最常用的是紙片擴散法、瓊脂篩選法、肉湯和瓊脂稀釋法。這些檢測方法耗時長,均需要在33~35 ℃條件下孵育24 h,易受孵育溫度、時間、培養基質量、菌液數量等多種因素的影響[9]。而PCR方法直接檢測細菌染色體上的MecA基因,不受藥敏實驗條件的影響,特異性高,從核酸提取到熒光檢測僅需3~4 h,為臨床醫生的快速診治提供了更為有效的手段。本研究FQ-PCR的最低檢測下限為0.159 pg/μL,靈敏度較普通PCR(15.9 pg/μL)高100倍,特異性達到100%,并對高低兩個濃度重復檢測的CV均小于5.00%,顯示具有良好的重復性,檢測性能滿足臨床檢測的需要。
本實驗采用FQ-PCR檢測2份耐甲氧西林凝固酶陰性葡萄球菌,結果顯示:Nuc基因陰性、MecA基因陽性。與Nuc基因是金黃色葡萄球菌特有基因、MecA基因是耐甲氧西林葡萄球菌分子學標志的結論一致。本實驗采用臨床標本直接進行FQ-PCR法檢測。2份臨床標本FQ-PCR法和普通PCR檢測MecA基因陰性,Nuc基因為陰性的痰液,而微生物鑒定為MRSA陽性。分析其原因可能為:(1)使用 4%NaOH液化標本后,未充分洗滌干凈,pH過高可抑制PCR,造成假陰性結果;(2)在標本洗滌、凍存、提取 DNA模板過程中,原始標本中的 MRSA菌水平極低,不能有效提取到 MRSA的DNA模板,造成FQ-PCR結果的假陰性。1份痰液標本FQ-PCR檢測MecA基因陽性,Nuc基因為陽性,而微生物鑒定為陰性。分析其原因可能為:痰培養受培養基的成分、細菌接種量、培養時間和培養溫度的影響,以及受抗菌藥物的抑制,而痰液中細菌分布不均一及培養室僅用標本的極少部分,都可能影響微生物培養法MRSA的檢出率。另外,FQ-PCR法檢測21份MRSA菌株與細菌培養鑒定的符合率為100%,說明直接用MRSA菌株進行FQ-PCR 檢測,實驗的準確度明顯提高。
綜上所述,FQ-PCR法的靈敏度高、特異性強,檢測方便、簡單、快捷,可以在標本接收后2~3 h內出結果,可迅速對臨床治療做出積極的引導,并可以滿足醫院感染防控24 h內檢測患者入院時是否攜帶MRSA的要求。
[1]Matouskova I,Janout V.Current knowledge of methicillin-resistant Staphylococcus aureus and community-associated methicillin-resistant Staphylococcus aureus[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008,152(2):191-202.
[2]Liu C,Bayer A,Cosgrove SE,et al.Clinical practice guidelines by the infectious diseases society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J].Clin Infect Dis,2011,52(3):18-55.
[3]施瑜.耐甲氧西林葡萄球菌檢測方法評價[J].檢驗醫學與臨床,2008,5(24):1517-1518.[4]Sturenburg E.Rapid detection of methicillin-resistant Staphylococcus aureus directly from Clinical samples:methods,effectiveness and cost considerations[Z],2009.
[5]Clinical Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twenty-third informational supplement.M100-S23[S].Wayne,PA,USA:CLSI,2013.
[6]Balakuntla J,Prabhakara S,Arakere G.Novel rearrangements in the staphylococcal cassette chromosome mec type V elements of Indian ST772 and ST672 methicillin risistant staphylococcus aureus strains[J].PloS One,2014,9(4):e94293-e94295.
[7]徐偉紅,徐斌.耐甲氧西林金黃色葡萄球菌SCCmec基因檢測及耐藥性分析[J].國際檢驗醫學雜志,2013,34(12):37-39.
[8]郝崇華,萬艷紅,裴世靜,等.耐甲氧西林金黃色葡萄球菌實驗室診斷方法[J].中國藥物與臨床,2013,13(9):1174-1176.
[9]牟曉峰,趙自云.實時熒光定量PCR檢測耐甲氧西林金黃色葡萄球菌方法的建立與應用評價[J].中華醫院感染學雜志,2011,21(19):4185-4187.
Evaluation of FQ-PCR method for detecting methicillin-resistant Staphylococcus aureus MecA gene*
OUHong-ling,CHENFeng-hua,WANGYan,ZHANGQiao-yun,WANGXin-ru△
(DepartmentofClinicalLaboratory,GeneralHospitaloftheSecondArtillery,Beijing100088,China)
Objective To evaluate the reliability of fluorescent quantitative polymerase chain reaction (FQ-PCR) method for detecting methicillin-resistant Staphylococcus aureus(MRSA) MecA resistant gene.Methods A total of 125 clinical specimens were collected from June 2013 to December 2013,including 40 blood specimens,52 sputum specimens,33 specimens of wound secretions.FQ-PCR method and bacteria identification were used to detect all the specimens,and then analyze the consistent rate of results,sensitivity and specifity.Results The sensitivity of FQ-PCR method was 0.159 pg/μL,the specificity of FQ-PCR in detecting bacterial strain cultured and identified was100%,and the consistent rate with the results of clinical samples was 97.6%.Conclusion FQ-PCR method is more convenient,fast in detecting MecA gene of MRSA,and sensitivity,specificity are ideal,the consistent rate with bacterial identification result is high,so could be used widely in clinical applications.
methicillin-resistant Staphylococcus aureus; MecA gene; fluorescent quantitative polymerase chain reaction; bacterial identification
全軍十二五面上課題(CWS11J205)。
歐紅玲,女,碩士,主管技師,主要從事分子生物學研究。△
,E-mail:wangxinru@126.com。
10.3969/j.issn.1672-9455.2015.04.002
A
1672-9455(2015)04-0436-03
2014-10-11
2014-12-10)

