裂谷熱病毒Gn蛋白主要抗原區(qū)的表達(dá)、純化及抗原性分析
夏 鵬,魏建超,陸瑩梅,武專昌,李蓓蓓,劉 珂,邵東華,邱亞峰,鐘登科,溫貴蘭,馬志永
裂谷熱病毒Gn蛋白主要抗原區(qū)的表達(dá)、純化及抗原性分析
夏 鵬1,2,魏建超1,陸瑩梅1,武專昌1,李蓓蓓1,劉 珂1,邵東華1,邱亞峰1,鐘登科3,溫貴蘭2,馬志永1
目的 通過(guò)原核表達(dá)系統(tǒng)制備裂谷熱病毒Gn片段主要抗原區(qū)蛋白,獲取純化蛋白,并分析抗原性。方法 將合成的裂谷熱Gn基因用PCR的方法擴(kuò)增具有保護(hù)性抗原表位的兩段Gn1和Gn2,并將其定向插入原核表達(dá)質(zhì)粒pColdⅠ中,構(gòu)建重組表達(dá)質(zhì)粒pColdⅠ-Gn1和pColdⅠ-Gn2,并將重組質(zhì)粒轉(zhuǎn)化到BL21(DE3)感受態(tài)中,以IPTG誘導(dǎo)表達(dá),SDS-PAGE分析表達(dá)蛋白和表達(dá)量,并利用His-tag Ni柱進(jìn)行親和層析純化,Western-blot鑒定表達(dá)蛋白。結(jié)果 所構(gòu)建的質(zhì)粒pColdⅠ-Gn1和pColdⅠ-Gn2序列正確,SDS-PAGE檢測(cè)到目的蛋白,Western-blot顯示截?cái)嗟腉n蛋白具有很好反應(yīng)原性。結(jié)論 成功純化了裂谷熱病毒Gn主要抗原區(qū)的表達(dá)蛋白。
裂谷熱病毒;Gn蛋白;原核表達(dá);蛋白純化
1931年,在肯尼亞的大裂谷報(bào)道了一種在家畜間大面積爆發(fā)的烈性傳染病,同年分離出病毒,并被命名為裂谷熱病毒(Rift Valley fever Virus,RVFV)。裂谷熱的傳播主要是通過(guò)蚊子的叮咬,引起包括肯尼亞、南非、埃及、馬達(dá)加斯加、也門(mén)及阿拉伯半島等地大面積爆發(fā)的人獸共患病。1977年之前,RVF一直在非洲撒哈拉大沙漠以南地區(qū)的動(dòng)物和人間傳播,但1977-1978年間在埃及的爆發(fā)則主要發(fā)生在人群中,報(bào)道18 000多病例,其中大約600人死亡。直到2000年前,此病主要在非洲的南部和東部地區(qū)流行,但2000年9月,中東地區(qū)的阿拉伯半島和也門(mén)也爆發(fā)此病,僅僅3個(gè)月就有1 087個(gè)疑似病例,其中121例死亡[1]。此后,非洲東部和南部及阿拉伯半島地區(qū)成周期性流行[2]。如今,世界各國(guó)動(dòng)物性進(jìn)出口貿(mào)易日益頻繁,而阿拉伯半島又毗鄰亞歐大陸,所以更應(yīng)加強(qiáng)對(duì)RVF的檢疫,同時(shí)對(duì)RVF疫苗的研制也迫在眉睫。裂谷熱沒(méi)有特征性臨床癥狀,因此個(gè)別病例的診斷較為困難,但該病的大面積傳播有以下特征:大批母畜流產(chǎn)、新生幼畜的大批死亡,乃至人群的發(fā)病。目前的診斷方法主要是病毒分離、血清學(xué)和核酸技術(shù)等[3]。
RVFV屬于布尼亞病毒科(Bunyaviridae) 白蛉熱病毒屬(Phlebovirus)。RVFV基因組由3個(gè)節(jié)段的負(fù)鏈RNA組成,分別為L(zhǎng)、M、S節(jié)段。S節(jié)段長(zhǎng)度為1 690 nt, 利用雙向策略,反義鏈編碼核衣殼蛋白( N) ,正義鏈編碼一個(gè)非結(jié)構(gòu)蛋白( NSs),2個(gè)相向的開(kāi)放閱讀框之間的基因間區(qū)域?yàn)?1 nt[4]。L節(jié)段長(zhǎng)6 404 nt反向編碼RNA依賴的RNA聚合酶也稱為L(zhǎng)蛋白[5],M節(jié)段長(zhǎng)3 885 nt,反向編碼4個(gè)蛋白,其中2個(gè)主要蛋白為糖蛋白Gn和Gc,另外2個(gè)次要蛋白為14 kDa的非結(jié)構(gòu)蛋白(NSm)和78 kDa的結(jié)構(gòu)蛋白[6]。糖蛋白對(duì)于布尼亞病毒在高爾基體內(nèi)的成熟具有重要作用,Gn和Gc蛋白參與高爾基體的定位過(guò)程。研究表明,Gn蛋白C端的48個(gè)氨基酸部位(包括20個(gè)氨基酸的跨膜區(qū)域和鄰近的蛋白C末端28個(gè)氨基酸) 就是RVFV的高爾基體定位信號(hào),而Gc蛋白則通過(guò)物理作用與Gn蛋白相結(jié)合從而定位于高爾基體[7-8]。N蛋白是RVFV主要的免疫原,而病毒表面的Gn和Gc蛋白含有中和表位,也能刺激機(jī)體產(chǎn)生抗體[9-10]。
RVFV囊膜糖蛋白(G) 是由M基因片段編碼的,翻譯后修飾過(guò)程中裂解為兩個(gè)蛋白(Gn和Gc糖蛋白)[11],是病毒的主要免疫原結(jié)構(gòu)蛋白。因Gn片段全長(zhǎng)為1 610 bp,在原核表達(dá)系統(tǒng)中不易表達(dá)和純化。根據(jù)Besselaar TG等報(bào)道的G蛋白的主要抗原區(qū),結(jié)合DNAstar Protean軟件分析Gn片段其親水區(qū)、表面展示概率及主要抗原區(qū),確定兩段主要抗原區(qū)Gn1 (480-1268)和Gn2(1371-1688)[14]。本研究分別構(gòu)建pColdⅠ-Gn1和pColdⅠ-Gn2原核表達(dá)質(zhì)粒,在BL21感受態(tài)細(xì)胞中,通過(guò)IPTG誘導(dǎo)表達(dá)截?cái)嗄夷さ鞍譍n1和Gn2,重組蛋白經(jīng)Ni柱 His Band親和層析純化后,獲得純化蛋白。
1 材料與方法
1.1 質(zhì)粒和菌種 大腸桿菌原核表達(dá)質(zhì)粒pColdⅠ、大腸桿菌感受態(tài)DH5α和BL21(DE3)由本實(shí)驗(yàn)室保存。
1.2 主要試劑和材料 In-Fusion? HD Cloning Kit試劑盒購(gòu)置于Clontech,各種限制內(nèi)切酶和Buffer購(gòu)置于Fermentas公司,小提質(zhì)粒試劑盒和DNA膠回收試劑盒購(gòu)置于Axygen公司Ni NTA His Bindresin購(gòu)自Novagen公司,氨芐青霉素和IPTG購(gòu)置于Sigma公司,各種DNA marker均購(gòu)置于天根生物公司,抗His標(biāo)簽鼠源單抗,抗兔抗PVFV Gn多克隆抗體(本研究室制備和鑒定),辣根過(guò)氧化物酶( HRP) 標(biāo)記的羊抗鼠二抗購(gòu)自Sigma公司,化學(xué)合成裂谷熱病毒M基因(GenBank ACCESSION :DQ380206)連接于pUc57質(zhì)粒,由Invitrogen公司合成得到M-pUc57。
1.3 引物的設(shè)計(jì) 通過(guò)DNAStar分析Gn基因的親水區(qū)、表面展示概率及主要抗原區(qū),以M-pUc57質(zhì)粒為模板用Primer Premier 5.0軟件設(shè)計(jì)上下游引物,用PCR的方法擴(kuò)增具有保護(hù)性抗原表位的兩段Gn1和Gn2。
1.4 重組質(zhì)粒的構(gòu)建 以合成的裂谷熱M基因?yàn)槟0澹肞CR的方法擴(kuò)增片段Gn1和Gn2,膠回收純化PCR產(chǎn)物,質(zhì)粒pColdⅠ并用KpnⅠ和EcoRⅠ雙酶切并純化,Gn1、Gn2分別于酶切純化后的質(zhì)粒按In-Fusion? HD Cloning Kit試劑盒連接(優(yōu)點(diǎn):盡可能多的減少質(zhì)粒外源基因的插入),并將重組質(zhì)粒轉(zhuǎn)化到BL21感受態(tài)細(xì)胞中,涂板過(guò)夜挑取單克隆,搖菌提質(zhì)粒PCR鑒定,最終測(cè)序確認(rèn)。
1.5 誘導(dǎo)表達(dá) 取鑒定正確的陽(yáng)性菌液,按1∶100轉(zhuǎn)接,37 ℃搖菌OD600至0.4~0.6之間,加入終濃度為1 mmol/L的IPTG,然后置于18 ℃搖菌24 h,取菌液離心,收集菌體沉淀。按菌體10 CV加入細(xì)菌裂解緩沖液重懸,置于冰上超聲(工作5 s,間歇5 s,功率4 HZ)共15 min。取未誘導(dǎo)的菌液、誘導(dǎo)未超聲的菌液、誘導(dǎo)超聲的上清、誘導(dǎo)超聲的沉淀,用15%的SDS-PAGE分析其蛋白表達(dá)形式。沉淀用30 mL的Binding緩沖液重懸,4 ℃過(guò)夜。
1.6 重組蛋白的純化 將誘導(dǎo)表達(dá)的蛋白,按照His-tag Ni柱進(jìn)行親和層析純化說(shuō)明書(shū)純化蛋白。用15%的SDS-PAGE檢測(cè)其純化效果。
1.7 Western-blot檢測(cè)重組蛋白的表達(dá) 重組蛋白在SDS-PAGE電泳后,0.24 A恒安電流下轉(zhuǎn)膜2 h,室溫封閉2 h,一抗分別為抗His標(biāo)簽鼠源單克隆抗體(稀釋度為1∶5 000)和抗兔抗PVFV Gn多克隆抗體(稀釋度為1∶1 000),4 ℃孵育過(guò)夜,用TBST洗滌3次,二抗為辣根過(guò)氧化物酶( HRP) 標(biāo)記的羊抗鼠,其稀釋度為1∶10 000,二抗室溫孵育2 h,TBST孵育3次,加顯色底物顯色,觀察GN1和GN2的免疫原性。
2結(jié) 果
2.1 原核重組質(zhì)粒的構(gòu)建與鑒定 裂谷熱M基因全長(zhǎng)3 885 bp,用特異性引物擴(kuò)增M片段的Gn1(480-1268)、Gn2(1371-1688),按In-Fusion? HD Cloning Kit試劑盒連接,質(zhì)粒小提后,以質(zhì)粒pColdⅠ-Gn1和pColdⅠ-Gn2為模板,分別以特異性引物擴(kuò)增,DL2000 marker、 1%的瓊脂糖凝膠電泳分析,分別得到預(yù)期大小相同的片段(見(jiàn)圖1),最后送生物公司測(cè)序,比對(duì)NCBI序列100%一致。
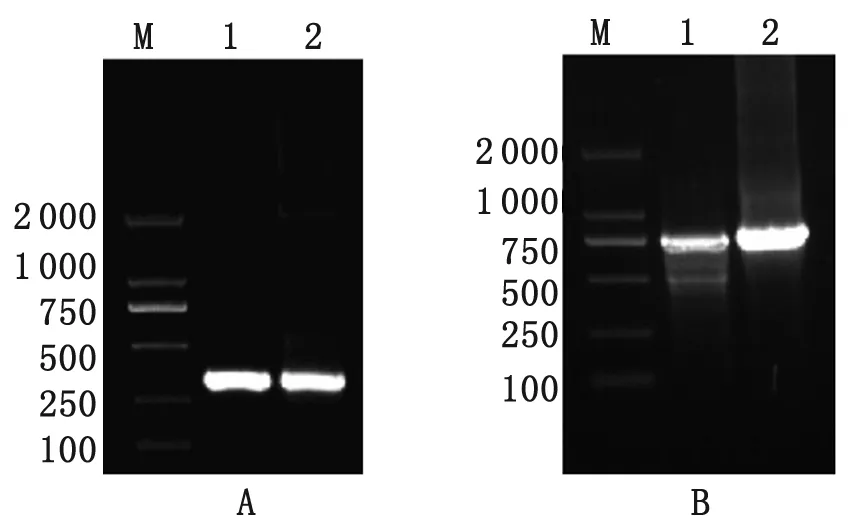
A M: DL2000 marker; 1: PCR amplification of M-pUc57; 2: PCR amplification of pColdⅠ-Gn1.
B M: DL2000 marker; 1: PCR amplification of M-pUc57; 2: PCR amplification of pColdⅠ-Gn2.
圖1 Gn1、Gn2的PCR擴(kuò)增鑒定
Fig.1 Identification of Gn1 and Gn2 by PCR
2.2 重組蛋白的誘導(dǎo)表達(dá) 將重組陽(yáng)性質(zhì)粒pColdⅠ-Gn1和pColdⅠ-Gn2轉(zhuǎn)化到BL21(DE3)中,37 ℃震蕩培養(yǎng)至生長(zhǎng)對(duì)數(shù)期,再以終濃度1 mmol/L IPTG在18 ℃誘導(dǎo)24 h,取未誘導(dǎo)的菌液、誘導(dǎo)未超聲的菌液、誘導(dǎo)超聲的上清、誘導(dǎo)超聲的沉淀,用15%的SDS-PAGE電泳鑒定后分子量約為Gn1 Gn2分別約為30 kDa和13 kDa(見(jiàn)圖2),與理論值一致且可以確定其表達(dá)在包涵體中。
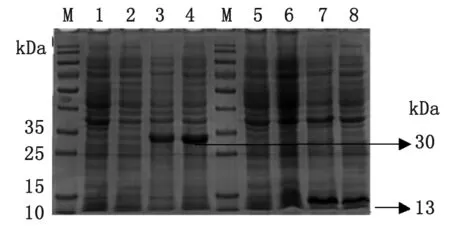
M: Protein marker; 1: Lysate of BL21uninduced; 2: Supernatant of BL21(Gn1); 3: Pellet of BL21(Gn1); 4: Lysate of BL21(Gn1) induced with IPTG; 5: Lysate of BL21uninduced; 6: Supernatant of BL21(Gn2); 7: Pellet of BL21(Gn2); 8: Lysate of BL21(Gn2) induced with IPTG.
圖2 Gn1和Gn2蛋白表達(dá)形式的鑒定
Fig.2 Analysis of expression of Gn1 and Gn2 protein
2.3 重組蛋白的純化 經(jīng)SDS-PAGE電泳表明,目的蛋白主要表達(dá)在包涵體內(nèi),于是對(duì)包涵體進(jìn)行大量誘導(dǎo)表達(dá),離心取菌體加裂解液,超聲后沉淀溶解在6 mol/L尿素Binding Buffer中于4 ℃過(guò)夜。對(duì)包涵體進(jìn)行His-tag Ni柱進(jìn)行親和層析純化,樣品進(jìn)行SDS-PAGE顯示得到較高純度的蛋白(見(jiàn)圖3和圖4)。
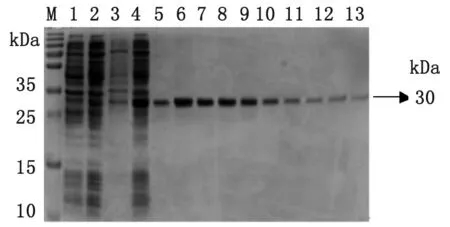
M: Protein marker; 1: Lysate of BL21uninduced; 2: Supernatant of BL21(Gn1); 3: Pellet of BL21(Gn1); 4: Lysate of BL21(Gn1) induced with IPTG; 5-13: Purification of Gn1 recombinant protein.
圖3 Gn1重組蛋白的純化
Fig.3 Purification of Gn1 recombinant protein
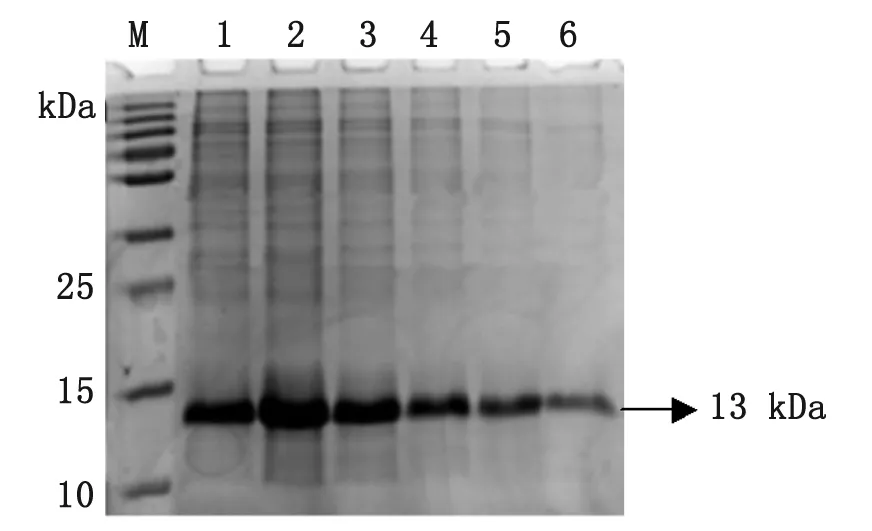
M: Protein marker; 1-5: Purification of Gn2 recombinant protein.
圖4 Gn2重組蛋白的純化
Fig.4 Purification of Gn2 recombinant protein
2.4 純化蛋白的Western-bolt分析 對(duì)重組蛋白Gn1、Gn2進(jìn)行Western-bolt鑒定,結(jié)果顯示分別在約30 kDa(見(jiàn)圖5)、13 kDa(見(jiàn)圖6)出得到特異性條帶。
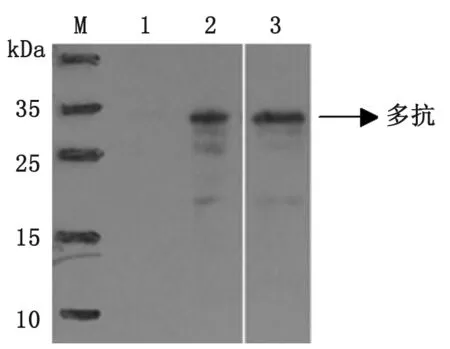
M: Protein marker; 1: Empty vector PcoldⅠ; 2: Purification of Gn1 recombinant protein reacted with His Monoclonal antibody; 3: Purification of Gn1 recombinant protein reacted with ployclonal antibody.
圖5 Gn1重組蛋白的Western-bolt鑒定
Fig.5 Identification of Gn1 recombinant protein by Western-bolt
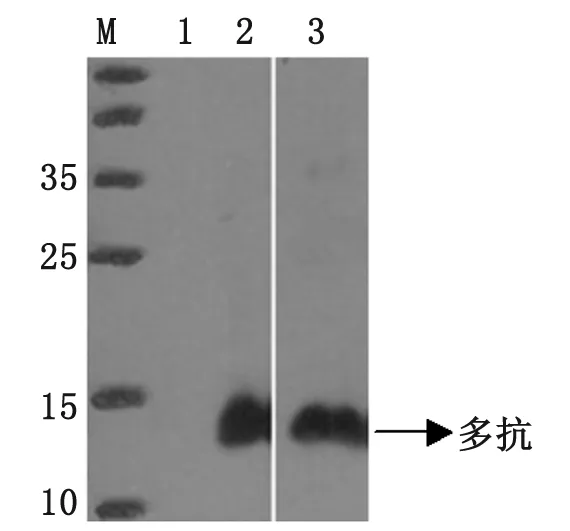
M: Protein marker; 1: Empty vector pColdⅠ; 2: Purification of Gn2 recombinant protein reacted with His Monoclonal antibody; 3: Purification of Gn2 recombinant protein reacted with ployclonal antibody.
圖6 Gn2重組蛋白的Western-bolt鑒定
Fig.6 Identification of Gn2 recombinant protein by Western-bolt
3 討 論
裂谷熱是由裂谷熱病毒引起的一種烈性人獸共患傳染病,蚊子是重要的傳播媒介,病毒可在蚊卵內(nèi)存活幾十年[12]。我國(guó)目前還沒(méi)有發(fā)現(xiàn)裂谷熱的存在,但近年來(lái),隨著中非貿(mào)易合作的加大,人員流動(dòng)和交通運(yùn)輸愈加頻繁,地域邊界和天然屏障已很難有效阻止蚊媒和病毒的入侵,傳入的風(fēng)險(xiǎn)也與日俱增,所以裂谷熱的防控一直備受關(guān)注。
布尼亞病毒的囊膜糖蛋白是由mRNA編碼的,所有的病毒均具有一個(gè)連續(xù)的閱讀框架,編碼糖蛋白的前體,再裂解為兩種糖蛋白( Gn和Gc);囊膜糖蛋白的主要功能是與細(xì)胞表面的受體結(jié)合[13]。在裂谷熱病毒入侵宿主細(xì)胞的過(guò)程中,首先是細(xì)胞與裂谷熱病毒囊膜糖蛋白介導(dǎo)病毒相結(jié)合,再通過(guò)細(xì)胞膜與病毒囊膜融合過(guò)程。因?yàn)榱压葻岵《救狈|(zhì)蛋白,所以糖蛋白對(duì)病毒粒子的成熟和釋放起到至關(guān)重要作用。
裂谷熱病毒和其他RNA病毒一樣,在侵入宿主細(xì)胞、融合、與宿主細(xì)胞受體結(jié)合及中和抗體的誘導(dǎo)方面,裂谷熱病毒的囊膜糖蛋白起到關(guān)鍵作用。裂谷熱病毒具備其他反轉(zhuǎn)錄病毒一樣的特性,能和多種異源病毒膜蛋白形成偽型病毒的能力,糖蛋白Gn、Gc在高爾基體內(nèi)積累,末端糖基化,獲得經(jīng)過(guò)修飾的宿主膜,出芽進(jìn)入高爾基池,或在細(xì)胞表面出芽;細(xì)胞質(zhì)小囊與胞漿膜融合,釋放出成熟的病毒粒子。
本研究通過(guò)人工合成的方法,合成了裂谷熱病毒的Gn基因,并通過(guò)DNAStar Protean軟件分析其親水區(qū)、表面展示概率及主要抗原區(qū),找出主要抗原區(qū),以人工合成的Gn為模板,設(shè)計(jì)特異性引物分別擴(kuò)增基因Gn1和Gn2。并將其插入到原核表達(dá)質(zhì)粒pColdⅠ中,構(gòu)建重組表達(dá)質(zhì)粒pColdⅠ-Gn1和pColdⅠ-Gn2,表達(dá)純化糖蛋白,通過(guò)SDS-PAGE和Western-blot檢測(cè),表達(dá)的原核蛋白具有良好的抗原性,可以被特異性抗體識(shí)別。本研究表達(dá)純化的裂谷熱的糖蛋白Gn,為后續(xù)裂谷熱的ELISA檢測(cè)奠定了基礎(chǔ)。
[1]Balkhy H H, Memish Z A. Rift Valley fever: an uninvited zoonosis in the Arabian peninsula.[J]. International Journal of Antimicrobial Agents, 2003, 21(2):153-157(5). DOI:10.1016/S0924-8579(02)00295-9.
[2]Liu L, Celma C C, Roy P. Rift Valley fever virus structural proteins: expression, characterization and assembly of recombinant proteins[J]. Virology Journal, 2008, 5(1):216-225. DOI:10.1186/1743-422X-5-82
[3]Oreshkova N. A single vaccination with an improved nonspreading Rift Valley fever virus vaccine provides sterile immunity in lambs.[J]. Plos One, 2013, 8(10):1-10. DOI: 10.1371/journal.pone.0077461
[4]Pang WJ, Yang GS, Chao JF et al.Study on molecular markers of H-FABP DNA on PCR-RFLP[J].Jour. of Northwest Sci-Tech Univ . of Agri. and For. (Nat. Sci. Ed. ).2004, 32(7):11-15. DOI:10.3321/j.issn:1671-9387.2004.07.003.(in Chinese) 龐衛(wèi)軍, 楊公社, 曹景峰,等. 豬H-FABP基因PCR-RFLP分子標(biāo)記研究[J]. 西北農(nóng)林科技大學(xué)學(xué)報(bào):自然科學(xué)版, 2004, 32(7):11-15. DOI:10.3321/j.issn:1671-9387.2004.07.003.
[5]Müller R, Poch O, Delarue M, et al. Rift Valley fever virus L segment: correction of the sequence and possible functional role of newly identified regions conserved in RNA-dependent polymerases[J].Journal of General Virology,1994,75(pt 6)(6):1345-1352.DOI: 10.1099/0022-1317-75-6-1345
[6]Jolckel S, Eiden M, Balkema-Buschmann A, et al. A novel indirect ELISA based on glycoprotein Gn for the detection of IgG antibodies against Rift Valley fever virus in small ruminants[J]. Research in Veterinary Science,2013,95(2):725 730. DOI:10.1016/j.rvsc.2013.04.015
[7]Wallance D B, Ellis C E, Espach A, et al. Protective immune responses induced by different recombinant vaccine regimes to Rift Valley fever.[J]. Vaccine, 2006, 24:7181-7189. DOI:10.1016/j.vaccine.2006.06.041
[8]De Boer S M. Rift Valley fever virus subunit vaccines confer complete protection against a lethal virus challenge.[J]. Vaccine, 2010, 28(11):2330 2339.DOI:10.1016/j.vaccine.2009.12.062
[9]Rndel F. Rift Valley fever virus.[J]. Current Molecular Medicine, 2005, 5(8):827-834(8). DOI:http://dx.doi.org/10.2174/156652405774962263
[10]Gerrard S R. Characterization of the Golgi retention motif of Rift Valley fever virus G(N) glycoprotein.[J]. Journal of Virology, 2002, 76(23):12200-12210.DOI: 10.1128/JVI.76.23.12200-12210.2002
[11]Mandell R B, Koukuntla R, Mogler L J, et al. A replication-incompetent Rift Valley fever vaccine: Chimeric virus-like particles protect mice and rats against lethal challenge[J]. Virology, 2010, 397(1):187 198. DOI:10.1016/j.virol.2009.11.001
[12]Billecocq A, Vazeille-Falcoz M, Rodhain F, et al. Pathogen-specific resistance to Rift Valley fever virus infection is induced in mosquito cells by expression of the recombinant nucleoprotein but not NSs non-structural protein sequences[J]. Journal of General Virology, 2000, 81(5):2161-2166.DOI:http://vir.sgmjournals.org/content/81/9/2161.
[13]Wang QH, Wang xijun, Hu Sen,et al. Study on DNA immune of envelope protein gene of Rift Valley Fever Virus[J].Acta Microbiologica Sinica, 2007, 47(4):677-681.(in Chinese) 王清華, 王喜軍, 胡森,等. 裂谷熱病毒囊膜蛋白基因DNA免疫的研究[J]. 微生物學(xué)報(bào), 2007, 47(4):677-681.
[14]Besselaar T G, Nk B. Topological mapping of antigenic sites on the Rift Valley fever virus envelope glycoproteins using monoclonal antibodies[J]. Archives of Virology, 1991, 121(1-4):111-124. DOI:10.1007/BF01316748
Expression, purification and antigenicity analysis of the major antigenic region of Gn protein from Rift Valley fever virus
XIA Peng1,2,WEI Jian-chao1,LU Ying-mei1,WU Zhuan-chang1,LI Bei-bei1,LIU Ke1,SHAO Dong-hua1,QIU Ya-feng1,ZHONG Deng-ke3,WEN Gui-lan2,MA Zhi-yong1
(1.ShanghaiVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Shanghai200241,China;2.CollegeofAnimalScience,GuizhouUniversity,Guiyang550025,China;3.DepartmentofAnimalScienceandTechnology,ShanghaiVocationalandTechnicalCollegeofAgricultureandForestry,Shanghai201600,China)
We expressed the protein of major antigenic region of Gn fragment of Rift Valley fever virus using prokaryotic expression system, and then purified the obtained protein for analyzing its antigenicity. The synthesized Gn gene was amplified with PCR and sub-cloned to generate pColdⅠ-Gn1 and pColdⅠ-Gn2 recombinant plasmid, which was then transformed intoE.coliBL21(DE3) competent bacteria. The expression of recombinant protein was induced by IPTG and analyzed by SDS-PAGE. The expressed protein was purified using His-Band Ni+ affinity chromatography and identified by Western blot. The recombinant expression plasmid was expressed successfully and the recombinant protein had good antigenicity by western-bolt. In conclusion, successfully expression and purification on the protein of major antigenic region of Gn fragment from Rift Valley fever virus laid the foundation for the follow-up study.
Rift Valley fever virus; Gn protein; prokaryotic expression; protein purification
Ma Zhi-yong, Email: zhiyongma@shvri.ac.cn
國(guó)家科技支撐計(jì)劃(2013BAD12B05); 國(guó)家自然科學(xué)基金(31302116);上海高校青年教師培養(yǎng)資助計(jì)劃(ZZnlzl2003)和上海農(nóng)林職業(yè)技術(shù)學(xué)院院級(jí)科研項(xiàng)目(091227)
馬志永,Email: zhiyongma@shvri.ac.cn
1.中國(guó)農(nóng)業(yè)科學(xué)院上海獸醫(yī)研究所,上海 200241; 2.貴州大學(xué)動(dòng)物科學(xué)學(xué)院,貴陽(yáng) 550025; 3.上海農(nóng)林職業(yè)技術(shù)學(xué)院,上海 201600
10.3969/cjz.j.issn.1002-2694.2015.07.003
R183.5
A
1002-2694(2015)07-0607-05
2014-11-10;
2015-05-12

Supported by grants from the National Science and Technology Support Program of China (No. 2013BAD12B05), the National Natural Science Foundation of China (No. 31302116), the Development Program for Young Teachers in Shanghai Colleges (No. ZZnlzl2003), and the Science Foundation of Shanghai Vocational and Technical College of Agriculture and Forestry (No. 091227)

