羅非魚皮Ⅰ型膠原蛋白 的抗原反應(yīng)特性分析
張靜怡,吳文惠,王南平,何 蘭,Elango JEEVITHAN,包 斌,*
(1.上海海洋大學(xué)食品學(xué)院,上海 201306;2.上海水產(chǎn)品加工及貯藏工程技術(shù)研究中心,上海 2013 06;3.上海市水產(chǎn)研究所,上海 200433)
?
羅非魚皮Ⅰ型膠原蛋白 的抗原反應(yīng)特性分析
張靜怡1,吳文惠2,王南平3,何 蘭3,Elango JEEVITHAN1,包 斌1,*
(1.上海海洋大學(xué)食品學(xué)院,上海 201306;2.上海水產(chǎn)品加工及貯藏工程技術(shù)研究中心,上海 2013 06;3.上海市水產(chǎn)研究所,上海 200433)
摘 要:目的:確定羅非魚皮Ⅰ型膠原蛋白的抗原性,為進(jìn)一步研究羅非魚皮Ⅰ型膠原蛋白生物相容性提供依據(jù)。方法:采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)對(duì)分離提取的羅非魚皮膠原蛋白進(jìn)行鑒定,共免疫ICR小鼠3 次。采用酶聯(lián)免疫吸附反應(yīng)(enzyme linked immune sorbent assay,ELISA)分別于每次免疫后第7天測(cè)定小鼠產(chǎn)生的總膠原蛋白抗體,并在第21天測(cè)定小鼠血清中內(nèi)免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(IgA)和免疫球蛋白M(IgM)的含量。結(jié)果:羅非魚皮膠原蛋白樣品是Ⅰ型膠原蛋白。所有經(jīng)羅非魚皮Ⅰ型膠原蛋白免疫的小鼠體內(nèi)均產(chǎn)生抗體,3 次免疫后羅非魚皮Ⅰ型膠原蛋白抗體質(zhì)量濃度范圍為160.50~164.25 μg/L,小鼠IgG、IgA和IgM的質(zhì)量濃度范圍分別為424.81~437.59 ng/mL、46.86~49.53 μg/mL、1.81~1.89 ng/mL。結(jié)論:羅非魚皮Ⅰ型膠原蛋白對(duì)ICR小鼠呈現(xiàn)較弱的抗原性。
關(guān)鍵詞:膠原蛋白;免疫;酶聯(lián)免疫吸附反應(yīng);抗原性
膠原蛋白作為哺乳動(dòng)物體內(nèi)含量最豐富的蛋白質(zhì),約占體內(nèi)蛋白總量的25%~33%,并且在組成細(xì)胞間質(zhì)過(guò)程中起重要作用[1-2]。膠原蛋白廣泛存在于動(dòng)物的皮、骨、軟骨、牙齒、肌腱、韌帶和血管中,具有支撐器官、保護(hù)機(jī)體的重要作用[3]。膠原蛋白三螺旋結(jié)構(gòu),由2 條α1多肽鏈和1 條α2多肽鏈組成,3 條α肽鏈交互纏繞形成了繩索狀的超螺旋結(jié)構(gòu)[4]。每一條膠原鏈都是左手螺旋構(gòu)型,3 條左手螺旋鏈相互纏繞成右手螺旋結(jié)構(gòu),形成膠原蛋白獨(dú)特的三重螺旋結(jié)構(gòu),使其分子結(jié)構(gòu)非常穩(wěn)定[5]。膠原蛋白具有良好的生物相容性、可生物降解性和生物活性[6]。因此,膠原蛋白在食品、醫(yī)藥、組織工程、化妝品等領(lǐng)域獲得廣泛的關(guān)注,膠原蛋白的生產(chǎn)與開發(fā)具有很好的前景[7]。
長(zhǎng)期以來(lái),人們都是使用豬、牛的皮和骨提取膠原蛋白和明膠。但瘋牛病、口蹄疫等疾病的爆發(fā),對(duì)牲畜膠原制品的安全性產(chǎn)生了影響[8-10]。另外,有些地區(qū)由于其他人文原因不能使用牲畜膠原蛋白制品。由此,魚類膠原蛋白逐漸成為了研究熱點(diǎn)[11]。我國(guó)水產(chǎn)資源豐富,魚類膠原蛋白屬天然生物再生資源,可以作為一種新型的生物醫(yī)學(xué)材料廣泛應(yīng)用[6,12-13]。與陸生動(dòng)物膠原蛋白相比,魚類膠原蛋白具有許多獨(dú)特優(yōu)勢(shì)。而羅非魚是一種分布廣泛、產(chǎn)量較高的魚類品種,被認(rèn)為是未來(lái)動(dòng)物性蛋白的主要來(lái)源之一,近年來(lái)逐步受到重視。
然而,魚類膠原蛋白的安全性仍然是關(guān)鍵問(wèn)題。抗體是在宿主對(duì)抗原刺激的免疫應(yīng)答過(guò)程中,由淋巴細(xì)胞產(chǎn)生的一類能夠特異性識(shí)別 并中和相應(yīng)抗原的具有免疫功能的球蛋白。抗原性是抗 原刺激機(jī)體產(chǎn)生免疫應(yīng)答的能力。抗原性作為生物材料安全性的關(guān)鍵因素,其強(qiáng)弱與抗原分子的大小、化學(xué)成分、抗原決定簇的結(jié)構(gòu)、抗原與被免疫動(dòng)物親緣關(guān)系的遠(yuǎn)近等有密切關(guān)系。膠原蛋白的分子質(zhì)量較大,在應(yīng)用于生物材料過(guò)程中可能會(huì)產(chǎn)生抗原性問(wèn)題。膠原蛋白對(duì)于宿主是異物,在體內(nèi)必定會(huì)產(chǎn)生某種應(yīng)答或出現(xiàn)排異現(xiàn)象[14-15]。如果要成功植入膠原蛋白,至少要使發(fā)生的免疫反應(yīng)被宿主接受,不產(chǎn)生有害作用。而被免疫的動(dòng)物會(huì)通過(guò)特異 性和非特異性的免疫防御機(jī)制來(lái)維持機(jī)體的正常功能及自身內(nèi)環(huán)境的穩(wěn)定。因此,進(jìn)行羅非 魚皮Ⅰ型膠原蛋白抗原性的檢測(cè)是十分必要的。通過(guò)測(cè)定被免疫動(dòng)物血清中的抗體含量,評(píng)價(jià)其免疫狀況,對(duì)判斷羅非魚皮Ⅰ型膠原蛋白生物相容性具有重要意義。
Song等[16]為了研究水母膠原蛋白是否會(huì)產(chǎn)生類似牛膠原蛋白或明膠引起的炎癥反應(yīng),進(jìn)行了體內(nèi)植入實(shí)驗(yàn),測(cè)定了促炎細(xì)胞因子和抗體分泌物的表達(dá)并檢測(cè)了免疫細(xì)胞的數(shù)量變化情況。結(jié)果顯示水母膠原蛋白可以引起與牛膠原蛋白和明膠類似的免疫反應(yīng)。本實(shí)驗(yàn)以ICR小鼠作為動(dòng)物模型,采用酶聯(lián)免疫吸附反應(yīng)分析測(cè)定羅非魚皮Ⅰ型膠原蛋白誘導(dǎo)小鼠產(chǎn)生抗體的特性及其相關(guān)指標(biāo)的變化特點(diǎn)[17],從而確定羅非魚皮Ⅰ型膠原蛋白的抗原性強(qiáng)弱,以便為該種膠原蛋白材料在生物工程領(lǐng)域的應(yīng)用提供基礎(chǔ)。
1 材料與方法
1.1動(dòng)物、材料與試劑
SPF級(jí)ICR雌性小鼠,購(gòu)自上海西普爾-必凱實(shí)驗(yàn)動(dòng)物有限公司,動(dòng)物生產(chǎn)許可證號(hào):SCXK(滬)2008-0016。小鼠飼養(yǎng)在相對(duì)濕度60%~70%、溫度20~25 ℃、自然晝夜溫差的環(huán)境內(nèi),每日定時(shí)飼喂常規(guī)飼料,每日更換墊料。
羅非魚皮Ⅰ型膠原蛋白由上海水產(chǎn)研究所提供。所有提取Ⅰ型膠原蛋白的實(shí)驗(yàn)操作均在4 ℃條件下進(jìn)行。羅非魚魚皮經(jīng)浸提、離心、透析和冷凍干燥等步驟獲得干燥的羅非魚酶溶性膠原蛋白(tilapia pepsin soluble collagen,TPSC)。
三羥甲基氨基甲烷(t r i s h y d r o x y m e t h y l aminomethane,Tris)(分析純) 瑞典LKB公司;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、過(guò)硫酸銨(ammonium persulphate,AP)、甘氨酸、四甲基乙二胺、氯化鋁、氫氧化鈉 國(guó)藥集團(tuán)化學(xué)試劑有限公司;考馬斯亮藍(lán)R250 上海標(biāo)本模型廠;小鼠抗Ⅰ型膠原蛋白抗體酶聯(lián)免疫吸附反應(yīng)(enzyme linked immune sorbent assay,ELISA)試劑盒、小鼠免疫球蛋白G (immunoglobulin G,IgG)ELISA試劑盒、IgA ELISA試劑盒、IgM ELISA試劑盒 上海撫生實(shí)業(yè)有限公司;0.25 μm孔徑親水PTFE針式濾器 上海安譜科學(xué)儀器有限公司。
1.2儀器與設(shè)備
DYY-2c型電泳儀 北京六一儀器廠;SH-1000型酶標(biāo)儀 上海天美儀器有限公司;CR21G型高速冷凍離心機(jī) 日本Hitachi公司;電泳凝膠成像分體系統(tǒng) 美國(guó)UVP公司。
1.3方法
1.3.1 十二烷基硫酸鈉-聚丙烯酰胺電泳(sodium dodecyl su lfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析
采用SDS-PAGE測(cè)定羅非魚皮膠原蛋白分子質(zhì)量,主要參照Laemmli[18]的方法進(jìn)行。濃縮膠質(zhì)量分?jǐn)?shù)為5%,分離膠質(zhì)量分?jǐn)?shù)為7.5%,250 V電壓電泳約1 h至終點(diǎn)。固定液固定1 h,考馬斯亮藍(lán)R250染色0.5 h,脫色過(guò)夜,凝膠成像系統(tǒng)分析成像。
1.3.2 免疫材料的制備
取44 mL 0.6 mol/L氯化鋁溶液加熱至60 ℃,再取42 mL 1 mol/L氫氧化鈉溶液加熱至60 ℃,在60 ℃水浴鍋中將氫氧化鈉溶液緩慢加入氯化鋁溶液中,不斷攪拌1 h。用氫氧化鈉溶液調(diào)整混合液的pH值達(dá)7.0時(shí)為終點(diǎn),再繼續(xù)攪拌10 min,配制得到的氫氧化鋁溶膠佐劑裝入瓶?jī)?nèi),121 ℃高壓蒸汽滅菌15 min,室溫保存[19-20]。
取羅非魚皮Ⅰ型膠原蛋白0.012 5 g,加入0.1 mol/L乙酸100 mL。注射前經(jīng)0.25 μm孔徑親水PTFE針式濾器過(guò)濾,作為抗原樣品。
蝦類是人類優(yōu)質(zhì)的食用蛋白資源之一,也是公認(rèn)的易引起過(guò)敏的食物之一。蝦蛋白作為一種異體蛋白進(jìn)入體內(nèi)時(shí),機(jī)體易產(chǎn)生免疫反應(yīng)將其中和及消滅掉。因此本實(shí)驗(yàn)中選用蝦蛋白作為陽(yáng)性對(duì)照[21]。選取10 g斑節(jié)對(duì)蝦的肌肉在研缽中勻漿,加入0.1 mol/L乙酸100 mL,4 ℃浸提16 h后10 000 r/min、4 ℃離心20 min取上清液,即為蝦總蛋白提取液[22]。經(jīng)0.25 μm孔徑親水PTFE針式濾器過(guò)濾后,蝦總蛋白提取液與氫氧化鋁溶膠佐劑等體積混勻[19-20],作為陽(yáng)性對(duì)照抗原。
1.3.3 動(dòng)物分組及免疫
取30 只體質(zhì)量為20 g左右的雌性ICR小鼠,腹腔注射羅非魚皮Ⅰ型膠原蛋白溶液,進(jìn)行劑量篩選預(yù)實(shí)驗(yàn)。結(jié)果表明0.1 mL/d為最佳劑量,因此采用該劑量進(jìn)行后續(xù)實(shí)驗(yàn)。
30 只雌性ICR小鼠隨機(jī)分為6 組,每組5只:低劑量處理組、中劑量處理組、高劑量處理組、對(duì)照組、膠原蛋白陽(yáng)性對(duì)照組和蝦蛋白陽(yáng)性對(duì)照組,注射量為0.1 mL。各劑量處理組小鼠分別注射羅非魚皮Ⅰ型膠原蛋白5、50、500 μg/kg(以體質(zhì)量計(jì),下同);對(duì)照組小鼠注射0.1 mol/L乙酸;膠原蛋白陽(yáng)性對(duì)照組和蝦蛋白陽(yáng)性對(duì)照組用氫氧化鋁溶膠佐劑0.05 mL分別與羅非魚皮Ⅰ型膠原蛋白及蝦蛋白0.05 mL混合,注入小鼠體內(nèi),以便更有效地刺激免疫系統(tǒng),增大免疫應(yīng)答效應(yīng)[23]。
每隔一周腹腔注射一次,共注射3 次。期間觀察小鼠注射后的癥狀,每次注射后7 d眼眶取血,抗凝條件為檸檬酸鈉3.8%、生理鹽水0.85%。5 000 r/min離心5 min取上清液,-20 ℃貯存?zhèn)溆谩L崛⊙暹M(jìn)行ELISA分析。
1.3.4 抗體含量檢測(cè)方法
分別于每次免疫后7 d取血,采用小鼠抗羅非魚皮Ⅰ型膠原蛋白抗體ELISA試劑盒,利用具有高靈敏度競(jìng)爭(zhēng)性ELISA的替代工具雙抗原夾心法,測(cè)定小鼠血清中Ⅰ型膠原蛋白抗體(collagen type I antibody,COL-Ⅰ Ab)水平[24]。在已包被的酶標(biāo)板上,標(biāo)準(zhǔn)孔準(zhǔn)確加入標(biāo)準(zhǔn)品50 μL,待測(cè)樣品孔中先加樣品稀釋液40 μL,然后再加待測(cè)樣品10 μL。37 ℃溫育30 min后棄去液體,每孔加滿洗滌液,靜置30 s后棄去,重復(fù)5 次。每孔加入酶標(biāo)試劑50 μL(空白孔除外),37 ℃溫育30 min,同上洗滌。經(jīng)過(guò)徹底洗滌后加底物3,3’,5,5’-四甲基聯(lián)苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)顯色,37 ℃避光顯色10 min,TMB在辣根過(guò)氧化物酶(horseradish peroxidase,HRP)的催化下轉(zhuǎn)化成藍(lán)色。每孔加終止液50 μL終止反應(yīng),TMB在酸的作用下轉(zhuǎn)化成最終的黃色。顏色的深淺和樣品中Ⅰ型膠原蛋白抗體(COL-Ⅰ Ab)含量呈正相關(guān)。以空白孔調(diào)零,在4 50 nm波長(zhǎng)處測(cè)定每組小鼠抗體的絕對(duì)吸光度。以標(biāo)準(zhǔn)曲線的公式計(jì)算小鼠Ⅰ型膠原蛋白抗體含量[25]。
2 結(jié)果與分析
2.1SDS-PAGE結(jié)果分析

圖1 羅非魚皮膠原蛋白樣品SDS-PAGE圖Fig.1 SDS-PAGE of tilapia skin collagen
如圖1所示,羅非魚皮膠原蛋白含兩條α鏈和它們的聚合鏈β,所得條帶與陳申如等[26-27]的研究結(jié)果相似。與Nagai等[28]對(duì)3 種魚皮膠原蛋 白的研究結(jié)果對(duì)比發(fā)現(xiàn),所提取的羅非魚皮膠原蛋白是Ⅰ型膠原蛋白成分。兩條α肽鏈分子質(zhì)量約為130 kD,β肽鏈分子質(zhì)量約為116 kD[29]。由3 條α鏈所組成的未變性膠原蛋白分子質(zhì)量為300 kD,所以β肽鏈可能是α肽鏈通過(guò)架橋結(jié)合所形成的成分[26]。進(jìn)行SDS-PAGE時(shí),對(duì)加了巰基乙醇和未加巰基乙醇的樣品進(jìn)行對(duì)照(結(jié)果未給出),電泳結(jié)果沒(méi)有區(qū)別,推測(cè)羅非魚皮膠原蛋白樣 品中沒(méi)有包含二硫鍵。
2.2羅非魚皮Ⅰ型膠原蛋白的抗原免疫原性測(cè)定結(jié)果

圖2 羅非魚皮Ⅰ型膠原蛋白免疫小鼠的抗體質(zhì)量濃度Fig.2 Antibody concentrations against tilapia skin type I collagen in mice
在以羅非魚皮Ⅰ型膠原蛋白為抗原的免疫實(shí)驗(yàn)中,所有的小鼠體內(nèi)均產(chǎn)生抗體。如圖2所示,前兩次免疫分析結(jié)果顯示,處理組間比較,中劑量處理組的抗體質(zhì)量濃度最高,其次為高劑量處理組,最低為低劑量處理組。第3次免疫后高劑量處理組的抗體質(zhì)量濃度最高,其次為低劑量處理組,最低為中劑量處理組。對(duì)比膠原蛋白陽(yáng)性對(duì)照組和蝦蛋白陽(yáng)性對(duì)照組的抗體質(zhì)量濃度可以發(fā)現(xiàn),前兩次免疫后膠原蛋白陽(yáng)性對(duì)照組產(chǎn)生的抗體質(zhì)量濃度要高于蝦蛋白陽(yáng)性對(duì)照組,這表明小鼠在接受注射后14 d內(nèi)對(duì)羅非魚皮Ⅰ型膠原蛋白的免疫強(qiáng)度較蝦蛋白強(qiáng)。21 d后這種差異性變得不再明顯,這可能是因?yàn)?1 d后小 鼠對(duì)膠原蛋白產(chǎn)生了免疫適應(yīng)性,導(dǎo)致免疫系統(tǒng)接受膠原蛋白的刺激能力變?nèi)醪⑹姑庖哐h(huán)趨于穩(wěn)定變化。第3次免疫后所有注射組的抗體質(zhì)量濃度均降低到最低值,維持在160~163 μg/L的水平。其中,中劑量處理組在第3次免疫后抗體質(zhì)量濃度明顯降低。
由以上結(jié)果可以看出,50 μg/kg的羅非魚皮Ⅰ型膠原蛋白注射量會(huì)在小鼠體內(nèi)產(chǎn)生較高的抗體質(zhì)量濃度。5 μg/kg的注射量在前7 d時(shí)產(chǎn)生的抗體質(zhì)量濃度較低,與對(duì)照組相比差異極顯著(P<0.01),與蝦蛋白陽(yáng)性對(duì)照組相比差異顯著(P<0.05)。羅非魚皮Ⅰ型膠原蛋白首次免疫小鼠產(chǎn)生的抗體量較少,第2次免疫后產(chǎn)生抗體質(zhì)量濃度有所升高,至第3次免疫產(chǎn)生的抗體質(zhì)量濃度又顯著降低。這表明低劑量的羅非魚皮Ⅰ型膠原蛋白是一種低抗原性的蛋白質(zhì)。隨著免疫次數(shù)的增加,免疫反應(yīng)強(qiáng)度進(jìn)一步降低。原因可能是持續(xù)的免疫反應(yīng)使小鼠適應(yīng)羅非魚皮膠原蛋白的能力得到提升,從而使羅非魚皮Ⅰ型膠原蛋白免疫刺激能力下降。該結(jié)果與何創(chuàng)龍等[30]的研究結(jié)果相似:運(yùn)用ELISA間接法檢測(cè)植入一種骨膠原材料后兔血清的抗體含量,確定該材料的抗原特性從而得出該材料可引起較低的免疫反應(yīng)。以上結(jié)果表明,羅非魚皮膠原Ⅰ型蛋白可以作為一種蛋白質(zhì)材料在一定時(shí)間內(nèi)存在于生物體內(nèi)而不發(fā)生嚴(yán)重的免疫反應(yīng)。
2.3羅非魚皮Ⅰ型膠原蛋白免疫小鼠產(chǎn)生的IgG、IgA、IgM含量
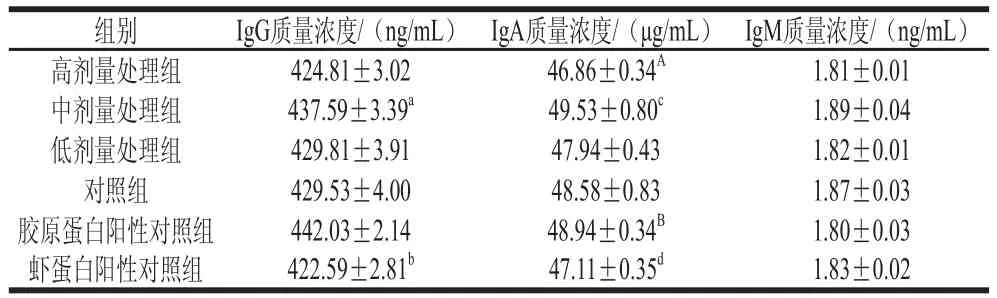
表1 羅非魚皮Ⅰ型膠原蛋白免疫小鼠的IgG、IgA、IgM質(zhì)量濃度Table 1 IgG, IgA and IgM concentrations in tilapia skin type Ⅰcollagen-immunized mice
3 次免疫反應(yīng)后對(duì)小鼠體內(nèi)的IgG、IgA、IgM含量進(jìn)行酶聯(lián)免疫分析法測(cè)定。由表 1可知,中劑量處理組的IgG質(zhì)量濃度顯著高于蝦蛋白陽(yáng)性對(duì)照組(P<0.05),低、高劑量處理組和對(duì)照組在小鼠體內(nèi)的免疫反應(yīng)沒(méi)有發(fā)現(xiàn)顯著差異(P>0.05)。這說(shuō)明中劑量的羅非魚皮Ⅰ型膠原蛋白可以刺激小鼠免疫系統(tǒng)產(chǎn)生高質(zhì)量濃度的IgG。其原因可能是低劑量條件下膠原蛋白活潑基團(tuán)的暴露量較少,IgG在蛋白分子上的吸附量較低,致免作用較弱。當(dāng)膠原蛋白劑量逐漸增大時(shí),伴隨著膠原蛋白活潑羥基群含量的提升,補(bǔ)體活化作用顯著增強(qiáng),并刺激小鼠免疫系統(tǒng)產(chǎn)生大量的IgG。而高劑量的膠原蛋白抗原含量較高,會(huì)較快地與新產(chǎn)生的IgG免疫球蛋白結(jié)合并被吞噬細(xì)胞吞噬,從而造成IgG檢測(cè)量偏低。對(duì)比處理組和陽(yáng)性對(duì)照組,中劑量處理組羅非魚皮Ⅰ型膠原蛋白產(chǎn)生的IgG質(zhì)量濃度要高于同劑量添加佐劑的蝦蛋白陽(yáng)性對(duì)照組,這表明羅非魚皮Ⅰ型膠原蛋白在小鼠體內(nèi)的免疫反應(yīng)強(qiáng)于蝦蛋白粗提取液。添加佐劑的羅非魚皮Ⅰ型膠原蛋白(膠原蛋白陽(yáng)性對(duì)照組)產(chǎn)生的IgG質(zhì)量濃度最高,這表明佐劑的存在會(huì)增強(qiáng)IgG的質(zhì)量濃度水平從而產(chǎn)生更有效的保護(hù)性免疫。在IgA質(zhì)量濃度測(cè)定中,羅非魚皮Ⅰ型膠原蛋白各劑量處理組的IgA質(zhì)量濃度測(cè)定結(jié)果與IgG相似,高劑量處理組的IgA質(zhì)量濃度極顯著低于膠原蛋白陽(yáng)性對(duì)照組(P<0.01)。中劑量處理組的IgA質(zhì)量濃度高于高、低劑量處理組。這種情況在IgM的測(cè)定結(jié)果中更為明顯。膠原蛋白陽(yáng)性對(duì)照組IgM質(zhì)量濃度低于蝦蛋白陽(yáng)性對(duì)照組,這表明羅非魚皮Ⅰ型膠原蛋白對(duì)IgM產(chǎn)生的影響小于斑節(jié)對(duì)蝦蝦蛋白。
作為體液免疫系統(tǒng)中重要的免疫效應(yīng)分子,免疫球蛋白IgG、IgA和IgM在生物體內(nèi)的含量可以直接體現(xiàn)免疫反應(yīng)的發(fā)生情況[31-32]。侯小萍等[33]研究了Ⅲ型豬膠原蛋白膜免疫實(shí)驗(yàn)兔后IgG、IgM和IgA抗體含量,從而確定其免疫特性,作為鑒定該材料是否可以用于鼓膜移植材料的一個(gè)依據(jù)。孫澤威等[34]也用類似方法對(duì)犢牛血清中大豆抗原特異性抗體IgG的含量進(jìn)行了ELISA檢測(cè)。IgG是體液免疫最重要的一個(gè)生物反應(yīng)指標(biāo),它是血清主要的抗體成分,約占血清免疫球蛋白含量的75%。其主要功能是在機(jī)體免疫中起保護(hù)作用,如抗菌、抗病毒,應(yīng)對(duì)麻疹、甲型肝炎等,能有效地預(yù)防相應(yīng)的感染性疾病。本實(shí)驗(yàn)中羅非魚皮Ⅰ型膠原蛋白引起小鼠體內(nèi)IgG的變化進(jìn)一步驗(yàn)證了羅非魚皮Ⅰ型膠原蛋白具有一定的抗原性[29]。IgA在正常人血清中的含量?jī)H次于IgG,占血清免疫球蛋白含量的10%~20%,也常與其他免疫球蛋白抗體一起作為抗原反應(yīng)特性的依據(jù)。血清檢出IgM 提示新近發(fā)生感染,可用于早期感染的診斷依據(jù),因此本實(shí)驗(yàn)也對(duì)其進(jìn)行了測(cè)定[32]。膠原蛋白陽(yáng)性對(duì)照組的IgA質(zhì)量濃度高于蝦蛋白陽(yáng)性對(duì)照組,表明羅非魚皮Ⅰ型膠原蛋白的抗原性強(qiáng)于斑節(jié)對(duì)蝦蛋白。并且小鼠體內(nèi)初次遭遇蛋白質(zhì)抗原后最早回應(yīng)出現(xiàn)的循環(huán)抗體為IgM, 但I(xiàn)gM在血液中的含量會(huì)因清除作用而迅速下降。因此羅非魚皮Ⅰ型膠原蛋白IgM質(zhì)量濃度較斑節(jié)對(duì)蝦蛋白低,也證明其抗原性高于后者,應(yīng)作進(jìn)一步的檢測(cè)以確定其影響強(qiáng)度。
3 結(jié) 論
本實(shí)驗(yàn)中羅非魚皮Ⅰ型膠原蛋白在SDS-PAGE圖中顯示由α鏈和β鏈構(gòu)成。羅非魚皮Ⅰ型膠原蛋白免疫穩(wěn)定后ICR小鼠產(chǎn)生的Ⅰ型膠原蛋白抗體質(zhì)量濃度范圍為160.50~164.25 μg/L,不同劑量處理組間顯示出較小的差別,僅為2%,該結(jié)果也顯示出羅非魚皮Ⅰ型膠原蛋白的低抗原性。用不同劑量的羅非魚皮Ⅰ型膠原蛋白免疫ICR小鼠后,IgG、IgA、IgM作為特征性免疫球蛋白,在各劑量處理組之間差異不大,其質(zhì)量濃度范圍分別是424.81~437.59 ng/mL、46.86~49.53 μg/mL、1.81~1.89 ng/mL。IgG、IgA、IgM的檢測(cè)結(jié)果也顯示羅非魚皮Ⅰ型膠原蛋白的低抗原性。與Song等[16]的研究結(jié)果比較,羅非魚皮Ⅰ型膠原蛋白和水母膠原蛋 白同樣可以引起較弱的免疫反應(yīng),可知結(jié)果的有效性。羅非魚皮Ⅰ型膠原蛋白低抗原性的結(jié)論暗示羅非魚Ⅰ型膠原蛋白作為食品的安全性及其作為生物材料的可能性。
參考文獻(xiàn):
[1]FLECK C A, SIMMAN R. Modern collagen wound dressings: function and purpose[J]. The Journal of the American College of Certifi ed Wound Specialists, 2010, 2(3): 50-54.
[2]CHEN J L, LI Q L, CHEN J Y, et al. Improvin g blood-compatibility of titanium by coating collagen: heparin multilayers[J]. Applied Surface Science, 2009, 255(15): 6894-6900.
[3]沈同, 王鏡巖. 生物化學(xué)[M]. 北京: 高等教育出版社, 1981: 157.
[4]BROWN E M. 膠原的結(jié)構(gòu): 天然膠原和改性膠原的網(wǎng)絡(luò)結(jié)構(gòu)[J]. 皮革科學(xué)與工程, 2005, 15(1): 26-30.
[5]張達(dá)江, 王亮. Ⅰ型膠原蛋白的結(jié)構(gòu), 功能及其應(yīng)用研究的現(xiàn)狀與前景[J]. 生物技術(shù)通訊, 2006, 17(2): 265-269.
[6]PATI F, DHARA S, ADHIKARI B. Fish collagen: a potential material for biomedical application[C]//Students’ Technology Symposium (TechSym), 2010 IEEE. IEEE, 2010: 34-38.
[7]李賀, 鄭庚修, 王秋芬, 等. 生物醫(yī)學(xué)材料膠原蛋白的研究進(jìn)展(Ⅱ):膠原的性質(zhì)及其在生物醫(yī)學(xué)領(lǐng)域的應(yīng)用[J]. 中國(guó)皮革, 2006, 35(3): 27-31.
[8]GIRAUD-GUILLE M M, BESSEAU L, CHOPIN C, et al. Structural aspects of fish skin collagen which forms ordered arrays via liquid crystalline states[J]. Biomaterials, 2000, 21(9): 899-906.
[9]LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69.
[10]SADOWSKA M, KO?ODZIEJSKA I, NIECIKOWSKA C. Isolation of collagen from the skins of Baltic cod (Gadus morhua)[J]. Food Chemistry, 2003, 81(2): 257-262.
[11]KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576.
[12]GóMEZ-GUILLéN M C, TURNAY J, FERNáNDEZ-DIAZ M D, et al. Structural and physical properties of gelatin extracted from different marine species: a comparative study[J]. Food Hydrocolloids, 2002, 16(1): 25-34.
[13]LEE C H, SINGLA A, LEE Y. Biomedical applications of collagen[J]. International Journal of Pharmaceutics, 2001, 221(1): 1-22.
[14]LYNN A K, YANNAS I V, BONFIELD W. Antigenicity and immunogenicity of collagen[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2004, 71(2): 343-354.
[15]LOTT J M, SEHRA S, MEHROTRA P, et al. Type V collagen-induced tolerance prevents airway hyperresponsiveness[J]. American Journal of Respiratory and Critical Care Medicine, 2013, 187(4): 454-457.
[16]SONG E, YEON KIM S, CHUN T, et al. Collagen scaffolds derived from a marine source and their biocompatibility[J]. Biomaterials, 2006, 27(15): 2951-2961.
[17]SARMA N J, TIRIVEEDHI V, MOHANAKUMAR T. Detection of antibodies to self-antigens (K-alpha 1 tubulin, collagen Ⅰ, Ⅱ, Ⅳ, and Ⅴ, myosin, and vime ntin) by enzyme-linked immunosorbent assay (ELISA)[M]//ZACHARY A A, LEFFELL M S. Transplantation immunology. New Jersey: Humana Press, 2013: 335-341.
[18]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[19]李德娟, 何巍, 張睿, 等. 氫氧化鋁佐劑配制工藝的優(yōu)化[J]. 中國(guó)生物制品學(xué)雜志, 2010, 23(10): 1135-1137.
[20]BURRELL L S, LINDBLAD E B, WHITE J L, et al. Stability of aluminium-containing adjuvants to autoclaving[J]. Vaccine, 1999, 17(20): 2599-2603.
[21]ADACHI A, TANAKA A, CHINUKI Y. Identification of 70 kDa shrimp protein as a possible new allergen for shrimp allergy[J]. Arerugi, 2013, 62(8): 960-967.
[22]DAUL C B, SLATTERY M, REESE G, et al. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin[J]. International Archives of Allergy and Immunology, 1994, 105(1): 49-55.
[23]HOGENESCH H, DUNHAM A, HANSEN B, et al. Formulation of a killed whole cell pneumococcus vaccine-effect of aluminum adjuvants on the antibody and IL-17 response[J]. Journal of Immune Based Therapies and Vaccines, 2011, 9(1): 5. doi: 10.1186/1476-8518-9-5.
[24]DENG Lijuan, XU Yan, HUANG Jian. Developing a double-antigen sandwich ELISA for effective detection of human hepatitis B core antibody[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2008, 31(6): 515-526.
[25]HU Weiping, LU Yang, PRECIOSO N A, et al. Double-antigen enzyme-linked immunosorbent assay for detection of hepatitis E virusspecific antibodies in human or swine sera[J]. Clinical and Vaccine Immunology, 2008, 15(8): 1151-1157.
[26]陳申如, 蔡揚(yáng)鵬, 周瓊, 等. 鯊魚魚皮、魚骨膠原蛋白的純化及其特性的初步研究[J]. 中國(guó)食品學(xué)報(bào), 2006, 6(1): 173-178.
[27]陳申如, 蔡揚(yáng)鵬, 周瓊, 等. 魚骨膠原蛋白的純化及其特性的初步研究[J]. 食品科學(xué), 2006, 27(11): 177-181.
[28]NAGAI T, SUZUKI N. Isolation of collagen from fi sh waste material: skin, bone and fi ns[J]. Food Chemistry, 2000, 68(3): 277-281.
[29]潘冰青. 魚類膠原蛋白的分離純化及其過(guò)敏原性研究[D]. 廈門: 集美大學(xué), 2011.
[30]何創(chuàng) 龍, 王遠(yuǎn)亮, 黃爭(zhēng)鳴, 等. 無(wú)細(xì)胞骨膠原基質(zhì)的理化性能和組織相容性研究[J]. 生物醫(yī)學(xué)工程學(xué)雜志, 2007, 24(3): 538-543.
[31]UNDERDOWN B J, SCHIFF J M. Immunoglobulin A: strategic defense initiative at the mucosal surface[J]. Annual Review of Immunology, 1986, 4(1): 389-417.
[32]GEISBERGER R, LAMERS M, ACHATZ G. The riddle of the dual expression of IgM and IgD[J]. Immunology, 2006, 118(4): 429-437.
[33]侯小萍, 江德勝, 李兆基, 等. 異種膠原生物膜鼓膜移植的生物相容性研究[J]. 山東醫(yī)大基礎(chǔ)醫(yī)學(xué)院學(xué)報(bào), 2001, 15(3): 135-137.
[34]孫澤威, 秦貴信, 張慶華, 等. 蒸汽熱處理對(duì)全脂大豆中主要抗原蛋白免疫原性的影響[J]. 營(yíng)養(yǎng)學(xué)報(bào), 2006, 28(6): 522-525.
Antigen Response Properties of Tilapia Skin Type I Collagen
ZHANG Jingyi1, WU Wenhui2, WANG Nanping3, HE Lan3, Elango JEEVITHAN1, BAO Bin1,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation, Shanghai 201306, China; 3. Shanghai Fisheries Research Institute, Shanghai 200433, China)
Abstract:Objective: To investigate the antigenicity of type I collagen isolated from tilapia skin and evaluate its biocompatibility. Methods: The purity of tilapia skin collagen was confirmed by SDS-PAGE, and the antigenicity was evaluated by measuring the changes in serum IgG, IgA and IgM induced by tilapia skin type I collagen in ICR mouse model using ELISA. Results: The tilapia skin type I collagen was pure. The antibody concentrations of tilapia skin collagenimmunized mice were 160.50–164.25 μg/L, and the concentrations of IgG, IgA and IgM were 424.81–437.59 ng/mL, 46.86–49.53 μg/mL and 1.81–1.89 ng/mL, respectively. Conclusion: Tilapia skin type I collagen has weak antigenicity responsitivty and proved to have superior biocompatibility for biomedical applications.
Key words:collagen; immunization; enzyme-linked immune sorbent assay (ELISA); antigenicity
doi:10.7506/spkx1002-6630-201507015
中圖分類號(hào):TS201.2
文獻(xiàn)標(biāo)志碼:A
文章編號(hào):1002-6630(2015)07-0079-05
*通信作者:包斌(1965—),女,副教授,碩士,研究方向?yàn)楹Q筇烊划a(chǎn)物化學(xué)。E-mail:bbao@shou.edu.cn
作者簡(jiǎn)介:張靜怡(1988—),女,碩士研究生,研究方向?yàn)楹Q笏幬铩-mail:zhangjyj@163.com
基金項(xiàng)目:國(guó)家自然科學(xué)基金委員會(huì)主任基金項(xiàng)目(81341082);國(guó)家高技術(shù)研究發(fā)展計(jì)劃(863計(jì)劃)項(xiàng)目(2011AA09070109)
收稿日期:2014-05-06

