內源活性肽Apelin-13對高血壓大鼠心肌纖維化的影響及機制
陶 陽,張 志,王瀅瀅遼寧醫學院附屬第三醫院 心內科,遼寧錦州 00;遼寧醫學院附屬第一醫院 呼吸內科,遼寧錦州00
內源活性肽Apelin-13對高血壓大鼠心肌纖維化的影響及機制
陶 陽1,張 志1,王瀅瀅2
1遼寧醫學院附屬第三醫院 心內科,遼寧錦州 121001;2遼寧醫學院附屬第一醫院 呼吸內科,遼寧錦州121001
目的探討內源性活性肽Apelin-13對高血壓大鼠心肌纖維化(myocardial fibrosis,MF)的影響并初步探討其機制。方法將40只8周齡雄性SD大鼠隨機分組,對其中32只大鼠施行腹主動脈狹窄(abdominal aorta coarctation,AAC)術,8只施行假手術,將造模后成活的大鼠隨機分成模型組、Apelin-13組(10μg/kg),纈沙坦(valsartan,VST)組[5 mg/(kg·d)]。觀察Apelin-13對高血壓大鼠心臟功能及血流動力學指標的影響;ELISA法測定血清Ang(1-7)、AngⅡ的濃度;Western觀察大鼠心肌轉化生長因子β1(transforming growth factor beat 1,TGF-β1)、組織抑制因子(tissue inhibitor of metalloproteinase,TIMP)、血漿纖溶酶原激活抑制劑-1(plasminogen activator onhibitor,PAI-1)、金屬蛋白酶-2(matrix metalloproteinase 2,MMP-2)的表達水平;HE和Masson染色觀察心肌組織膠原沉積情況,圖像分析測量心肌組織膠原容積分數(collagen volume fraction,CVF)。結果心功能AAC組較假手術組、Apelin-13組、VST組明顯降低(P<0.05),VST組較Apelin組減低(P<0.05)。血清Ang-(1-7) AAC組較藥物治療組降低,Ang(Ⅱ)增加(P<0.05),Apelin組與VST組差異無統計學意義(P>0.05)。Apelin-13組、VST組和AAC組中CVF及蛋白TIPM-1、TGF-β1、PAI-1的表達高于假手術組(P<0.05),且兩種藥物治療組明顯低于AAC組,Apelin-13組低于VST組(P<0.05),而MMP-2蛋白的表達低于假手術組。結論Apelin-13可能通過抑制腎素-血管緊張素-醛固酮系統,進而抑制TGF-β1、PAI-1、TIMP-1和增加MMP-2的表達以改善高血壓心肌纖維化。
Apelin-13;高血壓;腹主動脈縮窄;心肌纖維化;大鼠
高血壓心臟病(hypertensive cardiovascular disease,HHD)是高血壓主要的并發癥之一,其主要的致病機制是長期壓力超負荷,使兒茶酚胺與血管緊張素AngⅡ等生長因子刺激心肌細胞肥大和間質纖維化[1]。有研究認為,神經內分泌系統的激活,使心肌成纖維細胞過度增殖,以及基質金屬蛋白酶(matrix metalloproteinases,MMP)與組織抑制因子(tissue inhibitor of metalloproteinase,TIMP)平衡失調,合成細胞外基質增加,導致膠原合成代謝和降解代謝失衡是心肌纖維化(myocardial fibrosis,MF)不斷進展的內在機制之一。Apelins是由同一基因編碼的具有不同分子結構的一組內源活性肽,血管緊張素1型相關蛋白受體APJ(又命名為AGTRL1)是它的內源型配體[2]。Apelin/APJ具有降低血壓、改善心臟功能、保護心肌損傷、促進新生血管生成、調節水鹽及脂肪代謝等重要作用[3]。Apelin前蛋白原可生成Apelin-36、Apelin-13、Apelin-12等多肽,其中以Apelin-13生物活性較高,有很好的降壓作用。我們猜想Apelin-13改善心功能的作用是否與抑制心肌纖維化有關。本實驗在成功建立高血壓大鼠模型的基礎上,外源性給予Apelin-13,觀察高血壓大鼠心臟功能,血漿Ang(1-7)、AngⅡ的濃度,心肌轉化生長因子β1(transforming growth factor beat 1,TGF-β1)、TIMP、血漿纖溶酶原激活抑制劑-1(plasminogen activator onhibitor,PAI-1)、金屬蛋白酶-2(matrix metalloproteinase 2,MMP-2)蛋白的表達水平,以探討Apelin-13預防高血壓心臟病心肌纖維化的可能機制。
材料和方法
1 主要試劑 Apelin-13(北京康肽生物科技有限公司),纈沙坦(valsartan,VST)(桂林華信制藥有限公司),Elisa試劑盒(上海恒遠技術發展有限公司),Masson試劑盒[將來試劑(上海)有限公司],Western一抗(北京博奧森生物技術有限公司)。
2 腹主動脈縮窄高血壓模型建立 SPF級8周齡雄性Sprague Dawly(SD)大鼠40只,體質量為220 ~250 g,由遼寧醫學院實驗動物研究所提供,并取得遼寧醫學院動物倫理委員會許可。大鼠5只/籠,在恒溫(22~24℃),恒濕(60%),12 h明暗交替環境中飼養,自由進食水。適應環境1周后行腹主動脈狹窄(abdominal aorta coarctation,AAC)術(隨機選取32)。1%戊巴比妥50 mg/kg腹腔注射麻醉,固定、剃毛、常規消毒,分層打開腹腔,在右腎上緣分開腹膜等軟組織,暴露腹主動脈,并在雙腎動脈上0.5 cm處用內徑0.7 mm的銀夾造成腹主動脈狹窄,分層關閉腹腔。8只未用銀夾分離腹主動脈的大鼠作假手術組。造模7 d內32只造模大鼠6只死亡退出實驗。
3 實驗分組 共分4組,假手術組8只,AAC組8只,Apelin組8只(分組時為10只,置入微量泵2 d內死亡2只退出實驗),纈沙坦組8只。其中Apelin組背部除毛并用75%乙醇消毒,剪刀剪開背部皮膚、皮下,置入預裝Apelin-13的微量泵,Apelin-13的釋放量為3 μg/d(約10 μg/kg),然后縫合。纈沙坦組5 mg/(kg·d)(原藥粉劑用蒸餾水配制1 g/L,每天上午9:00 - 10:00灌胃),各組均正常進食水,8周后進行各指標檢測。
4 心臟超聲檢查 置入微量泵8周后,行超聲檢查,大鼠稱重后給予1%戊巴比妥30 mg/kg淺麻醉,仰臥位固定,前胸剪毛,PHILIPSONOS7500型超聲掃描儀及12 MHz探頭,測定其心臟舒張末期室間隔厚度、舒張末期左心室后壁、射血分數及左心室縮短分數,每一超聲測定值取3個連續心動周期測量的均值。
5 血流動力學檢查及取材 置入微量泵第9周,以異戊巴比妥50 mg/kg腹腔注射將大鼠麻醉,仰臥位固定,頸部切開,分離右頸總動脈,切開后插入直徑1 mm且有1%肝素的心導管,接BL420F生物機能分析系統,測量完畢后,斷脊髓處死大鼠,開胸取出心臟,稱重,保存心肌組織。
6 HE及Masson染色觀察心肌組織形態學變化、計算心肌組織膠原容積分數(collagen volume fraction,CVF) 心尖組織經4%甲醛溶液固定24 h,脫水,石蠟包埋,切片后行Masson染色。光鏡下觀察心肌組織形態學變化,Image Proplus 6.0分析圖像,通過灰度調節區別膠原和非膠原成分,測算心肌組織膠原容積分數,CVF=心肌血管周圍膠原面積/血管腔面積,每張切片均隨機取4個視野測量,計算其平均值。
7 ELISA法檢測血漿AngⅡ、Ang(1-7)濃度 每只大鼠在行血流動力學檢測后經心臟取血5 ml,離心(2 000 r/min,20 min)經心臟取血5~6 ml并分離血漿后,采用ELISA法進行測定。檢測步驟嚴格按照試劑盒說明書的要求進行操作,結果在全自動酶標儀上進行比色分析。
8 Western-blotting檢測心肌組織中TIPM-1、TGF-β1、PAI-1、MMP-2的蛋白表達 1)制備蛋白提取液:取-70℃凍存的小鼠心肌組織標本100 mg,在RIPA裂解緩沖液500 μl中裂解,冰浴下超聲勻漿,4℃離心(2 000 r/min,30 min),取上清液,酚試劑法測定蛋白濃度后,制成蛋白含量相等的樣品。2)SDS-聚丙烯酰胺凝膠電泳。3)轉膜。4)雜交:5%脫脂奶粉封閉2 h或過夜,TBST洗膜5 min×3次,滴加兔抗鼠TIMP-1、TGF-β1、PAI-1、MMP-2一抗4℃孵育過夜,TBST洗膜5 min×3次,以相應堿性磷酸酶標記的二抗室溫孵育2 h,TBST洗膜5 min×3次。5)顯色。6)成像分析:于掃描儀上成像,用Scion Corporation分析軟件對電泳條帶進行灰度值測定。以Mark的吸光度值(A)為100%,與實驗各組進行比較和半定量分析。
9 統計學處理 數據資料采用SPSS17.0軟件處理。所有數據均以±s表示,組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
結 果
1 各組大鼠心臟形態與功能特點結果分析與假手術組比較,手術組及治療組心臟質量、左心質量、左心室收縮末期壓力、短軸縮短分數、心肌組織膠原容積分數等指標明顯增高,而左心室壓力最大上升速率(+dP/dtmax)、左心室壓力最大下降速率(-dP/ dtmax)等血流動力學指標明顯減低(P<0.05),Apelin-13與纈沙坦均具改善高血壓大鼠心功能、血流動力學及心肌纖維的作用(P<0.05),且Apelin-13部分指標優于纈沙坦(P<0.05),見表1。
2 HE染色各組心肌細胞形態比較 假手術組心肌細胞形態、細胞質、間質及橫/縱紋均正常,肌纖維排列整齊,細胞質豐富均勻,期間很少見紅細胞。而模型組心肌排列紊亂,肌絲變粗,波浪樣改變,細胞水腫,橫/縱紋不清.壞死心肌周圍有不同程度的炎癥細胞浸潤和間質水腫,肌絲間可見大量紅細胞,有新毛細血管形成。纈沙坦組與Apelin組心肌病變較模型組輕微,且Apelin組優于纈沙坦組。見圖1。
3 Massion染色各組大鼠心肌膠原含量比較Masson染色時膠原纖維呈藍色,心肌肌纖維呈紅色,細胞核染成橘紅色,可見假手術組中有少量膠原纖維,而模型組可見大量膠原纖維,纈沙坦組與Apelin組可見膠原纖維,但明顯少于模型組,并且Apelin組的膠原纖維明顯少于纈沙坦組。見圖2。
4 各組大鼠心肌組織中蛋白TIPM-1、TGF-β1、PAI-1、MMP-2表達與Mark的比值 假手術組與手術組TIPM-1、TGF-β1、PAI-1、MMP-2差異有統計學意義(P<0.05),纈沙坦組和Apelin組與模型組差異均有統計學意義(P<0.05),且Apelin組與纈沙坦組差異有統計學意義(P<0.05)。見圖3、圖4。
5 各組大鼠血漿中血管緊張素Ⅱ、Ang(1-7)水平比較 假手術組與手術組血管緊張素Ⅱ、Ang(1-7)差異有統計學意義(P<00.05),纈沙坦組和Apelin組與模型組差異均有統計學意義(P<0.05),但Apelin組與纈沙坦組無統計學差異(P>0.05)。見表2。
表1 各組大鼠心臟形態學與功能學特點Tab. 1 Cardiac morphology and function in rats from different groups (±s)

表1 各組大鼠心臟形態學與功能學特點Tab. 1 Cardiac morphology and function in rats from different groups (±s)
aP<0.05, vs AAC;bP<0.05, vs AAC;cP<0.05, vs AAC;dP<0.05, vs VST; LVW: left ventricular weight; FS: fractional shortening; LVEDD: left ventricular end-diastolic diameter; P/dtmax: Left ventricular pressure change rate
?

表2 大鼠血漿血管緊張素Ⅱ、Ang(1-7)水平比較Tab. 2 Comparison of serum Ang Ⅱand Ang (1-7) levels

圖 1 大鼠心肌組織HE染色 (×400)Fig. 1 Hematoxylin-eosin staining of myocardial tissue in sham group (A), AAC group (B),VST group (C) and Apelin group (D) (×400)

圖 2 大鼠心肌組織Masson染色結果(×400)Fig. 2 Masson staining of myocardial tissue in sham group (A), AAC group (B), VST group (C) and Apelin group (D) (×400)

圖 3 大鼠心肌組織中蛋白TIPM-1、 TGF-β1、 PAI-1、 MMP-2表達與Mark的比值Fig.3 Protein expression of TIPM-1, TGF-β1, PAI-1, MMP-2 and Mark ratio P<0.05, vs AAC,P<0.05, vs AAC,P<0.05, vs AAC ,P<0.05, vs VST
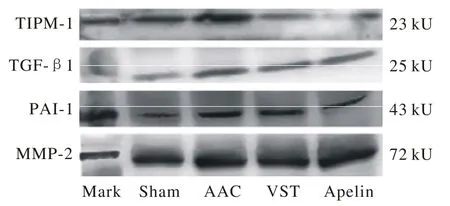
圖 4 Western-blotting法檢測大鼠心肌組織中TIPM-1、TGF-β1、PAI-1、MMP-2蛋白的表達Fig. 4 Western-blotting showing electrophoretic bands of TIPM-1, TGF-β1, PAI-1, MMP-2 in myocardial tissue of rats
討 論
高血壓可引起持續性壓力超負荷,致使心肌代償性肥厚,但心肌數量并不增加,主要以心肌纖維增多為主,而心肌纖維化導致心肌順應性變差,舒縮功能降低,心臟舒張末壓增高,導致的心臟結構和功能改變[4]。目前對高血壓左心室重構的病理改變進行了較深入地研究,認為高血壓左心室重構的病理改變主要有LVH和心肌纖維化。然而,心肌的纖維化必然導致心臟的舒縮功能降低,最終導致不可逆的心力衰竭[5]。
導致HHD患者心肌纖維化的機制很多,目前研究較多的與MF相關的神經內分泌系統主要包括RAS及交感神經系統,研究認為,神經內分泌系統的激活,使心肌成纖維細胞過度增殖,以及基質金屬蛋白酶與組織抑制因子平衡失調[6],合成細胞外基質增加,導致膠原合成代謝和降解代謝失衡是MF不斷進展的內在機制之一,而RAS的過度激活也與MF關系密切,RAS系統中的主要效應因子AngⅡ是心肌膠原網絡重塑的重要因子[7],AngⅡ也會刺激心肌成纖維細胞中的TGF-β1分泌增多。AngⅡ通過TGF-β1促進心肌細胞增殖、分化以及細胞外基質沉積的作用[8-9],多項實驗表明,TGF-β1 Smads信號通路亦是介導高血壓MF的重要通路,TGF-β1過表達可誘導高血壓大鼠中血管平滑肌細胞的增殖,且隨著心臟功能的不斷惡化,TGF-β1的mRNA表達逐漸增加,說明高血壓大鼠的心室重構與TGF-β1 Smad通路有關。對鹽敏感型高血壓大鼠的研究也發現,TGF-β1在主動脈中的mRNA表達水平明顯高于對照組[10]。上述資料說明AngⅡ、TGF-β1在高血壓所致心力衰竭的發病機制中發揮著重要作用。本實驗通過腹主動脈結扎致大鼠血壓增高,持續的高血壓導致心肌左心室重量增加、心肌細胞肥大、血管周圍纖維化和間質纖維化,左心室收縮末期壓力、左心室舒展末期壓力、左心室壓力最大上升速率、左心室壓力最大下降速率等心臟功能學指標明顯下降。上述指標證明了高血壓心臟病存在明顯的心肌纖維化,且心肌纖維化越重,心功能越差,我們可以推斷,高血壓可以導致心肌纖維化,而心肌纖維化又是高血壓心力衰竭的病理表現之一。
Apelin/APJ在血管及心臟結構中的相關細胞存在特定表達,并且APJ在一些平滑肌細胞中也有表達[11],并與AngⅡ有31%的同源性,但與AngⅡ的病理生理作用卻是截然相反的[12]。大量實驗證明,Apelin/APJ具有降低血壓、改善心臟功能、保護心肌損傷、預防心肌自噬[13]、促進新生血管生成、調節水鹽及脂肪代謝等重要作用。Ashenaqar等[14]通過研究自發性高血壓大鼠腎上腺內基因的表達,發現有128個高血壓相關基因表達下調,其中含有調控Apelin表達的相關基因,間接說明Apelin參與高血壓的形成過程。Naiafipour等[15]在給兩腎一夾大鼠靜脈注射Apelin后出現了明顯的收縮壓和舒張壓降低,Apelin降動脈壓的效果優于降舒張壓,并且對高血壓大鼠的降壓效果優于正常組[16]。Tatemoto等[17]給予大鼠一定濃度Apelin后,大鼠的平均動脈壓呈劑量依賴性下降。Japp等[18]發現Apelin可以降低心肌耗氧量、增加心肌收縮力,降低血壓,但不引起心肌肥厚[19]。外源性應用Apelin-13治療后測量心臟各部分重量及與體質量比值、心臟超聲及血流動力學,證明Apelin能較好改善心臟功能。通過HE及Masson染色證明了Apelin能較好改善心肌纖維化及預防心室重構。ELISA測量血清中AngⅡAAC組明顯高于假手術組和治療組,而Ang(1-7)則相反,AngⅡ越高心功能越差,初步考慮AngⅡ可以使心功能惡化,Ang(1-7)可以改善心功能。ELISA及Western證明了Apelin-13是通過抑制AngⅡ的表達、減少TGF-β1及PAI-1的表達、加強MMP-2的表達,而改善心肌纖維化及預防心室重構。但Wesrern結果證明纈沙坦和Apelin有差異,而ELISA測定AngⅡ、Ang(1-7)的表達無差異。說明Apelin抑制纖維化的作用不僅是通過本實驗證明的機制,還有其他機制,這有待于進一步研究證明。
綜上所述,外源性Apelin-13具有降低血壓、心率、預防心肌纖維化和改善心功能的作用。Apelin改善心功能的作用可能是通過抑制腎素-血管緊張素-醛固酮系統、降低AngⅡ及減少TGF-β1及PAI-1的表達、加強MMP-2的表達,而抑制心肌纖維化實現的;而心肌纖維越重,心功能則越差,Apelin可以降低收縮壓,抑制心肌纖維化,延緩高血壓心力衰竭的發生。因此,Apelin也許會為高血壓及高血壓心臟病的預防提供新的思路。
1 葛均波,徐永健,霍勇,等.內科學[M]. 8版.北京:人民衛生出版社,2013:258-271.
2 Barnes G, Japp AG, Newby DE. Translational promise of the apelin--APJ system[J]. Heart, 2010, 96(13): 1011-1016.
3 Galanth C, Hus-Citharel A, Li B, et al. Apelin in the control of body fluid homeostasis and cardiovascular functions[J]. Curr Pharm Des, 2012, 18(6): 789-798.
4 Santos M, Shah AM. Alterations in cardiac structure and function in hypertension[J]. Curr Hypertens Rep, 2014, 16(5): 428.
5 Quercioli A, Mach F, Montecucco F. Novel treatment strategy with direct renin inhibition against heart failure[J]. Panminerva Med,2010, 52(1):41-51.
6 Leask A. Potential therapeutic targets for cardiac fibrosis: TGFbeta,angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation[J]. Circ Res, 2010, 106(11): 1675-1680.
7 陳劍,周瑞莉.血管緊張素Ⅱ及轉化生長因子α在糖尿病心肌病發病機制中的作用[J].嶺南心血管病雜志,2012,18(3):246-248.
8 褚燕,譚明旗.轉化生長因子-β及其Smad信號轉導通路在肺纖維化中的作用[J].中國醫藥指南,2013,11(3):52-53.
9 Maya L, Villarreal FJ. Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis[J]. J Mol Cell Cardiol,2010, 48(3): 524-529.
10 Jing L, Zhang JZ, Zhao L, et al. High-expression of transforming growth factor beta1 and phosphorylation of extracellular signalregulated protein kinase in vascular smooth muscle cells from aorta and renal arterioles of spontaneous hypertension rats[J]. Clin Exp Hypertens, 2007, 29(2): 107-117.
11 Thomas MC, Pickering RJ, Tsorotes D, et al. Genetic ace2 deficiency accentuates vascular inflammation and atherosclerosis in the ApoE knockout mouse[J]. Circ Res, 2010, 107(7): 888-897.
12 Oudit GY, Crackower MA, Backx PH, et al. The role of ACE2 in cardiovascular physiology[J]. Trends Cardiovasc Med, 2003, 13(3):93-101.
13 焦慧,張志,馬清華,等.Apelin-13對葡萄糖剝奪乳鼠心肌細胞自噬的影響及機制[J].解放軍醫學院學報,2013,34(2):167-171.
14 Ashenagar MS, Tabuchi M, Kinoshita K, et al. Gene expression in the adrenal glands of three spontaneously hypertensive rat substrains[J]. Mol Med Rep, 2011, 3(2): 213-222.
15 Najafipour H, Soltani Hekmat A, Nekooian AA, et al. Apelin receptor expression in ischemic and non- ischemic kidneys and cardiovascular responses to apelin in chronic two-kidney-one-clip hypertension in rats[J]. Regul Pept, 2012, 178(1/3): 43-50.
16 柏丹娜,高延,李紅梅,等.Apelin-13對自發性高血壓大鼠的降壓調節作用的研究[J].心臟雜志,2010,22(4):514-516.
17 Tatemoto K, Takayama K, Zou MX, et al. The novel peptide apelin lowers blood pressure via a nitric oxide-dependent mechanism[J]. Regul Pept, 2001, 99(2/3): 87-92.
18 Japp AG, Cruden NL, Barnes G, et al. Acute cardiovascular effects of apelin in humans: potential role in patients with chronic heart failure[J]. Circulation, 2010, 121(16):1818-1827.
19 Koguchi W, Kobayashi N, Takeshima H, et al. Cardioprotective effect of apelin-13 on cardiac performance and remodeling in endstage heart failure[J]. Circ J, 2012, 76(1): 137-144.
Effect of apelin-13 on myocardial fibrosis in hypertensive rats and its underlying mechanism
TAO Yang1, ZHANG Zhi1, WANG Yingying2
1Department of Cardiology, The Third Affiliated Hospital of Liaoning Medical university, Jinzhou 121001, Liaoning Province, China;2Department of Cardiology, The First Affiliated Hospital of Liaoning Medical university, Jinzhou 121001, Liaoning Province, China
ZHANG Zhi. Email: ningcheng631@163.com
ObjectiveTo study the effect of apelin-13 on myocardial fibrosis in hypertensive rats and its underlying mechanism.MethodsForty male Sprague Dawley (SD) rats aged 8 weeks were randomly divided into AAC group (n=32) and sham operation group (n=8). After modeling the survival, the rats were randomly divided into three groups: apelin-13 group (n=8), valsartan VST group (n=8) and model group (n=8). The effect of apelin-13 on their cardiac function status and hemodynamical indexes were tested. ELISA kit was used to measure the concentration of AngⅡand Ang (1-7) in blood; Expression level of signaling pathways related protein TGF-β1, TIMP, PAI-1 and MMP-2 were detected by Western-blotting; Morphology of collagen in myocardial tissue was observed by HE and Masson staining, collagen volume fraction (CVF) in left ventricular interstitial tissue was measured by image analysis.ResultsThe cardiac function of AAC group decreased significantly compared with the sham operation group, apelin-13 group and VST group (P<0.05), and VST group was lower than apelin-13 group. Compared with the drug treatment group, the serum levels of Ang-(1-7) in ACC group decreased while the serum levels of Ang (Ⅱ) increased (P<0.05), and no statistically significant difference was found between apelin-13 group and VST group (P>0.05). The CVF in left ventricular interstitial tissue, and the TGF-β1, TIMP, PAI-1 protein expression levels were significantly higher whereas the MMP-2 expression level was significantly lower in apelin-13 group, VST group and ACC group than in sham operation group (P<0.05), and both drug treatment groups were significantly lower than AAC group with apelin-13 group lower than VST group (P<0.05).ConclusionApelin-13 can improve myocardial fibrosis in hypertensive rats by inhibiting the renin - angiotensin - aldosterone system, thereby inhibiting the expression of TGF-β1, PAI-1, TIMP-1 and improving the expression of MMP-2.
apelin-13; hypertension; abdominal aortic stenosis; myocardial fibrosis; rats
R 544.1
A
2095-5227(2015)03-0267-06
10.3969/j.issn.2095-5227.2015.03.018
時間:2014-12-10 08:55
http://www.cnki.net/kcms/detail/11.3275.R.20141210.0855.002.html
2014-09-15
遼寧省科學技術計劃項目(2012225019)
Supported by the Science and Technology Program of Liaoning Province(2012225019)
陶陽,男,在讀碩士。研究方向:心肌損傷與修復。Email: 540028653@qq.com
張志,男,博士,主任醫師,主任。Email: ningcheng631@163.com

