IBDV感染雛雞外周血液淋巴細胞chMDA5信號通路因子表達的動態變化
王成成,葛 銘,劉超男,欒亞男,李廣興,張瑞莉
(東北農業大學動物醫學學院,哈爾濱 150030)
IBDV感染雛雞外周血液淋巴細胞chMDA5信號通路因子表達的動態變化
王成成,葛 銘,劉超男,欒亞男,李廣興,張瑞莉*
(東北農業大學動物醫學學院,哈爾濱 150030)
為研究雞MDA5(chMDA5)及其信號通路因子在傳染性法氏囊病病毒(IBDV)感染雛雞體內的表達情況,將40只14日齡SPF雛雞隨機分為感染組和對照組,感染組雛雞經點眼、滴鼻方式給予IBDV液,對照組雛雞于相同日齡、相同途徑給予相同劑量PBS,于感染后第1、4、7及21天采取雛雞外周血液并分離淋巴細胞,采用實時熒光定量PCR方法檢測雛雞外周血液淋巴細胞chMDA5信號通路因子mRNA轉錄及IBDV載量的動態變化。結果表明,IBDV感染雛雞后第4天病毒載量較感染后第1天明顯升高,之后逐漸下降;雛雞淋巴細胞chMDA5及其信號通路因子表達量在感染后第4天均有明顯的上升(P<0.01或P<0.05),感染后第7—21天又出現下調。IBDV能夠激活雛雞體內chMDA5信號通路,并且IBDV復制與chMDA5信號通路因子的表達有著密切關系。
IBDV;chMDA5;雛雞;外周血液淋巴細胞
機體的天然免疫系統在抵抗病毒感染方面發揮著重要作用。病毒感染宿主細胞后,宿主細胞可以通過模式識別受體(pattern recognition receptors,PRR)識別病原相關分子模式( pathogen associated molecule patterns,PAMP),從而區別病原生物與機體自身[1]。RIG-I樣受體(RIG-I like receptors,RLRs)是一類新發現的能夠特異性識別細胞質中病毒dsRNA的模式識別受體。RLRs家族成員主要包括三個:視黃酸誘導基因-I(retinoic acia-induced gene I,RIG-I)、黑色素瘤分化相關基因5(melanoma differentiation associated gene 5,MDA5)和LGP2(laboratory of genetics and physiology 2),能夠識別細胞質中的病毒 RNA,誘導干擾素和促炎癥細胞因子的產生,在抗病毒天然免疫的建立方面起著至關重要的作用。其中,MDA5 在體內的表達十分廣泛,主要依賴位于線粒體外膜的銜接蛋白分子即IFN-β啟動子激活因子1(IFN-β-promoter stimulator 1,IPS-1)啟動特異性的信號通路,介導抗病毒效應。MDA5激活的信號轉導途徑對機體啟動抗病毒天然免疫發揮著重要作用[2]。鴨擁有完整的RIG-I受體,在A型流感病毒感染的時候被激活從而上調IFN-β表達,相比之下,雞缺乏這種RNA解旋酶。雞的胚胎成纖維細胞系DF-1細胞對RIG-I配體無免疫反應,但將鴨RIG-I基因轉染到DF-1細胞后則可以檢測這種RNA解旋酶,并誘導IFN-β啟動子表達。也就是說,雞細胞內可能缺乏RIG-I受體[3]。那么,雞細胞內是否存在MDA5受體呢?研究發現,在RIG-I缺乏的雞細胞內(包括DF-1成纖維細胞和HD-11巨噬細胞樣細胞),MDA5活化介導IFN-β的合成分泌而發揮抗禽流感病毒作用[4-5]。
雞傳染性法氏囊病(infection bursal disease,IBD)是由雙鏈RNA病毒科禽雙鏈RNA病毒屬法氏囊炎病毒(infection bursal disease virus,IBDV)引起的一種雞的急性高度接觸性免疫抑制傳染病[6]。已證實,相對較長的dsRNA(>1 kb)可被MDA5選擇性識別,而短的dsRNA(<1 kb)則依賴于RIG-I的識別[7]。IBDV基因序列全長A段為3.2~3.4 kb,B段為2.4 kb[8],那么,MDA5信號轉導通路是否參與IBDV感染過程?C.C.Lee等最新體外研究發現,DF-1細胞內MDA5能夠識別IBDV[9],但是,在復雜的雞體內,IBDV感染是否激活MDA5信號轉導通路,至今未見有報道。因此,本項研究擬從能夠特異性識別dsRNA 病毒的模式識別受體MDA5及其信號轉導入手,以雛雞為研究對象,研究雛雞感染IBDV后,其外周血液淋巴細胞chMDA5信號轉導通路中銜接蛋白分子(chIPS-1)、轉錄因子(chIRF3)及其誘導產物(chIFN-β)表達變化,從雛雞體內抗病毒模式識別及信號轉導的角度在分子水平闡明IBDV致雛雞發病機制,為防制雛雞IBD提供新的科學思路。
1 材料與方法
1.1 病毒及實驗動物
IBDV JIC7株,TCID50為105.5·0.1 mL-1,購自中國獸醫藥品監察所。
SPF雛雞40只,購自中國農業科學院哈爾濱獸醫研究所SPF實驗動物中心。
1.2 主要試劑和儀器
SYBR Green Realtime PCR Master Mix購自TOYOBO公司;Trizol Reagent購自Invitrogen公司;M-MLV反轉錄酶、RNA酶抑制劑均購自大連寶生物工程有限公司;雞淋巴細胞分離液購自天津灝洋生物制品科技有限責任公司;ABI 7500熒光定量PCR儀,Life Technologies產品。
1.3 實驗動物分組及處理
將40只SPF雛雞隨機分為感染組和對照組,每組20只。其中,感染組雛雞于14日齡經點眼、滴鼻方式給予IBDV液,每只0.6 mL,對照組雛雞于相同日齡、相同途徑給予相同劑量PBS。兩組雛雞分別嚴格隔離飼養。在感染IBDV后第1、4、7、21天,每組隨機抽取5只雛雞,心臟采血,經抗凝處理后按照淋巴細胞分層液說明書分離淋巴細胞。
1.4 雛雞外周血淋巴細胞總RNA的提取與反轉錄
參照Trizol試劑盒說明書進行雛雞外周血淋巴細胞總RNA的提取。之后參照反轉錄試劑盒說明書,將提取的總RNA反轉錄成cDNA,置于-20 ℃備用。
1.5 引物的設計與合成
根據GenBank上公布的chMDA5受體及其信號通路因子序列,在基因保守區內設計特異性的引物,用于實時熒光定量PCR反應檢測chMDA5受體及其信號通路因子mRNA的轉錄情況。同時,根據GenBank上公布的chβ-actin基因序列設計特異性引物,作為參考基因,引物由博仕生物有限公司合成。引物序列見表1。
表1 chMDA5受體及其信號通路因子和參考基因目的片段擴增用引物
Table 1 The primers used to amplify the gene fragment of chMDA5 and its signaling pathway factors

基因Nameofprimers引物序列(5'-3')Sequences(5'-3')大小/bpFragmentssizeschMDA5GGAAGGCCTAGACATCAAAGAGTGCATCTTCACGTTCAACAGCTCCTG135chIPS-1TGCAGGGAGGCCATACACCAGTGTCCACCTCCCAAGGTGACCCGTG124chIRF3CTCTCTGACTCTTTCAACCTCTTCGTGCTGCCTGCTCCTGTGG260chIFN-βGCCCACACACTCCAAAACACTGTTGATGCTGAGGTGAGCGTTG151chβ-actinATTGCTGCGCTCGTTGTTCTTTTGCTCTGGGCTTCA173
1.6 雛雞外周血液淋巴細胞chMDA5及其信號通路因子(chIPS-1、chIRF3、chIFN-β)mRNA的檢測
實時熒光定量反應采用ABI Prism 7500實時熒光定量PCR儀進行檢測,PCR反應程序:95 ℃預變性1 min,95 ℃變性15 s,60 ℃退火40 s,共40個循環,退火延伸時檢測熒光信號。PCR反應體系:Mix 10 μL、PCR Forward Primer(10 μmol·L-1)0.6 μL、PCR Reverse Primer(10 μmol·L-1)0.6 μL、cDNA 2 μL、ROX 0.04 μL、H2O補全20 μL。對PCR結果采用2-ΔΔCt法進行分析,試驗中由PCR儀設定統一的熒光閾值,PCR擴增信號達到閾值后,儀器將計算出此反應所需的循環數為Ct值。以chβ-actin為參考基因,各試驗處理組中相對于對照組的ΔΔCt值根據以下公式計算:ΔΔCt值=感染組(目的基因Ct值-參考基因Ct值)-對照組(目的基因Ct值-參考基因Ct值)。利用公式計算出mRNA相對轉錄量為2-ΔΔCt。
1.7 雛雞外周血液淋巴細胞IBDV載量的檢測
1.7.1 IBDV-VP2實時熒光定量PCR標準曲線的繪制 將重組質粒T-IBDV-VP2(本實驗室制備并保存)進行10倍倍比稀釋:10-1、10-2、10-3、10-4、10-5、10-6、10-7,作為標準品模板,使用前測定原始質粒濃度并換算成質粒的拷貝數。用IBDV實時熒光定量PCR引物(上游引物為CAAACCTGCAAGATCAAACC,下游引物為AAGCCAGGGAAAAAGACAA,預期擴增片段長度為184 bp)進行熒光定量PCR擴增,并繪制標準曲線。PCR程序及體系同1.6。以不同濃度標準品的對數值為橫坐標,以PCR反應中熒光信號達到閾值所用的Ct值為縱坐標繪制T-IBDV-VP2標準曲線。
1.7.2 IBDV載量動態變化檢測 以1.5制備的雛雞外周血液淋巴細胞cDNA為模板,以IBDV 實時熒光定量PCR擴增引物進行實時熒光定量PCR反應,反應條件與反應體系同1.6。反應結束后,記錄各試驗樣品的Ct值,將其代入T-IBDV-VP2標準質粒繪制的標準曲線建立的回歸方程,可以得出相應試驗組病毒的拷貝數。
1.8 數據統計與分析
采用Graph PadPrism軟件進行數據處理,經方差法分析組間差異性。
2 結 果
2.1 雛雞外周血液淋巴細胞IBDV載量的動態變化
以不同濃度標準品的對數值為橫坐標,以PCR反應中熒光信號達到閾值所用的Ct值為縱坐標繪制T-IBDV-VP2標準曲線,標準品的對數值與Ct值之間成線性關系,反應的相關系數R2=0.999 286,T-IBDV-VP2質粒擴增效率為90.1%,獲得回歸方程:Y=-3.585 967X+30.30。將各感染組測得的Ct值代入方程,可以得出相應感染組病毒拷貝數,根據各拷貝數,繪制病毒含量的動態變化圖,如圖1所示,雛雞感染IBDV后第4天,其外周血液淋巴細胞IBDV載量與感染后第1天相比迅速升高并且達到峰值,之后逐漸下降,感染后第21天IBDV載量與感染后第1天基本持平。
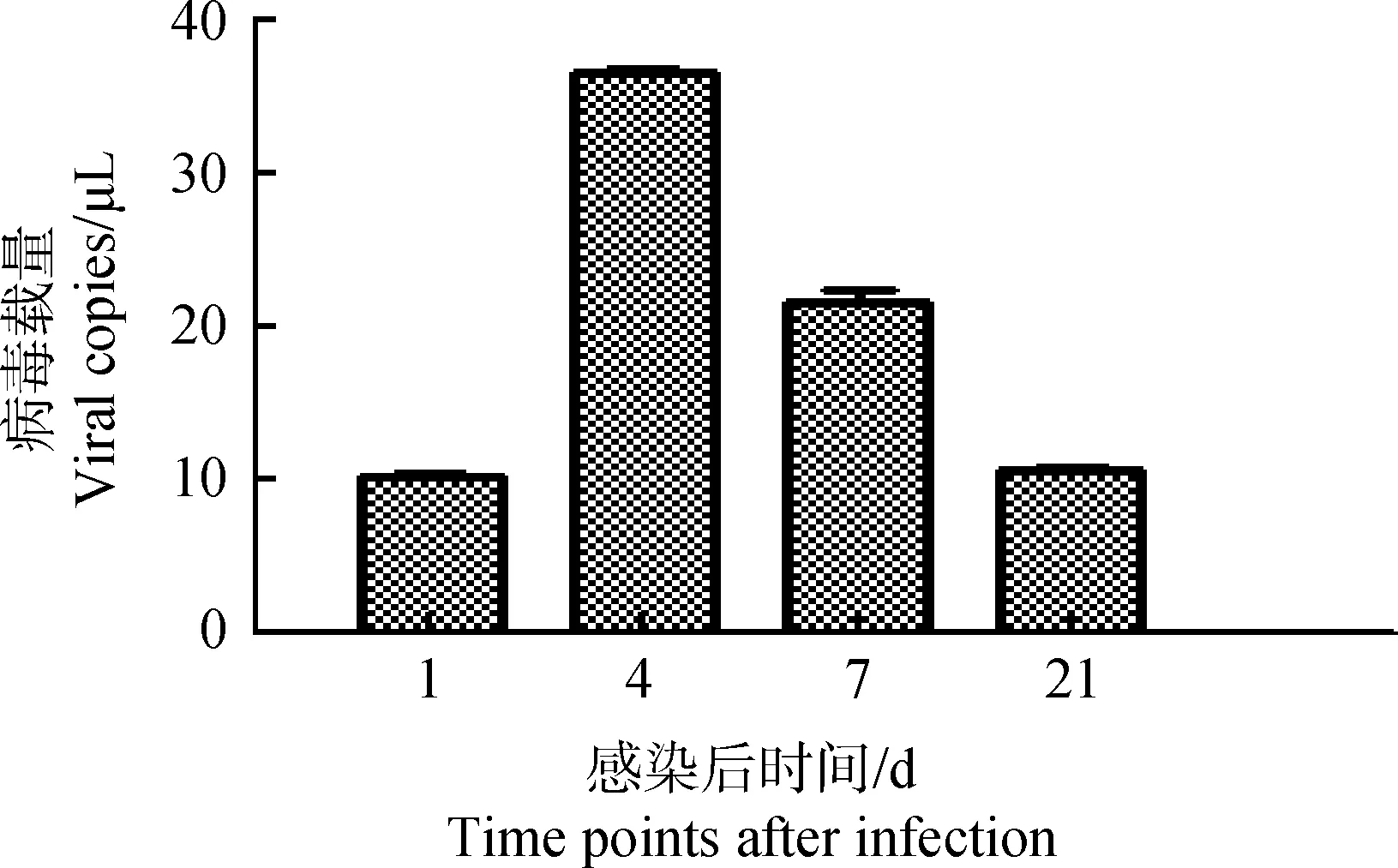
圖1 雛雞外周血液淋巴細胞IBDV載量動態變化Fig.1 Dynamics changes of the viral load in chick peripheral blood lymphocytes
2.2 雛雞外周血液淋巴細胞chMDA5、chIPS-1、chIRF3、chIFN-βmRNA表達的動態變化
雛雞感染IBDV后,其外周血液淋巴細胞chMDA5 mRNA的表達量在感染后第1天略低于對照組,但到感染后第4天,chMDA5 mRNA表達量極顯著升高且達到峰值(P<0.01),之后顯著降低,在感染后第7天其表達明顯低于對照雛雞(P<0.05),但在感染后第21天chMDA5 mRNA表達量又升高(P<0.05),如圖2。
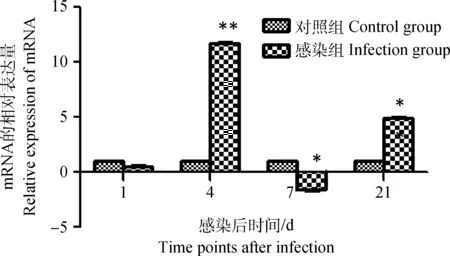
**表示感染組細胞mRNA相對表達量與相應時間點對照細胞比較差異極顯著(P<0.01);*表示感染組細胞mRNA相對表達量與相應時間點對照細胞比較差異顯著(P<0.05),無標記表示差異不顯著(P>0.05)。以下各圖同The letter “**” shows the relative expression of mRNA significantly different at 0.01 level compared with control group,the letter “*” shows the relative expression of mRNA significantly different at 0.05 level compared with control group and differ quietly(with unlabeled,P>0.05).The following is same as here圖2 雛雞外周血液淋巴細胞chMDA5 mRNA轉錄表達的動態變化Fig.2 Dynamic changes of the chMDA5 mRNA in chick peripheral blood lymphocytes
雛雞感染IBDV后第 1天,其外周血液淋巴細胞chIPS-1 mRNA表達量明顯低于對照細胞(P<0.05),之后表達量呈上升趨勢,至感染后第4天達到峰值(P<0.01),在第7天表達量明顯下調并且低于對照組(P<0.05),但在感染后第21天,chIPS-1 mRNA表達量又出現小幅上升(P<0.05),如圖3。
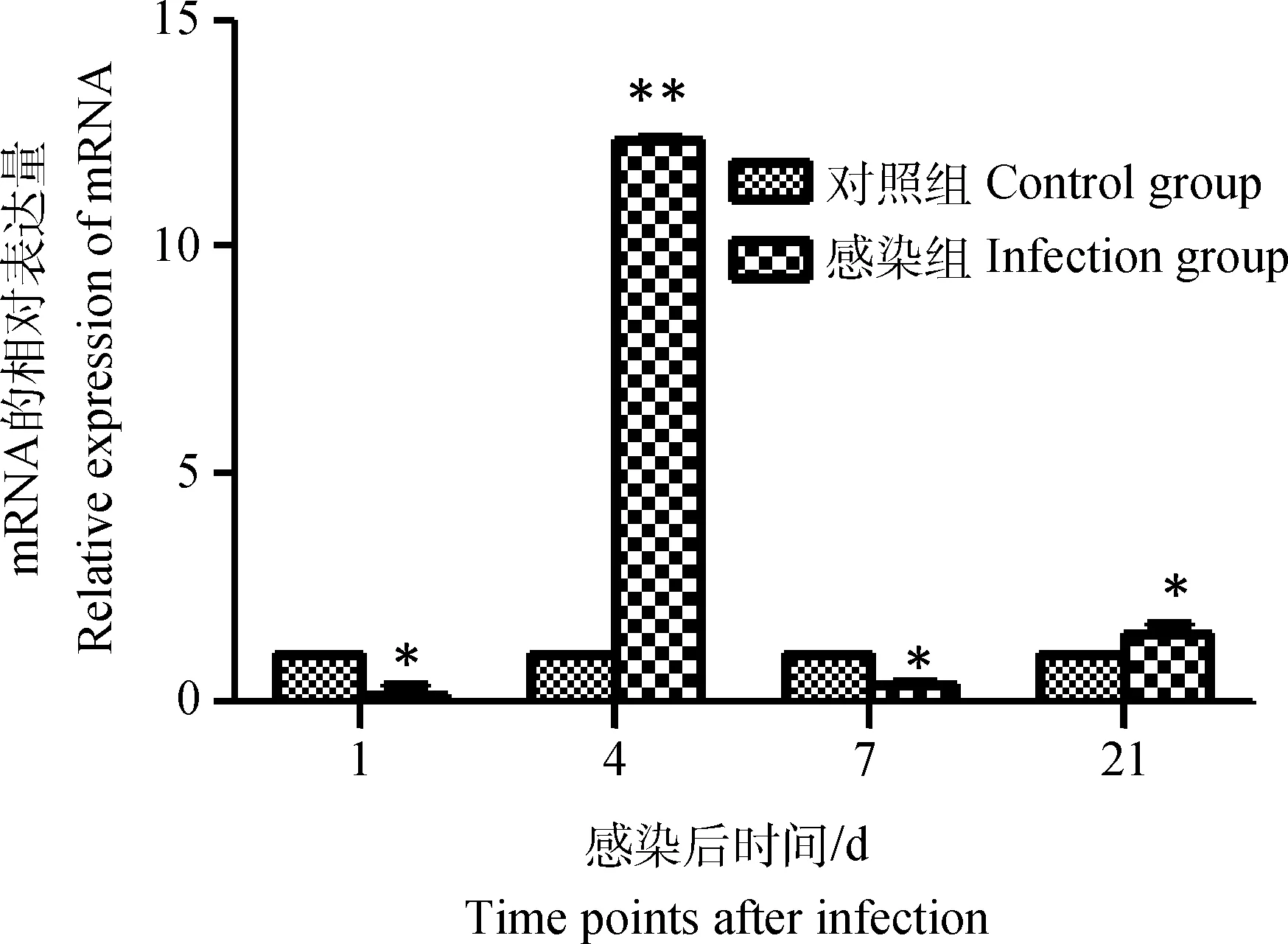
圖3 雛雞外周血液淋巴細胞chIPS-1 mRNA表達的動態變化Fig.3 Dynamic changes of the chIPS-1 mRNA in chick peripheral blood lymphocytes
雛雞感染IBDV后第1天,其外周血液淋巴細胞chIRF3表達量明顯下調(P<0.01),但在感染后第4天又出現明顯的上升趨勢并且表達量達到峰值(P<0.01),之后下調,但在感染后第21天表達量再一次升高,并且與感染后第4天chIRF3表達量持平(P<0.01),如圖4。
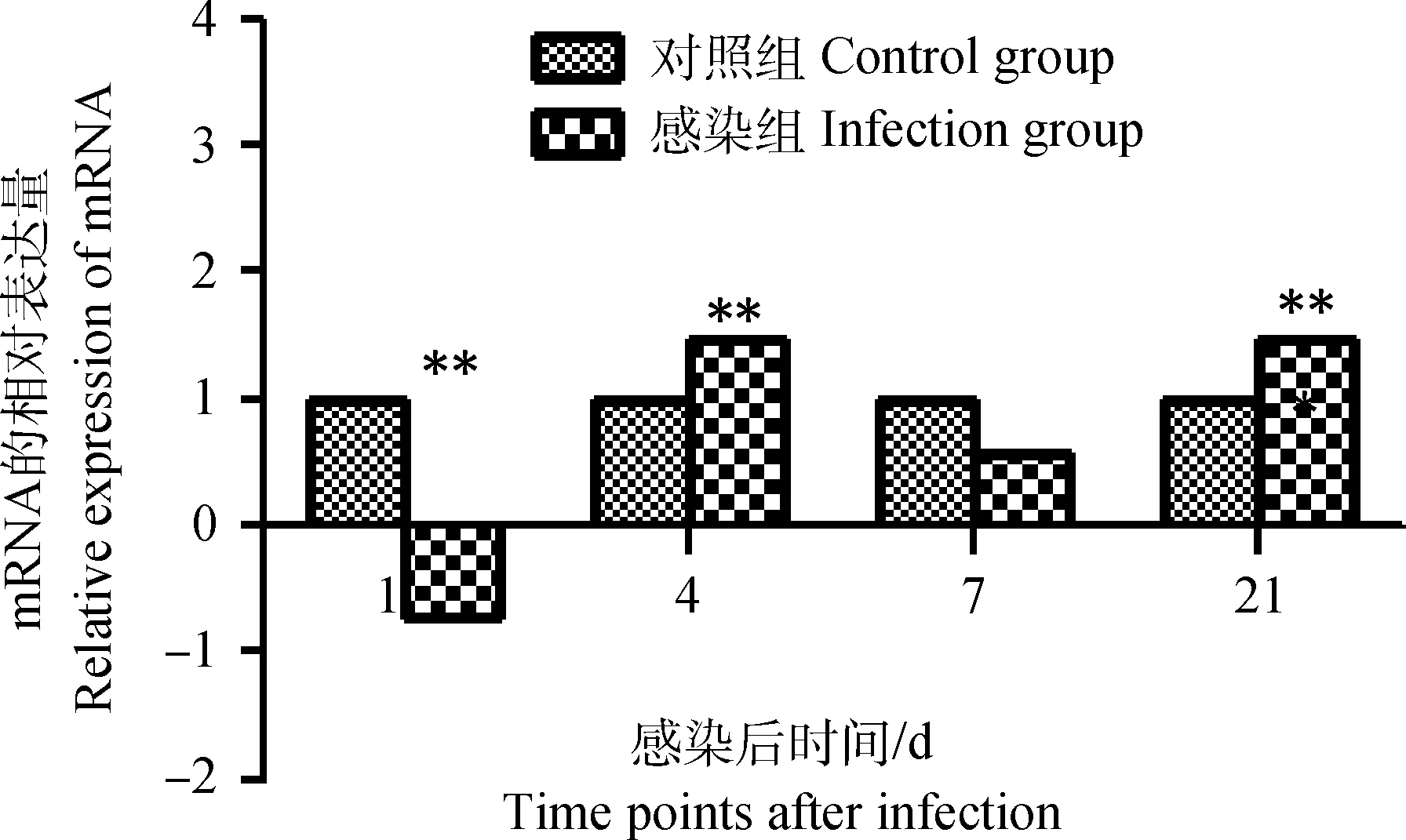
圖4 雛雞外周血液淋巴細胞chIRF3 mRNA表達的動態變化Fig.4 Dynamic changes of the chIRF3 mRNA in chick peripheral blood lymphocytes
雛雞感染IBDV后第1天,其外周血液淋巴細胞chIFN-β mRNA表達量與對照組相比小幅升高(P<0.05),至感染后第4天達到峰值(P<0.01),在感染后第7天又顯著下調出現負值(P<0.05),在第21天其表達量又升高且明顯高于對照組(P<0.01),如圖5。
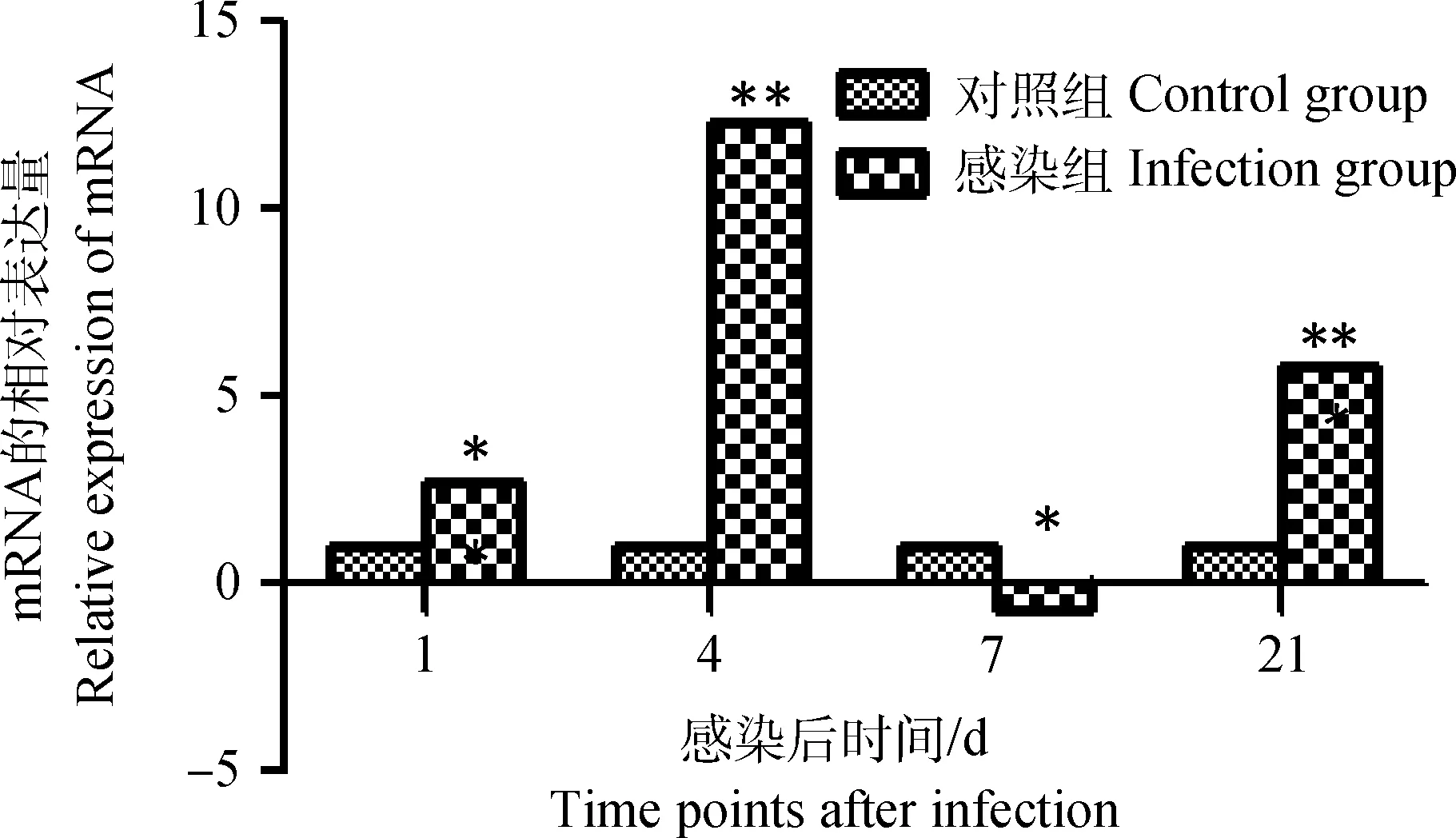
圖5 雛雞外周血液淋巴細胞chIFN-β mRNA表達的動態變化Fig.5 Dynamic changes of the chIFN-β mRNA in chick peripheral blood lymphocytes
3 討 論
IBDV被動物機體固有免疫受體識別后,激活機體抗病毒免疫,主要是Ⅰ型干擾素及炎性細胞因子的活化。當dsRNA病毒感染機體后,MDA5識別病毒核酸,并通過蛋白-蛋白接觸的方式與其下游銜接蛋白分子IPS-1結合,進而活化IκB及IκB激酶,這兩類激酶活化轉錄因子NF-κB及IFR(IFN regulatory factor)并形成轉錄復合體,結合到IFN-β的啟動子區域,促進IFN-β基因轉錄[10]。
本試驗從mRNA水平檢測雛雞感染IBDV后,其外周血液淋巴細胞chMDA5及其信號轉導通路中銜接蛋白分子(chIPS-1)、轉錄因子(chIRF3)及誘導產物(chIFN-β)轉錄的動態變化。結果發現,雛雞感染IBDV后,其外周血液淋巴細胞chMDA5和chIFN-β轉錄量呈現先小幅下降然后顯著上升,之后兩者的表達量在感染后第7天又出現迅速下調。同時,本研究還發現,chMDA5 mRNA轉錄量的變化趨勢與IBDV載量變化趨勢相同,即IBDV病毒粒子拷貝數增加的同時chMDA5的轉錄量也相應增加,待chMDA5轉錄量有所下降時,IBDV的復制也受到抑制,表明IBDV在雛雞外周血液淋巴細胞內的復制、增殖與chMDA5的表達存在著一定的關系。研究發現,MDA5的過量表達可增強IFN-β啟動子活性[11],而流行性腮腺炎病毒和仙臺病毒等副黏病毒的Ⅴ蛋白可通過其高度保守的C末端與MDA5結合,抑制MDA5介導的IFN-β啟動子的轉錄活化,進而對整個信號通路產生抑制作用[12]。我們懷疑IBDV某部分結構蛋白也有此作用。
chMDA5信號通路因子chIPS-1和chIRF3基因轉錄量變化趨勢與chMDA5相似,在感染IBDV后第1天兩者轉錄量均低于對照組,其中chIRF3表達量顯著低于對照組,感染后第4天chIPS-1和chIRF3轉錄量均達到峰值,之后迅速下降,在第21天又出現小幅上調。原因在于MDA5通過CARD-CARD相互作用募集位于線粒體的配體蛋白IFN-β啟動子刺激子(IPS-1)產生相應干擾素的同時與Fas相關的死亡域蛋白(FADD)作用[13],活化IRF3,進而促進各種細胞因子表達。IPS-1缺陷型小鼠暴露于RNA病毒,不能激活IRF3[14]。因此,我們了解到IPS-1是MDA5信號途徑中心配體蛋白,IPS-1與MDA5下游多個信號分子相互作用對IRF3的激活和起始抗病毒反應起著核心作用。
近年來,對MDA5等非依賴型固有免疫受體的關注度日益提高,本試驗通過實時熒光定量PCR的方法檢測IBDV感染雛雞MDA5信號通路因子的動態變化,發現chMDA5及其信號通路因子在雛雞感染IBDV后的不同天數其基因轉錄量變化驚人的相似,這與MDA5信號通路相符。然而,IBDV感染雞體第1天,MDA5信號通路中IRF3表達量的下降趨勢比IPS-1更低,究其原因需要更深入的研究。了解IBDV感染對MDA5及其下游細胞因子的影響可為雞傳染性法氏囊病的預防和治療奠定基礎。
4 結 論
IBDV能夠激活雛雞體內chMDA5信號通路,并且IBDV復制與chMDA5信號通路因子的表達密切相關。
[1] AKIRA S,UEMATSU S,TAKEUCHI O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[2] KATO H,TAKEUCHI O,SATO S,et al.Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses[J].Nature,2006,441(7089):101-105.
[3] BARBER M R W,ALDRIDGE J R,WEBSTER R G,et al.Association of RIG-I with innate immunity of ducks to influenza[J].ProcNatlAcadSciUSA,2010,107(13):5913-5918.
[4] KARPALA A J,STEWART C,MCKAY J, et al.Characterization of chicken MDA5 activity:regulation of IFN-β in the absence of RIG-I functionality[J].JImmunol,2011,86(9):5397-5405.
[5] LINIGER M,SUMMERFIELD A,ZIMMER G,et al.Chicken cells sense influenza A virus infection through MDA5 and CARDIF signaling involving LGP2[J].JVirol,2012,86(2):705-717.
[6] CALNEK B W.禽病學[M].高 福,劉文軍,譯.北京:北京農業大學出社,1991:554-556. CALNEK B W.Poultry science[M].GAO F,LIU W J,translation.Beijing:Beijing Agricultural University Press,1991:554-556.(in Chinese)
[7] KATO H,TAKEUCHI O,MIKAMO-SATOH E,et al.Length-dependent recognition of double-stranded ribonucleic acids by retinoic acid-inducible gene-I and melanoma differentiation-associated gene 5[J].JExpMed,2008,205(7):1601-1610.
[8] PETKOV D,LINNEMANN E,KAPCZYNSKI D R,et al.Full-length sequence analysis of four IBDV strains with different pathogenicities[J].VirusGenes,2007,34(3):315-326.
[9] LEE C C,WU C C,LIN T L.Chicken melanoma differentiation-associated gene 5(MDA5) recognizes infectious bursal disease virus infection and triggers MDA5-related innate immunity[J].ArchVirol,2014,159(7):1671-1686.
[10] HEMMI H,TAKEUCHI O,SATO S,et al.The roles of two IκB kinase-related kinases in lipopolysaccharide and double stranded RNA signaling and viral infection[J].JExpMed,2004,199(12):1641-1650.
[11] ANDREJEVA J,CHILDS K S,YOUNG D F,et al.The V proteins of paramyxoviruses bind the IFN-inducible RNA helicase,mda-5,and inhibit its activation of the IFN-β prompter[J].ProcNatlAcadSciUSA,2004,101(49):17264-17269.
[12] RAMACHANDRAN A,HORVATH C M.Dissociation of paramyxovirus interferon evasion activities:universal and virus-specific requirements for conserved V protein amino acids in MDA5 interference[J].JVirol,2010,84(21):11152-11163.
[13] 謝廣成,段招軍.抗病毒感染固有免疫應答的信號轉導[J].病毒學報,2012,28(3):303-310. XIE G C,DUAN Z J.Signal transduction of innate immunity to virus infection[J].ChineseJournalofVirology,2012,28(3):303-310.(in Chinese)
[14] SUN Q,SUN L,LIU H H,et al.The specific and essential role of MAVS in antiviral innate immune responses[J].Immunity,2006,24(5):633-642.
(編輯 白永平)
Dynamic Changing in the Expression of chMDA5 Signal Pathway Factors in Peripheral Blood Lymphocytes of Chicken Infected with IBDV
WANG Cheng-cheng,GE Ming,LIU Chao-nan,LUAN Ya-nan,LI Guang-xing,ZHANG Rui-li*
(CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin150030,China)
The present study investigated the expression of chick melanoma differentiation associated gene 5(chMDA5) and its signaling pathway factors in chickens infected with infectious bursal disease virus(IBDV).Fourty 14-day-old specific pathogen free(SPF) chickens were randomly allocated into 2 groups which were infected and control groups.The infected group of chickens was inoculated with IBDV by intraocularly and intranasally.Meanwhile,the control group chickens were administered with PBS by intraocularly and intranasally.Peripheral blood lymphocytes were isolated at the 1st,4th,7th and 21st day after infection.Real-time fluorescence quantitative PCR method was used to detect the mRNA expression levels of chMDA5 signal pathway factors and the IBDV loads in peripheral blood lymphocytes of chickens.The results showed that the viral loads of IBDV-infected chickens in peripheral blood lymphocytes on the 4th day were significantly higher than that in the 1st day,and then gradually declined.The expression of chMDA5 and its downstream targets genes were significantly increased(P<0.01orP<0.05) at the 4th day after infection,then reduced at 7-21 day than that in the control group.The results indicated that IBDV could activate the chMDA5 signaling pathways in chickens.In addition,the replication of IBDV had closely relationship with the expression of chMDA5 signaling pathways factors.
IBDV;chMDA5;chickens;peripheral blood lymphocyte
10.11843/j.issn.0366-6964.2015.05.020
2014-09-12
國家自然科學基金資助項目(31272533)
王成成(1988-),女,遼寧遼陽人,碩士生,主要從事預防獸醫學研究
*通信作者:張瑞莉,E-mail:zhangruil@neau.edu.cn
S852.659.4
A
0366-6964(2015)05-0830-06

