某院2013—2014年藥物不良反應報告分析
程軍平,沈夕坤,胡 芳,金 炎,張夏蘭
(蘇州市中醫醫院藥學部,江蘇蘇州 215009)
藥品不良反應(ADR)是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應,本報告對我院2013—2014年上報的ADR進行總結分析。
1 資料與方法
1.1 一般資料 收集我院2013年1月—2014年12月各科室發生并且呈報的ADR報告表,根據報告表填寫的內容進行篩選,得到符合要求的ADR報告共計215份。
1.2 方法 回顧性分析每位ADR患者的性別、年齡、轉歸結果、給藥途徑、藥品種類、藥品劑型、上報部門、患者過敏史等項目,并對其進行統計分析,對報表存在的問題進行相關分析。
2 結果
2.1 一般情況 215例ADR報告表,ADR屬性中一般的ADR 209 例(97.21%),新的一般的 ADR 5 例(2.32%),嚴重的ADR 1例(0.47%)。結果見表1。
2.2 報告部門統計 215例ADR報告表,報告部門最多的是藥劑科187例(86.98%),其次為骨傷科18例(8.37%),上報職業最多為藥師,比例為86.98%。結果見表2。
2.3 ADR患者的性別與年齡分布 215例ADR患者中,男性患者59例(32.52%),女性患者 156例(67.48%);患者年齡5~93歲,在發生ADR患者中,20~39歲者所占比例最大,為35.81%。結果見表3。
2.4 ADR患者體重分布 215例ADR患者中,體重范圍為41~60 kg的患者所占比例為65.55%。結果見表4。
2.5 ADR患者過敏史統計 215例ADR患者中有28例患者有過敏史,占整個ADR患者比例為13.02%,其中青霉素過敏患者所占比例最大,為32.14%。結果見表5。

表1 我院2013—2014年藥品不良反應報告表一般情況
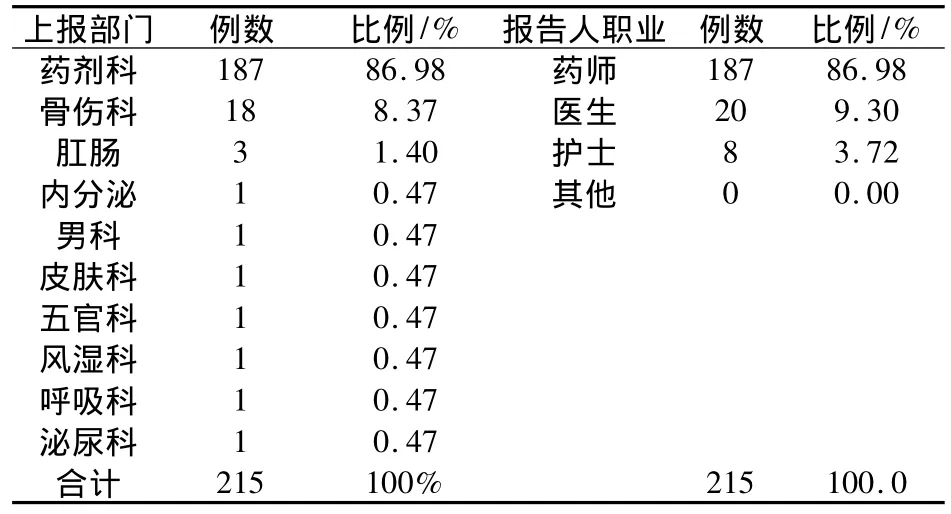
表2 我院2013—2014年藥品不良反應報告部門和報告人職業統計
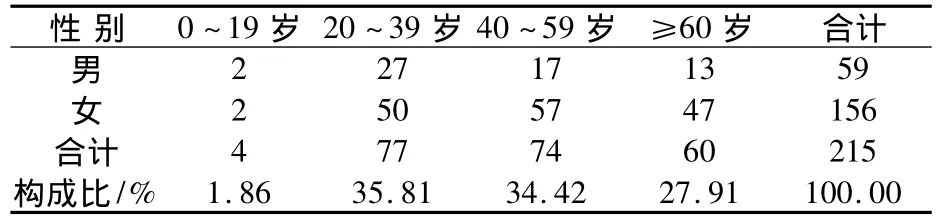
表3 我院2013—2014年藥品不良反應報告年齡組病例數及構成
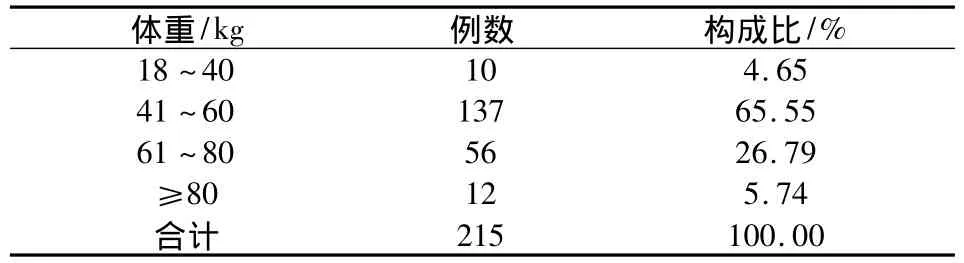
表4 ADR患者體重與構成
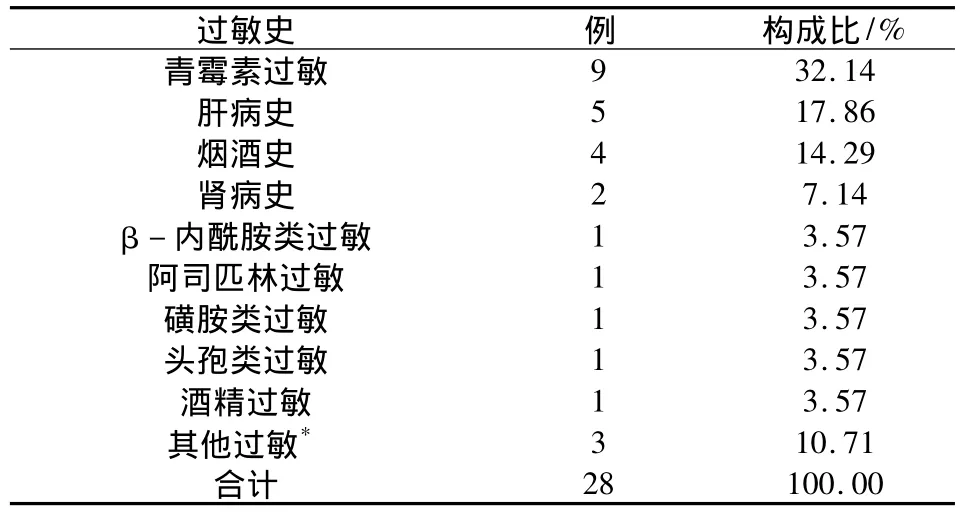
表5 ADR患者過敏史的統計
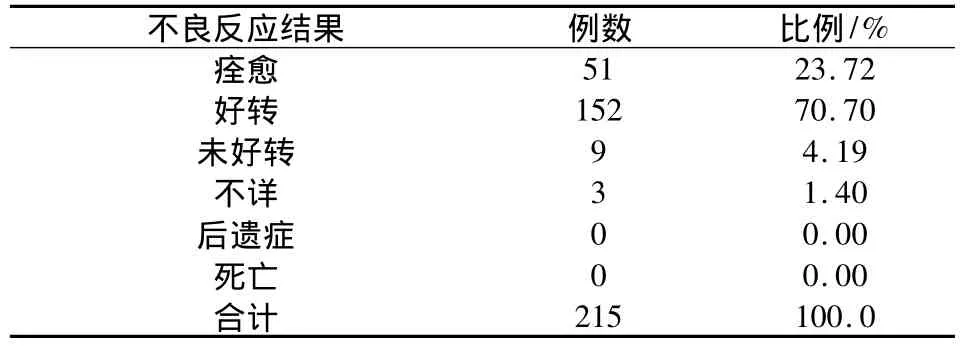
表6 藥品不良反應結果的例數和比例
2.6 合并用藥與ADR 215例ADR報告中,使用單一藥品的有55例,比例為25.6%;合并用藥的有160例,比例為74.4%。
2.7 給藥途徑與ADR 根據國家食品藥品監督管理局藥品不良反應監測中心制定的藥品不良反應用藥途徑共32種。本次報告只涉及了靜脈滴注、口服用藥、陰道用藥、局部外用及肌內注射五種途徑,結果見表7。
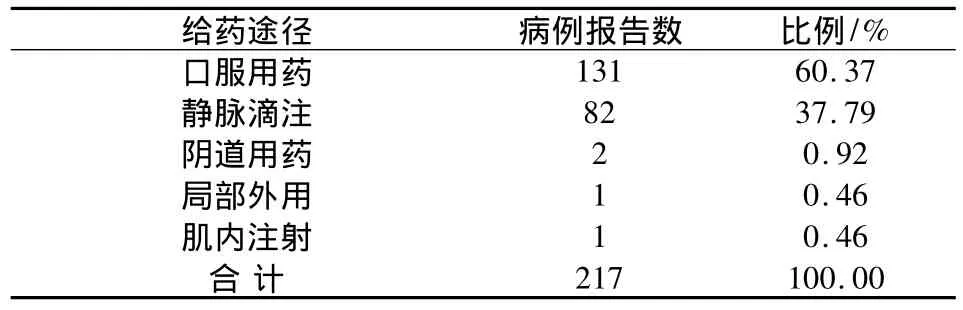
表7 藥品不良反應按給藥途徑統計
2.8 藥品劑型與ADR 藥品不良反應按照藥品劑型統計,片劑和注射劑所占比例最大,合計為58.52%,其次為膠囊劑和粉針劑,比例分別為18.89%和11.52%。結果見表8。

表8 藥品不良反應按藥品劑型統計
2.9 涉及藥物品種與ADR 參照《中華人民共和國藥典臨床用藥須知》(2010)[1]的藥品分類方法,將藥品進行分類統計。215例報告中,引起ADR的藥物品種主要集中在中成藥與抗菌藥這兩類,構成比分別為37.79%和31.80%,抗菌藥物中出現次數較多的主要為頭孢菌素類,結果見表9。
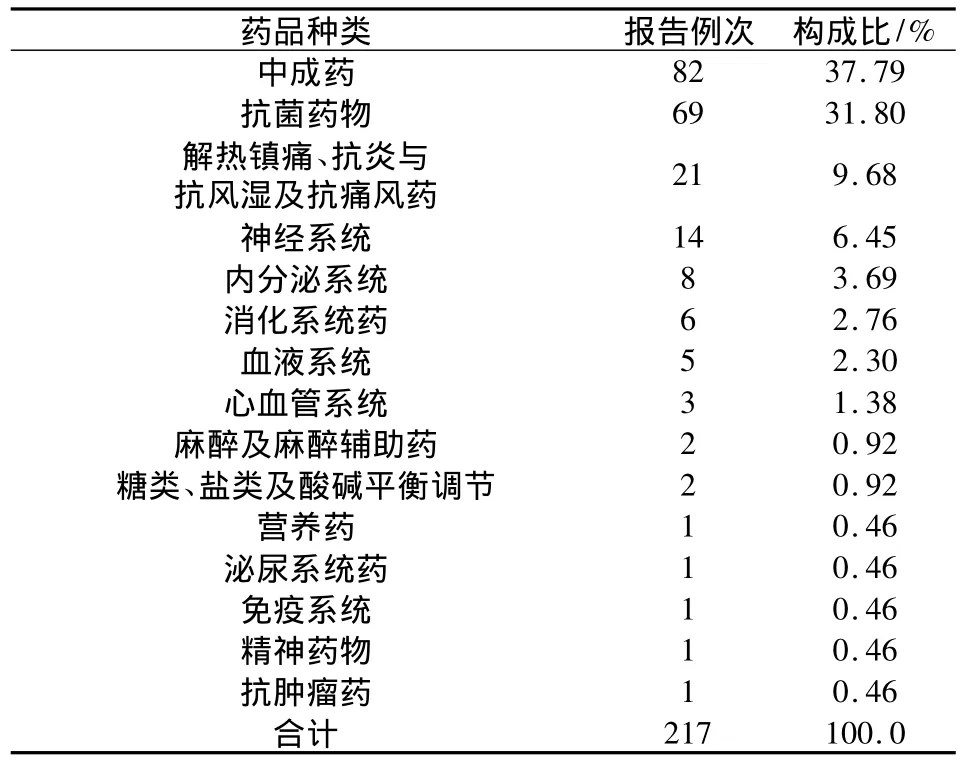
表9 引起ADR的藥物種類及其構成比
2.10 發生ADR的前5位藥品 發生ADR的前5位藥品大部分是抗菌藥物和中藥注射劑,共引起37例藥品不良反應,占215例ADR的17.2%,結果見表10。
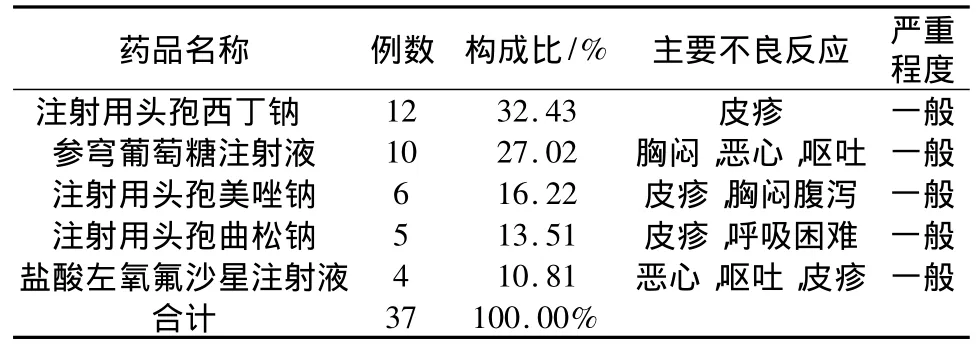
表10 引發ADR的前5位藥品
2.11 累及系統-器官與ADR 累及系統—器官與ADR的統計,結果見表11。
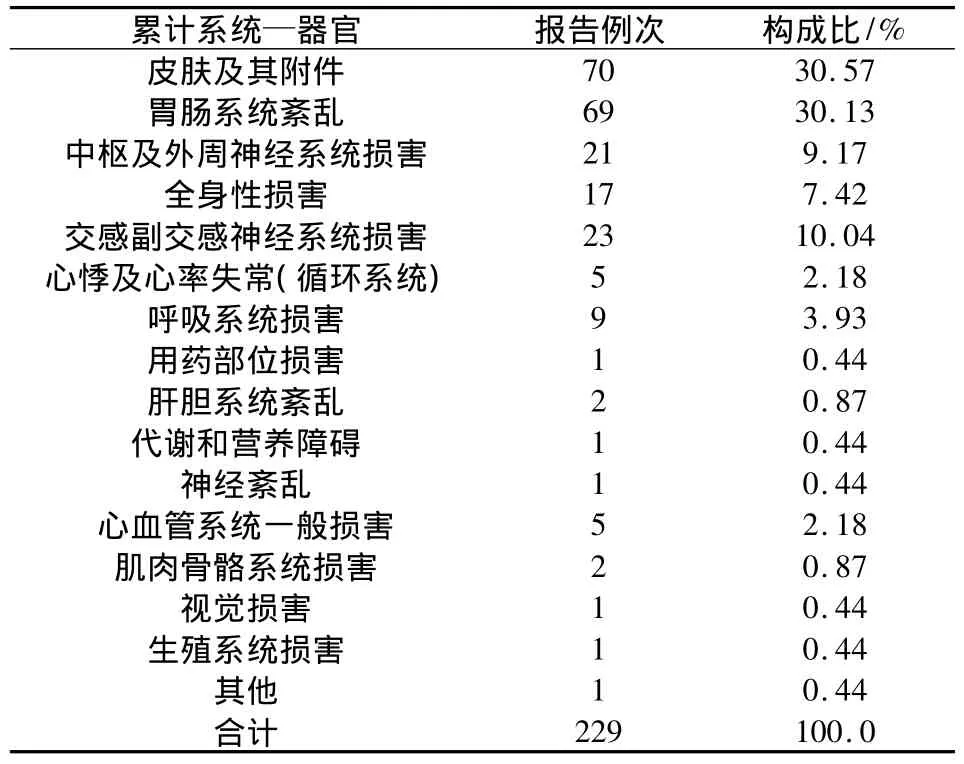
表11 累計系統—器官分類統計
3 結果分析與評價
3.1 ADR與年齡、性別關系的評價 215例ADR報告中,其中20~39歲組所占比例最高為35.81%。由表3可知,發生ADR男女比例為1∶2.64。大于60歲的老年患者占不良反應人群的27.91%,也同樣是好發年齡組[2]。老年患者隨著年齡的增大,肝、腎功能相繼減退,腎小管分泌能力及腎小球濾過率降低,腎血流量明顯減少從而影響體內藥物的排泄;肝血流量相應降低、肝藥酶活性減弱從而導致解毒能力下降[3]。
3.2 給藥途徑評價 215例ADR報告中發生率最高的給藥途徑為口服和注射[4]給藥。我院是具有中醫藥特色的醫院,中成藥的使用率較高,口服中成藥對胃的刺激性較大,易引起皮疹或胃腸道等不適癥狀。
3.3 合并用藥的評價 215例ADR中合并用藥共160例,多于單一用藥,我院目前中成藥和西藥、中藥飲片聯用情況是比較普遍的,聯合用藥有其獨特的優勢,是用藥的一大形式,聯合用藥交互作用影響到原有藥物不良反應導致意外ADR[5]。我們可以做的就是對其合理性進行嚴格考證,從而降低或保證用藥的安全[6-7]。
3.4 藥物品種評價 由表9和表10可知,中成藥和抗菌藥物占據了引起ADR反應藥物品種的主要地位,分別為37.79%和31.80%,其中占據抗菌藥物的主體為頭孢菌素類,共31例,占到了抗菌藥物的45%。發生ADR最多的前2種藥物是注射用頭孢西丁鈉和參芎葡萄糖注射液。據文獻報道這可能與其化學結構中的β-內酰胺母核易降解誘發變態反應相關,還可能與頭孢菌素—蛋白質結合物及生產過程中的蛋白質雜質有關[8]。本次數據中出現的中藥注射劑的ADR主要集中在參芎葡萄糖注射液和丹參川芎嗪注射液[9-10],分別為10例和1例,鑒于這個ADR頻率出現較高的中藥注射劑,我院已經從各環節入手分析其發生頻次較高的原因,由于此品種集中出現在同一個病區,目前已聯系廠家和我院病區一起調查分析其發生ADR的原因。對于口服中成藥[11]而言,主要是由于中草藥復方制劑的提取工藝較為復雜就有可能導致ADR的發生。中成藥品種出現ADR的情況比較散在,出現次數較分散,沒有集中出現在某一個藥品上的情況,我院ADR報告里面中成藥例數是最多的,但是中成藥ADR比例并不是最高的。
3.5 累及器官系統評價 我院不良反應累及系統—器官分類結果顯示皮膚及其附件損害最多。這可能因為這方面的損害臨床表現比較直觀,容易判斷,故上報例數較多。在實際工作中,我們更要關注那些不是很直觀而且容易被掩蓋的不良反應,如心血管、血液系統等損害,如能及時發現,及時處理,可以將傷害減至最輕程度。
3.6 上報ADR人員身份評價 近年參與不良反應上報的人員由藥師占主體人群逐漸演變為醫生、藥師、護士共同協作,隨著我院宣傳及普及ADR知識力度加強,醫護人員上報意識有所增強,重視程度有了很大的提高,ADR上報數量明顯增加。醫務人員報告的ADR品種主要集中在神經系統用藥,抗菌藥物和中成藥三大類,給藥途徑中主要注射劑占了82%,累及器官主要集中在中樞及外周神經系統損害,交感副交感神經系統損害,呼吸系統損害,胃腸系統紊亂這幾個方面。
國家實施ADR上報和監測制度,是為了提高醫務人員對ADR的正確認識,促進合理用藥。醫務人員加強ADR的監測保障了人民群眾的用藥安全。藥師、醫師、護士是ADR監測的主力軍,我們將利用藥事管理委員會、內部刊物《藥訊》等多種途徑在院內大力宣傳ADR知識。
[1] 國家藥典委員會.中華人民共和國藥典臨床用藥須知[S].北京:中國醫藥科技出版社,2011:1-28.
[2] 陳崇澤.12例左氧氟沙星致心血管不良反應分析[J].藥物評價研究,2013,36(6):485 -487.
[3] 張 穎,方維軍.藥品不良反應統計分析與臨床合理用藥探討[J].湖北民族學院學報(醫學版),2012,16(9):88 -90.
[4] 葛 躍,楊 波,吳惠明,等.徐州市2011年抗感染類藥物不良反應分析[J].臨床合用藥,2013,1(6):34 -36.
[5] 李繼友,孫 駿,周 靜,等.熱毒寧注射液相關風險因素分析[J].中國藥物警戒,2013,10(10):627 -634.
[6] 姚 冰,彭曉燕.484例藥品不良反應報告分析[J].西北藥學雜志,2012,27(3):268 -270.
[7] 仉媛媛,叢 麗.瑞格列奈片與其他藥物的相互作用及不良反應研究[J].藥品評價,2013,10(23):29 -32.
[8] 王希斌,黃振光,劉滔滔,等.我院776例藥品不良反應報告分析[J].中國藥房,2013,24(30):2851.
[9] 周麗娟,邊 潮.我院218例中藥注射劑不良反應報告分析[J].中國藥房,2013,24(43):4098 -4100.
[10]張 瑩.消癌平注射液致嚴重不良反應1例[J].藥物評價研究,2013,36(6):488.
[11]林令華,魏 玲.197例藥品不良反應病例的報告分析[J].抗感染藥學,2013,10(4):307 -310.

