支氣管哮喘患者血清IL-13、TGF-β1、VEGF表達變化及臨床意義
康建軍
陜西省榆林市第一醫院呼吸內科,陜西榆林 719000
支氣管哮喘(bronchial asthma)是嚴重危害人類 健康的一種氣道慢性炎癥疾病,其最重要的病理改變為氣道炎癥與氣道重塑,細胞因子在支氣管哮喘的發病機制中起著重要作用[1-2]。 目前,研究表明白介素13(IL-13)、轉化生長因子β1(TGF-β1)、血管內皮生長因子(VEGF)在支氣管哮喘細胞因子網絡失衡中可能起著重要的作用[3-4]。本研究旨在分析IL-13、TGF-β1、VEGF 在支氣管哮喘患者血清中的動態變化及與肺功能的關系,從而探討支氣管哮喘發生的可能機制,為臨床醫師診斷和治療支氣管哮喘提供新的理論依據。
1 資料與方法
1.1 一般資料
選取2012 年8 月~2014 年2 月在榆林市第一醫院(以下簡稱“我院”)呼吸內科住院的支氣管哮喘患者88 例,按照病史情況及臨床表現將患者分為兩組:哮喘急性發作期組和臨床緩解期組,每組各44 例。并選取同期在我院體檢健康中心體檢的健康者45 例作為對照組。 所有患者均符合中華醫學會制訂的《哮喘診治指南》[5]中的診斷標準,并排除有嚴重心、肝、腎、腦疾病患者,排除有神精神系統疾病者。 哮喘急性發作期組44 例:男24 例,女20 例,年齡18~62 歲,平均(45.15±8.27)歲;臨床緩解期組44 例,男23 例,女21 例,年齡17~63 歲,平均(46.35±7.21 歲);對照組45 例,男22 例,女23 例,年齡18~63 歲,平均(47.11±4.26)歲。 兩組患者在年齡,性別等一般資料比較,差異無統計學意義(P >0.05),具有可比性。本研究經醫院關醫學倫理委員會批準,所有患者和/或家屬均知情同意并簽署知情同意書。
1.2 方法
1.2.1 肺功能檢測 對所有患者均采用肺功能儀(日本佳能公司生產,型號:AS-505 型)行肺功能測定,測定指標為:第1 秒用力呼氣末容積(FEV1)、用力肺活量(FVC),并計算第l 秒用力呼氣末容積占用力肺活量的比值(FEV1/FVC%)。
1.2.2 IL-13、TGF-β1、VEGF 檢測 酶聯免疫分析法(ELISA)采用酶聯免疫分析儀(美國伯樂公司生產,Thermo labsystems 1500 型)分別檢測三組患者外周血IL-13、TGF-β1、VEGF 含量。 人血清IL-13、TGF-β1、VEGF 采用ELISA 定量檢測試劑盒均購自武漢博士德生物工程有限公司。 檢測方法按照試劑盒說明書進行操作。
1.3 統計學方法
采用統計軟件SPSS 16.0 對數據進行分析,正態分布計量資料以均數±標準差()表示,多組間比較采用方差分析,兩兩比較采用LSD-t 檢驗。 計數資料以率表示,采用χ2檢驗。 以P <0.05 為差異有統計學意義。
2 結果
2.1 三組血清IL-13、TGF-β1、VEGF 比較及肺功能
結果顯示:急性發作期組患者血清水平IL-13、TGF-β1、VEGF 明顯高于臨床緩解期組和對照組,差異有統計學意義(P <0.05);臨床緩解期組明顯高于對照組,差異有統計學意義(P <0.05)。急性發作期組肺功能顯著低于臨床緩解期組和對照組,差異有統計學意義(P <0.05);臨床緩解期組肺功能顯著低于對照組,差異有統計學意義(P <0.05)。 見表1。
表1 三組血清IL-13、TGF-β1、VEGF 及肺功能情況的比較()
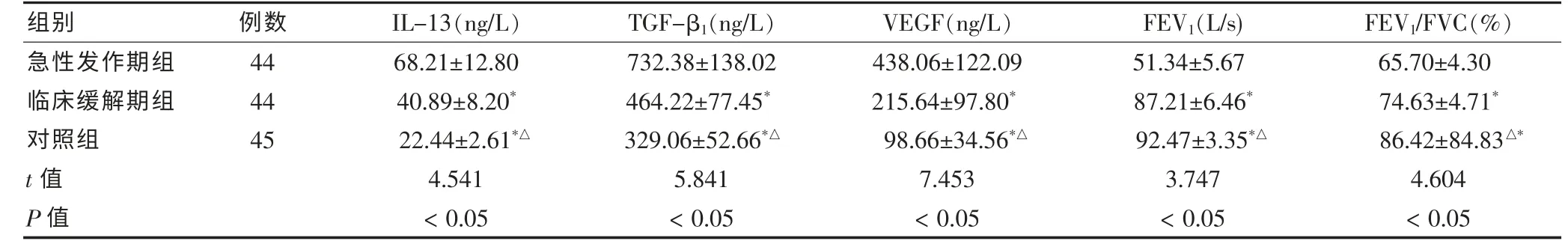
表1 三組血清IL-13、TGF-β1、VEGF 及肺功能情況的比較()
注:與急性發作期組比較,*P <0.05;與臨床緩解期組比較,△P <0.05;IL-13:白介素13;TGF-β1 轉化生長因子β1;VEGF:血管內皮生長因子;FEV1:第1 秒用力呼氣末容積;FEV1/FVC%:第1 秒用力呼氣末容積占用力肺活量的比值
組別 例數 IL-13(ng/L) TGF-β1(ng/L) VEGF(ng/L) FEV1(L/s) FEV1/FVC(%)急性發作期組臨床緩解期組對照組t 值P 值44 44 45 68.21±12.80 40.89±8.20*22.44±2.61*△4.541<0.05 732.38±138.02 464.22±77.45*329.06±52.66*△5.841<0.05 438.06±122.09 215.64±97.80*98.66±34.56*△7.453<0.05 51.34±5.67 87.21±6.46*92.47±3.35*△3.747<0.05 65.70±4.30 74.63±4.71*86.42±84.83△*4.604<0.05
2.2 急性發作期組血清IL-13、TGF-β1、VEGF 之間及與肺功能的相關性分析
血清IL-13、TGF-β1、VEGF 水平互呈正相關(r =0.772、0.662、0.614,P <0.05)、急性發作期組患者血清IL-13、TGF-β1、VEGF 水平與FEV1呈負相關(r =-0.913、-0.895、-0.921,P <0.05),急性發作期組患者血清血清IL-13、TGF-β1、VEGF 與FEVl/FVC%呈負相關(r=-0.935、-0.912、-0.977,P <0.05)。 見表2。

表2 急性發作期組血清IL-13、TGF-β1、VEGF 之間及與肺功能的相關性(r 值)
3 討論
支氣管哮喘的發病機制目前尚不清楚,但目前公認支氣管哮喘是一種變態反應性疾病,氣道炎癥、氣道高反應性和氣流阻塞是其主要特征,尤其炎癥是支氣管哮喘哮喘的本質。支氣管哮喘的常見病理變化是氣道炎癥與氣道重塑,而炎癥因子與生長因子既參與氣道的炎癥反應,也參與了氣道的重塑過程。 目前已有研究表明生化因子IL-13、TGF-β1、VEGF 三者之間的比例失衡可能在支氣管哮喘的發病過程中起著重要作用[6]。
IL-13 是一種重要的炎癥因子,由活化的Th2 細胞分泌。IL-13 具有多種效能。有學者認為IL-13 與氣道的炎癥和免疫調節有關,可以單獨介導引起哮喘[7]。另外, 也有研究證實IL-13 可以通過刺激成纖維細胞[8],使其活化后參與氣道重塑,這個過程可能是IL-13誘導支氣管平滑肌細胞分泌VEGF 和刺激TGF-β1活性增強所導致的。 TGF-β1是一種公認的具有強烈致纖維化作用的細胞因子,在肝、腎、肺等臟器的纖維化中起著重要作用[9-10]。氣道重塑的實質是TGF-β1刺激氣道平滑肌細胞,使氣道平滑肌增生和肥大而導致的。 TGF-β1還可以引起IL-13 等上升而參與氣道炎性反應。 VEGF 又稱血管滲透因子,是血管新生的正調控因子。 VEGF 可以促進血管內皮細胞的增殖并形成新血管,由于VEGF 還可以促進血管通透性增加,蛋白質大分子容易引起外滲形成纖維蛋白原,在呼吸道炎癥和重塑中纖維蛋白原起著重要的不容忽視的作用[11]。 肺泡上皮細胞、氣道平滑肌細胞及血管內皮細胞上VEGF 及其受體均有表達,而且VEGF 的表達受到多種因素的調控,如缺氧就是一個重要的調控因素,除了缺氧,一些Th2 細胞因子,如生長因子IL-4、IL-5、IL-13 和轉化生長因子(TGF-β1、TGF-β2、TGF-β3)等也可以增加氣道平滑肌細胞(ASMC)分泌VEGF[12]。
在本研究中我們發現,急性發作期組患者血清IL-13、TGF-β1、VEGF 水平明顯高于緩解期組和對照組(P <0.05),急性發作期組患者血清IL-13、TGF-β1、VEGF 三者水平互呈正相關,這與以往的研究一致[13-15],說明IL-13、TGF-β1、VEGF 三個細胞因子相互間存在著緊密聯系,在氣道的炎癥與重塑過程中,相互刺激和影響,共同構成了大的網絡中的一環。在本研究中,血清IL-13、TGF-β1、VEGF 水平與FEV1、FEV1/FVC%呈負相關。 提示支氣管哮喘的病情越重,血清IL-13、TGF-β1、VEGF 水平越高。 因此聯合檢測血清IL-13、TGF-β1、VEGF 表達水平是臨床上判斷哮喘患者病情嚴重程度的一項關鍵指標。
綜上所述,支氣管哮喘患者血清IL-13、TGF-β1、VEGF 水平增高,且與支氣管哮喘的嚴重程度相關,呈正相關,提示其參與了炎癥和氣道的重塑過程,下一步可以在信號通路甚至是基因學水平上進行進一步研究,為臨床醫師指導支氣管哮喘患者有效預防和治療提供新的科學的方法,減輕患者的痛苦。
[1] Pinnock H,Ehrlich E,Hoskins G,et al. A woman with asthma:a whole systems approach to supporting self-management [J].NPJ Prim Care Respir Med,2014,16(8):1406.
[2] Friend M,Morrison A. Interventions to improve asthma management of the school-age child [J]. Clin Pediatr (Phila),2014,24(63):66-74
[3] Vieira RP,Silva RA,Oliveira-Junior MC,et al. Exercise deactivates leukocytes in asthma [J]. Int J Sports Med,2014,35(7):629-635.
[4] Meyer N,Akdis CA. Vascular endothelial growth factor as a key inducer of angiogenesis in the asthmatic airways [J].Curr Allergy Asthma Rep. 2013,13(1):1-9.
[5] 中華醫學會呼吸病學分會哮喘學組.哮喘診治指南(2007 年修訂版)[J].中華結核和呼吸雜志,2007,30(1):8-17.
[6] Gao YD,Cao J,Li P,Huang G,et al. Th2 cytokine-primed airway smooth muscle cells induce mast cell chemotaxis via secretion of ATP [J]. J Asthma,2014,54(9):1-7.
[7] Krafft E,Lybaert P,Roels E,et al. Transforming growth factor beta 1 activation,storage,and signaling pathways in idiopathic pulmonary fibrosis in dogs[J].J Vet Intern Med,2014 ,51(21):1666-1675.
[8] Ji H,Tang H,Lin H,et al. Rho/Rock cross-talks with transforming growth factor-β/Smad pathway participates in lung fibroblast-myofibroblast differentiation [J]. Biomed Rep,2014 ,2(6):787-792.
[9] Zou H,Fang QH,Ma YM,et al. Analysis of growth factors in serum and induced sputum from patients with asthma[J].Exp Ther Med,2014,8(2):573-578.
[10] Koczy-Baron E,Kasperska-Zajac A. The role of vascular endothelial growth factor in inflammatory processes [J].Postepy Hig Med Dosw(Online),2014,68(1):57-65.
[11] Kumar P K,Herbert C,Yang M. Role of interleukin-13 in eosinophil accumulation and airway remodeling in a mouse model of chronic asthma [J]. Clinical and Experimental Allergy,2012,15(7):1104-1111.
[12] Wen F Q,Liu X,Manda W. TH2 Cytokine-enhanced and TGF-beta-enhanced vascular endothelial growth factor production by cultured human airway smooth muscle cells is attenuated by IFN-gamma and corticosteroids [J].Journal of Allergy and Clinical Immunology,2003,33(6):1307-1318.
[13] 李甫前.Th1、Th2 細胞及其分泌的相關因子失衡與哮喘患者預后的相關性[J].中國醫藥導報,2014,11(14):20-23.
[14] 盧繼芳,劉振玲.孟魯司特聯合沙美特羅替卡松治療兒童中度哮喘的療效及對IL-13 和TNF-α 水平的影響[J].臨床和實驗醫學雜志,2014,13(8):647-650.
[15] Camoretti-Mercado B,Solway J. Transforming growth factor-β1 and disorders of the lung [J]. Cell Biochemistry and Biophysics,2011,61(1):131-148.

